去細胞羊膜載體復合自體子宮內膜干細胞治療重度宮腔粘連1例報道
黎佳敏,林姣,彭婀娜,黃潔瓊,黃向紅
(湘潭市中心醫院,湘潭 411100)
一、病例資料
患者38歲,因“月經紊亂20年,結婚8年,未避孕未孕8年”診斷為“原發不孕、多囊卵巢綜合征”,在湘潭市中心醫院進行輔助生殖治療。
2012年診斷“多囊卵巢綜合征”,間斷口服達英35(2.04 mg,1次/d)治療,服藥期間月經正常,停藥后月經紊亂。月經初潮12歲,(7/30~90)d,經量正常。
門診促排卵3個周期,有優勢卵泡形成,指導同房未孕。改為卵泡期長方案促排卵,行體外受精-胚胎移植助孕,2014年5月3日移植2枚新鮮胚胎,獲雙胎妊娠(雙絨毛膜雙羊膜囊),孕6+月自然流產,流產后行清宮術,考慮可能是宮頸機能不全導致流產,建議行宮頸環扎術,患者拒絕該手術。2015年10月23日因患者強烈要求,移植2枚凍胚,再次獲雙胎妊娠(雙絨毛膜雙羊膜囊),建議行減胎術及宮頸環扎術,患者拒絕,再次孕6+月自然流產,并行清宮術。清宮術后月經量極少,經期1 d,1片護墊即可。2018年9月至2018年11月擬再次行凍胚移植術,在內膜準備階段,B超監測發現內膜薄、欠連續,考慮宮腔粘連。
2018年12月11日行第一次宮腔鏡手術,同時行宮腔鏡檢+宮腔粘連分離+子宮內膜息肉摘除+取子宮內膜干細胞培養+上球囊+透明質酸鈉宮腔灌注,術中見宮腔失去正常形態、下段封閉(圖1 A),B超引導下分離粘連后,基本恢復宮腔形態,雙側壁及前后壁下段內膜缺失,左側宮角見少許內膜組織,左側輸卵管開口處見一處息肉,術后宮腔深7.5 cm。術后診斷:宮腔粘連,美國生育學會(AFS)宮腔粘連評分為10分,子宮內膜息肉。
2019年1月11日復查宮腔鏡,同時行宮腔粘連分離+子宮內膜息肉摘除+宮腔置入節育器負載去細胞羊膜載體與自體子宮內膜干細胞的復合體(制備方法:收集術前四項陰性并排除其它感染的剖宮產產婦的羊膜,剪裁為10 cm培養皿大小的羊膜片,去細胞處理后凍干保存。使用時,將凍干的去細胞羊膜復蘇,使羊膜完全貼附于培養皿底,按照1×105/cm2的密度接種自體子宮內膜干細胞,37℃、5%CO2培養箱中培養24 h,待細胞完全貼壁,細胞形態會逐漸變成細長梭形,即可使用。此次干細胞細胞量為3×106個)。術中見:宮腔右側致密粘連,右側宮角封閉,左側宮角處見致密粘連帶,累及宮腔范圍1/2,術前雙側宮角及輸卵管開口均不可見(圖1B)。微剪分離宮腔粘連后宮腔形態大致正常,予中號宮型節育器置入宮腔,術后雙側宮角及輸卵管開口均可見,右側壁內膜缺失,腺體開口稍少。術后診斷:宮腔粘連(AFS評分為6分),子宮內膜息肉,宮內羊膜,宮內節育器。術后輔助人工周期治療,月經量明顯改善,經期3 d。
2019年3月5日行第3次宮腔鏡,術中行宮腔粘連分離+取環+羊膜取出+球囊宮腔內放置+自體子宮內膜干細胞宮腔移植(干細胞細胞量為6×106個)+透明質酸鈉宮腔灌注。術中見:右側宮腔中上段致密粘連,宮內節育器嵌頓于粘連帶內,右側壁內膜缺失,前壁中下段內膜缺失(圖1C)。術后診斷:宮腔粘連(AFS評分為6分)。5 d后取出球囊。
2019年4月4日行第4次宮腔鏡。術中見:兩側壁內膜缺失,前后壁及宮底內膜薄并有草莓樣充血,右側宮腔中上段致密粘連累及宮腔范圍<1/3(圖1D),行宮腔粘連分離+透明質酸鈉宮腔灌注。術后抗感染治療,并予替代周期+低分子肝素皮下注射準備子宮內膜。2019年4月19日黃體酮轉化內膜,凍胚移植前1 d行陰道彩超檢查提示內膜達到8.5 mm,C級(圖2)。2019年4月24日移植一枚早期囊胚,移植后12 d測血HCG為616.2 U/L,移植后28 d經陰道B超提示“宮內妊娠,單活胎”。囑孕12~14周產科就診行宮頸環扎術,定期產檢。
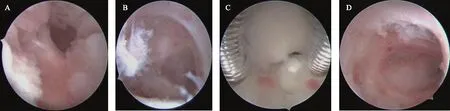
A:第1次宮腔鏡;B:第2次宮腔鏡;C:第3次宮腔鏡;D:第4次宮腔鏡圖1 四次宮腔鏡手術視野

圖2 移植術前經陰道B超結果
二、討論
宮腔粘連又稱Asherman綜合征,多由于宮腔手術操作、宮腔內感染、介入手術、放射線等原因導致子宮內膜基底層被破壞,從而造成宮腔和/或宮頸管粘連,導致患者出現月經異常、不孕甚至反復流產等一系列臨床表現。宮腔粘連會影響子宮內膜容受性,導致不孕并嚴重影響輔助生殖的臨床妊娠率。
宮腔粘連分離術后極易復發,其中輕中度宮腔粘連的復發率約23%,重度宮腔粘連的復發率約62%[1]。手術是治療宮腔粘連的必要手段[2],手術治療的目的是恢復子宮腔正常解剖學形態,擴大宮腔容積,分離或切除瘢痕組織,保護殘留內膜,治愈相關癥狀。但術后預防宮腔粘連復發及幫助子宮內膜恢復和重建更為重要[3]。子宮內膜具有良好的容受性是胚胎著床成功的關鍵因素[4]。因此,宮腔鏡下宮腔粘連分離術后的綜合管理極為重要。目前宮腔粘連術后預防復發及恢復內膜的治療方法主要有:人工周期治療、宮腔內置入節育器、宮腔內置入球囊、藥物改善子宮內膜血液循環治療(如阿司匹林、低分子肝素等)、粒細胞集落因子刺激治療(皮下注射或宮腔灌注等)[5-6]。人工周期需要在子宮腔殘留一定面積的子宮內膜基礎上發揮作用,對于殘留子宮內膜面積不足宮腔面積1/3且出現閉經或點滴經血臨床表現的重度宮腔粘連患者及高齡薄型子宮內膜患者,常規使用人工周期效果欠理想,需要新的思路開拓有效的治療方案[7]。
目前干細胞治療成為多學科的熱點,婦產科也不例外。有研究者構建了宮腔受損的小鼠模型,經干細胞治療后驗證干細胞具有重建子宮內膜及預防宮腔粘連的效果[8],但是用于臨床宮腔粘連患者尚鮮有報道。干細胞可分為全能干細胞和多能干細胞,其中多能干細胞包括胚胎干細胞和成體干細胞,具有很強的多向分化和自我更新潛能[9]。成體干細胞可來源臍帶、臍血、羊膜、胎盤[10],并且廣泛分布于骨髓、肝臟、腎臟、子宮內膜及肌層、輸卵管等多個部位[11]。作為成體干細胞的子宮內膜干細胞在特定誘導條件下可分化為子宮內膜細胞,并且可以多次傳代擴增,且不存在免疫排斥,這些特性都為干細胞治療重度宮腔粘連及幫助子宮內膜修復提供了理論基礎[12]。因自體子宮內膜干細胞容易取材、分離簡單、易體外培養,且具有增殖快、成瘤性低和安全可靠等特點,近年來成為組織器官再生修復的關注熱點[13]。育齡期女性每個月經歷的子宮內膜剝脫和再生提示了子宮內膜干細胞的存在,以及其維持子宮內膜動態平衡和再生的重要作用[14]。尋找上皮和間質來源的干/祖細胞的相關研究已經揭示了人類子宮內膜干細胞的存在,且通過標記滯留法及側群法已經成功分離出具有特定標記物的子宮內膜干細胞[15]。子宮內膜修復的過程極其復雜,包括炎癥反應、血管重建、組織再生和重塑。自體子宮內膜干細胞通過子宮螺旋動脈周圍微環境參與子宮內膜修復過程,且在細胞增殖及凋亡這個平衡中起著重要作用,從而維持內膜的分化和自我更新[16]。很多細胞因子及相關成分參與了協調子宮內膜干細胞發揮作用,例如分泌因子(趨化因子、生長因子受體、激素)、細胞外間質(ECM,如纖維連接蛋白、膠原蛋白),亦包括一些相關物理因子及炎癥、瘢痕、富含激素的環境等[17]。
羊膜來源于人胎盤,是一種由滋養層細胞分化而成的低抗原性、富含間充質干細胞的半透明生物薄膜,能夠同時達到降低粘連和促進內膜修復的作用[18]。凍干羊膜更適合臨床隨時備用,其含有豐富的膠原蛋白和蛋白多糖,可增加羊膜抗拉能力,置入宮腔內可與子宮壁緊密貼合,起到屏障作用和基底膜作用,為細胞生長提供足夠的三維空間結構,同時能促進上皮細胞增殖分化,加速受損子宮內膜愈合和生長,預防宮腔粘連復發[19]。
研究表明,雖然子宮內膜存在干細胞,但是深入子宮基底層的損傷會引起干細胞的丟失或功能異常,導致子宮內膜再生失敗[20]。單純應用羊膜或其它宮腔支架效果欠佳,而子宮內膜干細胞宮腔注射后很難在損傷局部定位,影響療效,故去細胞羊膜載體復合自體子宮內膜干細胞用于宮腔粘連的治療開拓了新的治療思路,可望克服如上不足。目前,去細胞羊膜載體復合自體子宮內膜干細胞應用于宮腔粘連的治療尚未見報道。本文此例重度宮腔粘連患者通過宮腔鏡分離粘連的宮腔,使宮腔形態大致正常后,用去細胞羊膜載體復合自體子宮內膜干細胞法治療,有效修復了子宮內膜并成功臨床妊娠。去細胞羊膜載體復合自體子宮內膜干細胞法利用羊膜的生物屏障作用阻止宮腔粘連的復發,其豐富的細胞因子、膠原蛋白等物質又可促進子宮內膜修復,同時干細胞以羊膜為支架充分爬行到子宮腔各處,分化為子宮內膜各種細胞成分,通過自分泌或旁分泌等作用重建子宮內膜。此應用可作為修復受損子宮內膜的新思路,為宮腔粘連同時存在子宮內膜過薄、缺失的患者帶來了新希望。但是目前干細胞及人羊膜在子宮內膜修復方面的研究尚處在初步階段,缺乏大樣本數據,導致目前尚沒有標準化的干細胞治療方案,需要更多的深入研究來探索其對子宮內膜修復的機制及應用效果,制定出有效的治療途徑和用量,甚至更精準地分離出有效的細胞因子,更有效地修復子宮內膜并預防宮腔粘連的復發。

