具有透明細胞乳頭狀特征的SDH缺陷型腎細胞癌1例并文獻復習
趙 醒,申興斌
琥珀酸脫氫酶(succinatedehydrogenase, SDH)又稱線粒體復合體Ⅱ[1],是三羧酸循環(琥珀酸轉變成延胡索酸)及線粒體呼吸鏈(線粒體電子傳遞鏈)中的重要組成部分。SDH家族包括SDHA、SDHB、SDHC及SDHD,近年研究發現SDH與多種腫瘤相關,常見腎細胞癌、胃腸道間質瘤、副神經節瘤和嗜鉻細胞瘤。SDH缺陷型腎細胞癌具有較強的遺傳性,大部分均與SDHB基因相關,因此目前對線粒體復合物Ⅱ功能異常的定義即免疫組化中SDHB表達缺失。WHO(2016)腎臟腫瘤新分類中,將SDH缺陷型腎癌列為腎癌的新增組織學類型,目前國內外報道較少,尤其是具有顯著透明細胞乳頭狀特征的腫瘤未見相關報道。本文現報道1例具有透明細胞乳頭狀特征的SDH缺陷型腎細胞癌,分析其臨床病理特點、免疫表型、診斷及鑒別診斷,旨在提高認識水平。
1 材料與方法
1.1 臨床資料患者女性,58歲,10年前無明顯誘因出現左側腰痛,呈間斷性脹痛,無轉移、無擴散。最近2個月左側腰痛癥狀較前加重,查泌尿系彩超:左腎實質內可見一大小25.1 mm×21.2 mm×21.3 mm中等稍強回聲結節,邊界清楚,形態規整。CDFI檢查:周邊可見散在的彩色血流,提示左腎實性結節,建議行進一步檢查。泌尿系CT:左腎見一皮質期明顯強化結節影,排泄期病灶強化程度減低;左腎另見一無強化結節影,邊界清,提示左腎占位,考慮惡性。專科檢查:左側腎區叩擊痛,未聞及血管雜音;行腹腔鏡中轉開放左腎部分切除,術后檢查標本可見左腎腫瘤完整切除。
1.2 方法標本經10%中性福爾馬林固定12 h,常規取材,包埋,切片,染色。由主治醫師和主任醫師鏡下觀察。免疫組化采用SP法染色,抗體CK7、CD117、CD10、vimentin、P504S、Ki-67、p53、CAIX、TFE-3、p63、CK(34βE12)、SDHB,均購自北京中杉金橋公司。同時設立陰性對照和陽性對照。
2 結果
2.1 眼觀腎組織1塊,大小3 cm×1 cm×1 cm,切開可見一大小1.5 cm×1.5 cm的腫物,灰黃色,包膜不明顯,邊界較清,質地中等。
2.2 鏡檢低倍鏡下腫瘤組織與周圍正常組織邊界清楚(圖1),大部分區域為管狀、乳頭狀排列,乳頭結構可見真性纖維血管軸心(圖2),未見出血、壞死。高倍鏡下可見大部分細胞具有豐富的透明胞質,小到中等大,立方形(圖3)。核圓形或橢圓形,核仁不明顯,腫瘤細胞核多數位于細胞基底部,少數遠離基膜或纖維血管軸心,核分裂象罕見(圖4)。部分細胞輕度嗜酸性,細胞核膜規則,染色質細膩。
2.3 免疫表型腫瘤細胞CK7(圖5)、vimentin、CAIX、CK(34βE12)均陽性,SDHB(圖6)、CD117、CD10、P504S、p53、TFE-3、p63均陰性,Ki-67增殖指數約5%。
2.4 病理診斷(左腎)具有透明細胞乳頭狀特征的SDH缺陷型腎細胞癌。
3 討論
腎細胞癌的組織學亞型根據胞質、結構、細胞類型等特點進行分類,隨著分子技術的發展和進步,近年出現根據分子遺傳學特征命名的腫瘤,如SDH缺陷型腎細胞癌,在SDH家族的4個成員中,SDHB缺陷最常見,其次是SDHC、SDHD、SDHA,占腎細胞癌的0.05%~0.2%。自2004年首次報道以來,該腫瘤報道較少,尤其是大樣本病例報道。本文現報道1例具有透明細胞乳頭狀特征的SDH缺陷型腎細胞癌,并分析其臨床病理學特點、免疫表型、診斷及鑒別診斷。
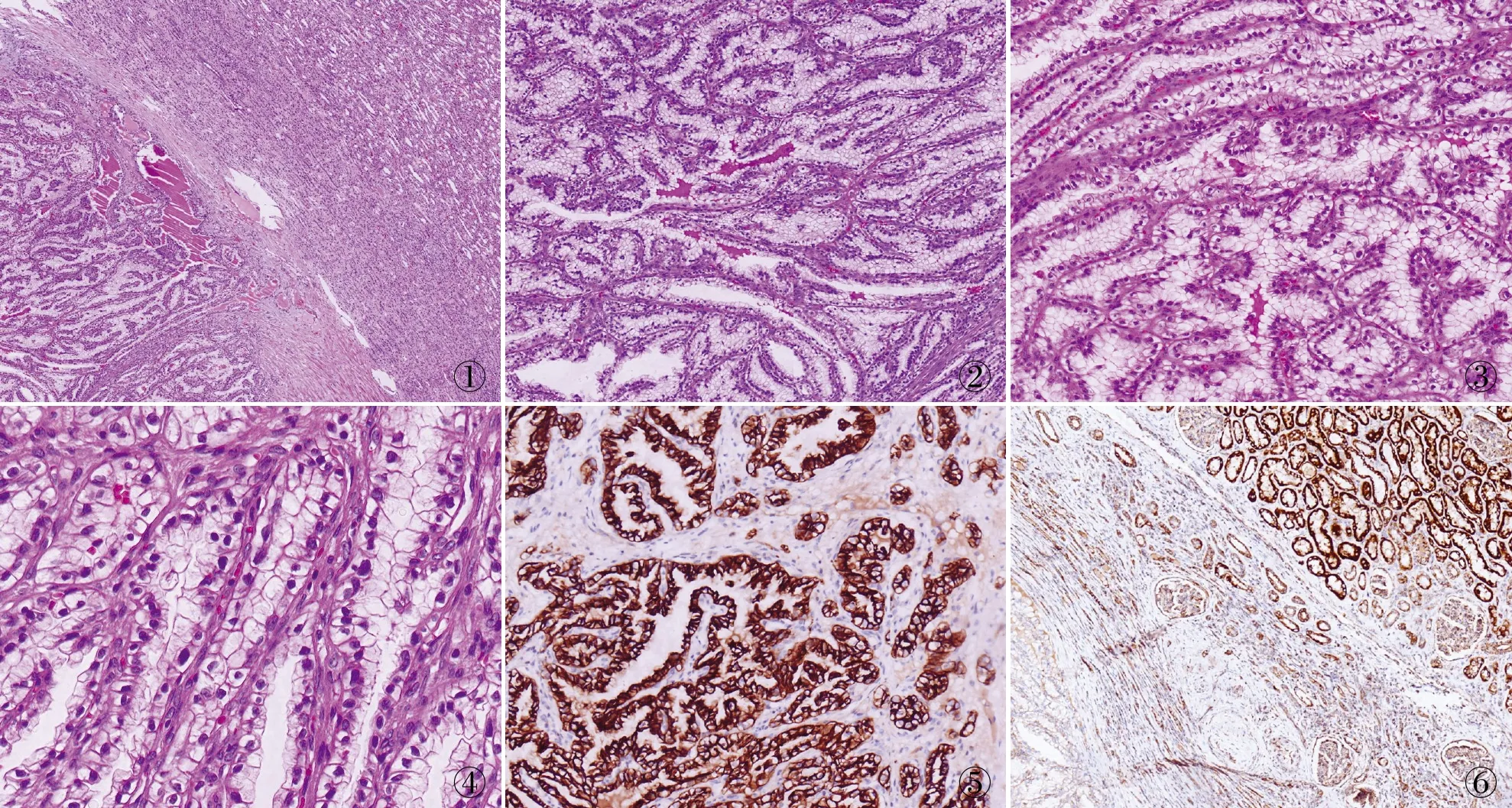
圖1 腫瘤組織與周圍正常組織邊界清楚 圖2 腫瘤細胞呈乳頭狀排列,乳頭結構可見真性纖維血管軸心 圖3 細胞具有豐富的透明胞質,小到中等大小 圖4 腫瘤細胞核多數位于細胞基底部,少數遠離基膜 圖5 腫瘤細胞CK7呈陽性,SP法 圖6 腫瘤細胞SDHB呈陰性,周圍正常腎組織呈陽性,SP法
3.1 臨床表現SDHB基因突變的人群中約14%患者發生腎細胞癌[2],除腎癌以外,SDHB基因突變人群易發生副神經節瘤、嗜鉻細胞瘤及胃腸道間質瘤,15%患者有胃腸道間質瘤病史,15%患者有副節瘤病史。SDH缺陷型人群具有較強的遺傳性,22%患者有家族性腎癌病史,26%患者有家族性副節瘤病史,4%患者有家族性胃腸道間質瘤病史。有文獻報道22歲的SDH缺陷型腎細胞癌女性患者,其母親患有心臟嗜鉻細胞瘤。目前,未發現有效的診斷和治療策略。關于SDH缺陷型腎細胞癌大樣本報道較少,文獻報道的27例患者中最年輕的患者14歲,中位年齡37歲,性別差異不明顯,男性略多發,比例為1.7 ∶1[3-5]。本例患者無家族史及個人相關疾病史。
3.2 病理特征SDH缺陷型腎細胞癌肉眼可見腫瘤呈棕黃色到紅色不等,大部分為邊界清楚的實性腫瘤,亦可出現囊性變。腫瘤平均直徑55 mm,Kumar等[6]報道1例腫瘤直徑10 cm,質地韌,位于左腎下極,部分區域出血呈深棕色,并可見3.2 cm的淡黃色區域。本例患者腫物大小1.5 cm×1.5 cm,灰黃色,包膜不明顯,邊界較清,質地中等。該腫瘤以實性結構為主伴囊性改變。瘤細胞具有特征性的胞質內空泡、包涵體,胞質絮狀、嗜酸性,細胞核為均一的低級別。這些包涵體在超微結構檢查中為巨大的線粒體,腫瘤內常見肥大細胞。高級別組織學特征,如肉瘤樣改變、凝固性壞死、高級別的核等并不常見,且一旦出現即與侵襲性生物學行為有關。最顯著的形態學特征為腫瘤細胞胞質豐富,輕度嗜酸而不均勻,呈空泡狀或絮狀/羽毛狀。細胞核膜規則,染色質細膩(類似神經內分泌腫瘤),但有時也可出現高級別的細胞核形態。此外,透明細胞癌、乳頭狀腎細胞癌、未分類腎細胞癌的形態也有報道[7]。
本例患者鏡下呈透明細胞乳頭狀結構,類似于腎臟的透明細胞乳頭狀癌,但其腫瘤細胞核并不呈線性排列并遠離基膜,而是多數位于細胞基底部或中央。
3.3 免疫表型SDHB陰性是該腫瘤診斷的敏感而特異性標志物。Gill等[8]報道顯示,對27例SDH缺陷型腎細胞癌進行基因檢測,每例患者均可檢測到一種SDH亞基的缺失。即使SDHA、SDHC、SDHD基因突變,也會出現SDHB陰性,但在SDHB、SDHC、SDHD基因突變的病例中,腫瘤細胞SDHB陰性,但SDHA陽性。需警惕部分胞質透明的腎細胞癌有時SDHB染色減弱,而非真陰性;此時不能診斷為SDHB缺陷型腎癌。腫瘤細胞一般表達PAX-8和EMA,僅30%病例CK陽性,CK7多數陰性,CgA、Syn、CD117均陰性。本例患者腫瘤細胞CK7、vimentin、CAIX、CK(34βE12)均陽性,SDHB、CD117、CD10、P504S、p53、TFE-3、p63均陰性,Ki-67增殖指數約5%。
3.4 鑒別診斷SDH缺陷型腎細胞癌可有多種組織學形態,故應與多種腎臟腫瘤鑒別。(1)嗜酸細胞腺瘤:組織學表現為巢狀或管狀結構,細胞有中等至大量嗜酸性、顆粒狀胞質。免疫組化標記CD117、SDHB均陽性,CK7陰性。(2)透明細胞乳頭狀腎細胞癌:腫瘤可呈管狀、乳頭狀、腺泡狀、囊性、帶狀和實性結構,瘤細胞呈立方或矮柱狀,細胞質豐富透明,均一的圓形細胞核呈線性排列并遠離基膜,核仁不明顯,核分級大部分為WHO/ISUP 1級或2級。偶爾局灶可見較大細胞成群,常存在嗜酸性分泌物,CAIX染色呈特征性的杯口狀陽性,SDHB陽性。(3)MiT家族易位性腎細胞癌:t(6;11)腎癌形態學為雙向性,癌組織呈巢狀,由大小兩種上皮細胞組成,其中形態較小的上皮細胞呈巢狀排列并圍繞玻璃樣變的基膜樣物質形成菊形團樣結構,腫瘤周邊常見內陷的腎小管。XP11.2易位相關的腎細胞癌主要由透明細胞構成乳頭樣結構,常伴有嗜酸性顆粒胞質的瘤細胞組成的巢狀結構,腫瘤通常表達TFE-3、CK及HMB-45,基因學檢測顯示Xp11.2染色體易位,導致TFE-3基因融合。
3.5 治療與預后該腫瘤大多數形態溫和,缺乏壞死且預后良好,當腫瘤出現高級別的細胞核特征及凝固性壞死時,預后較差,腫瘤轉移率高達70%。Gill等[8]報道27例SDH缺陷型腎細胞癌患者隨訪0~368個月,平均55個月,33%的患者出現轉移,2例在5.5~30年后復發,4例死于腎細胞癌轉移,組織學分級為WHO/ISUP 3級或4級,或可見凝固性壞死。對于組織學分級高、預后差的患者推薦使用VEGF途徑抑制劑,如多靶向小分子VEGF受體、哺乳動物雷帕霉素(mTOR)或酪氨酸激酶抑制劑等[9]。
總之,SDH缺陷型腎細胞癌是一種新發現的組織學亞型,由于該病為遺傳性疾病,常呈多系統發病,且臨床報道較少,應對患者進行長期隨訪。