小立碗蘚PpCASLUU3基因敲除載體的構建
陳 波,閆慧清,李 莉,曹海鵬,辛健康,姜 山
(貴州師范大學 生命科學學院,貴州 貴陽 550001)
【研究意義】小立碗蘚(Physcomitrellapatens)是葫蘆蘚目(Funariales)葫蘆蘚科(Funariaceae)小立碗蘚屬(Physcomitrium)的蘚類。苔蘚植物是非維管束植物,隸屬于高等植物中較低等的類群,是最早登陸的陸生植物代表[1-3]。細胞凋亡(apoptosis)指為維持內環境穩定,由基因控制的細胞自主有序的死亡。涉及一系列基因的激活、表達以及調控等的作用,并不是病理條件下自體損傷的一種現象,而是為更好地適應生存環境而主動爭取的一種死亡過程。半胱氨酸蛋白水解酶(cysteinyl aspartate specific proteinas, caspase)作為細胞凋亡過程的重要蛋白酶在細胞凋亡的最后實施過程中起決定性的作用,作為多種凋亡程序啟動的執行者,有著非常重要的意義和作用[4]。其對底物的切割使得細胞呈現出凋亡的一系列形態和分子生物學特征:如形成凋亡小體、DNA Ladder、凋亡細胞皺縮等[5-7]。基因敲除技術是研究基因功能的基本手段,Caspase基因功能的研究擬采用基因敲除的技術,而基因敲除技術中載體的構建尤為重要。小立碗蘚基因組已測序完成,其核基因組易于與有同源片段的外源DNA發生高頻率的同源重組,從而使得精確的基因敲除成為可能,為基因功能的研究提供了良好的材料。目前已成為國內外植物分子生物學研究的模式生物[18]。【前人研究進展】雖然植物中沒有Caspase的同源蛋白,但是植物的細胞程序性死亡(programmed cell death,PCD)過程有時能檢測到Caspase的活性,這種酶活性被定義為類Caspase活性(caspase-like activity)[7],命名為類半胱氨酸蛋白酶(Metacaspase)[9],研究顯示,有些植物能夠產生類似Caspase活性的物質,并且這種酶活性能調控PCD過程[10]。在擬南芥(Arabidopsisthaliana)[11]、番茄(Lycopersiconesculentum)[12]和其他植物中均已進行研究報道。【本研究切入點】超敏反應是植物防御反應中細胞程序性死亡的一類。在灰霉菌侵入后,小立碗蘚會激發與類似超敏反應(Hypersensitive response-like,HR-like)的防衛反應,在實驗室(苔蘚分子生物學與運用研究室)前期,通過轉錄組測序結果,比較對照組和灰霉菌處理12 h、1 d、2 d和3 d后小立碗蘚的轉錄組數據,得到23個參與誘導細胞程序性死亡相關差異表達基因。其中PpCASPLUU3基因在灰霉菌侵染后的12 h與其他基因相比,該基因的表達量變化最為明顯,表明PpCASPLUU3基因可能參與了由灰霉菌引起的小立碗蘚類過敏反應。而PpCASPLUU3(GenBank:XM 024524752;類半胱氨酸蛋白酶)存在于小立碗蘚中[13]。對苔蘚植物中PpCASLUU3基因的研究尚未見報道。【擬解決的關鍵問題】構建小立碗蘚PpCASLUU3的敲除載體,為后續研究PpCASLUU3是否參與了灰霉菌引起的小立碗蘚中類過敏反應,對早期登陸植物的防衛防御的進化提供基礎。
1 材料與方法
1.1 材料
1.1.1 試驗材料 小立碗蘚和質粒pTN182(5006 bp,用于構建PpCASLUU3基因敲除載體)由首都師范大學何奕騉教授提供,PTN182質粒中含有nptII,該基因在大腸桿菌中表現為抗卡那霉素。E.coliDH5α(用于外源基因的轉化)由貴陽醫學院提供。E.coliDH5α感受態細胞由貴州師范大學苔蘚分子生物學與運用研究室制備。
1.1.2 試驗儀器 冷凍離心機(湖南湘儀實驗室儀器有限公司,TGL-16K),PCR儀(美國SCILOGEX公司,TC1000-G),恒溫搖床培養箱(上海博迅實業有限公司,THZ-92A),超凈工作臺(蘇州凈化設備公司,SW-CJ-2D),凝膠成像系統(美國Bio-Rad公司,76S /07904),恒溫水浴鍋(上海博迅實業有限公司,HHS),電子天平(美國賽多利斯,TP-214),電泳儀(美國 Bio-Rad公司,A101439),滅菌鍋(上海博迅實業有限公司,YXQ-LS-75)。
1.1.3 主要試劑 DNA提取試劑盒、膠回收試劑盒、EcoR Ⅰ、EcoR Ⅴ、BamH Ⅰ、SmaⅠPremixTaqTM、T4-DNA連接酶、氨芐青霉素(Amp)、1.5K DNA Marker均購于Takara。Plas-mid Mini Kit I試劑盒購于OMEGA biotek,卡那霉素購于美國sigma公司,酵母提取物(yeast ex-tract)和胰蛋白胨(tryptone)購于英國OXOID公司,葡萄糖、氯化鈉、氫氧化鈉及瓊脂等試劑均購于國藥集團化學試劑有限公司。引物的合成和序列測定工作,均委托武漢金開瑞生物工程有限公司完成。
1.2 方法
1.2.1 酶切位點的選擇 在NCBI上檢索(Genebank:XM_024524752.1)得到PpCASLUU3的DNA序列,將PpCASLUU3的DNA序列1414 bp分成上游臂(PpCASLUU3.1、700 bp)和下游臂(PpCASLUU3.2、714 bp)2段,用DNAMAN軟件進行酶切位點分析,結合PTN182載體序列,最終選取EcoR I、EcoR V作為構建載體上游臂的酶切位點,SmaI、BamH I作為下游臂的酶切位點。利用Primer Primer 5軟件設計擴增上、下游目的片段的引物(表1),在引物前端加入酶切位點序列,根據GC含量添加合適的保護堿基[19]。然后送武漢金開瑞生物工程公司合成,作為獲取上游(PCR產物大小為522 bp)、下游(PCR產物大小為548 bp)目的片段的PCR擴增引物。
1.2.2 目的基因的獲取 取培養20 d的小立碗蘚新鮮材料,超純水洗凈,用液氮充分研磨至粉末,參照DNA提取試劑盒說明書提取DNA,以提取的小立碗蘚DNA為模板,PpCASLUU3.1-F、PpCASLUU3.1-R為上游臂引物擴增上游臂片段,同樣,以PpCASLUU3.2-F、PpCASLUU3.2-R為下游臂引物擴增下游臂片段。PCR反應體系如下表2,反應條件:94 ℃預變性5 min,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min,35個循環,72 ℃再延伸10 min,4 ℃保存。將PCR后的產物進行1 %的瓊脂糖凝膠電泳檢測。檢測后根據膠回收試劑盒說明書對目的片段進行割膠回收,獲得目的基因。
1.2.3 PTN182質粒提取 取含PTN182質粒的大腸桿菌加入含卡那霉素的LB液體培養基中37 ℃ 220 r/min過夜培養,取5 mL培養液,根據Plas-mid Mini Kit I試劑盒說明書抽提PTN182質粒。

表1 PpCASLUU3上下游片段擴增的引物序列Table 1 Primer sequences of PpCASLUU3 upstream and downstream segments amplification
注:表中劃橫線部分為酶切位點。
Note: The underlined part in the table was the enzyme cutting site.

表2 PpCASLUU3上下游片段擴增的PCR反應體系Table 2 PCR reaction system of PpCASLUU3 upstream and downstream fragment amplification
1.2.4 PpCASLUU3.1-PMD19-T、PpCASLUU3.2-PMD19-T載體構建 將上述割膠回收的目的基因按表3的連接體系,16 ℃連接30 min,采用CaCl2法制作大腸桿菌感受態細胞[20]。將連接液加入到100 μl的大腸桿菌感受態細胞中,輕搖混勻,冰浴30 min,42 ℃熱激90 s后立即冰浴3 min,加入900 μl不含氨芐青霉素(Amp)的LB液體培養基,37 ℃震蕩培養1 h,12 000 r/min離心1 min,取100 μl上清液重懸沉淀,將重懸的菌液涂布于含Amp抗性的LB平板,放置數分鐘,待菌液干后放入37 ℃恒溫培養箱內倒置培養16 h。待其長出單菌后,挑取單菌于含Amp的LB液體培養基中37 ℃恒溫搖床培養箱220 r/min培養16 h,取2 μl菌液,以表1中的引物做菌液PCR,篩選能擴增出目的片段的菌液,用Plas-mid Mini Kit I試劑盒進行質粒抽提。得到PpCASLUU3.1-pMD19-T質粒,用EcoR I、EcoR V酶切驗證。使用相同的方法得到PpCASLUU3.2-pMD19-T質粒。
1.2.5 PpCASLUU3.1-PTN182載體構建 使用EcoR I、EcoR V同步酶切PpCASLUU3.1-pMD19-T和PTN182原始載體,酶切體系如表4所示,37 ℃酶切3 h后加入5 μl loading buffer進行1 %的瓊脂糖凝膠電泳,割取目的片段大小的條帶及酶切后的PTN182載體回收,然后按表4連接體系進行16 ℃連接16 h,取連接產物5 μl轉入大腸桿菌感受態細胞,轉化方法同1.2.2。取100 μl轉化液涂布于含卡那霉素的LB平板,待菌液干后置于37 ℃恒溫培養箱內倒置培養16 h。挑取單菌于含卡那霉素的LB液體培養基中37 ℃恒溫搖床培養箱220 r/min培養16 h,后取2 μl菌液做菌液PCR篩選,將能擴增出目的片段的菌液進行質粒抽提,酶切驗證,選取陽性質粒送武漢金開瑞生物工程公司測序。

表3 PpCASLUU3.1-pMD19-T及PpCASLUU3.2-pMD19-T載連接體系Table 3 PpCASLUU3.1-pMD19-T and PpCASLUU3.2-pMD19-T vector connection system
1.2.6 PpCASLUU3.1-PTN182-PpCASLUU3.2載體構建 將含有PpCASLUU3.2片段的 PpCASLUU3.2-pMD19-T質粒和PpCASLUU3.1-PTN182質粒分別搖菌過夜,取5 mL培養液進行質粒抽提,PpCASLUU3.2-pMD19-T用SmaI和BamH I進行雙酶切,回收切出片段,與同樣酶切的PpCASLUU3.1-PTN182載體連接,獲得重組質粒PpCASLUU3.1-PTN182-PpCASLUU3.2(圖1),具體方法同1.2.3。
2 結果與分析
2.1 PpCASLUU3.1、PpCASLUU3.2目的基因的獲取
通過設計引物擴增PpCASLUU3.1、PpCASLUU3.2目的基因,將小立碗蘚總DNA經過PCR反應后用瓊脂糖凝膠電泳檢測(圖2)可見:A凝膠圖上1號泳道中的PCR產物的條帶與PpCASLUU3.1目的基因大小條帶相同(500 bp左右),B凝膠圖上的1號泳道中的PCR產物的條帶與PpCASLUU3.2目的基因條帶大小相同(500 bp左右),A、B圖中陰性對照在500 bp左右的位置未出現條帶。表明該引物設計合理,能正常擴增出目的片段,可用于目的基因的獲取。
2.2 PpCASLUU3.1-pMD19-T及PpCASLUU3.2-pMD19-T載體構建
如圖3所示,A中1號泳道為PpCASLUU3.1-pMD19-T質粒用EcoR I、EcoR V酶切后的瓊脂糖凝膠電泳圖,B中1號為PpCASLUU3.2-pMD19-T質粒用BamH I、SmaI酶切后的瓊脂糖凝膠電泳圖,2號均為未經過酶切的原始質粒,兩者質粒酶切后在泳道的相應位置均出現了與目的片段(500 bp左右)大小一致的條帶。說明,PpCASLUU3.1、PpCASLUU3.2片段成功的克隆到pMD19-T載體中。
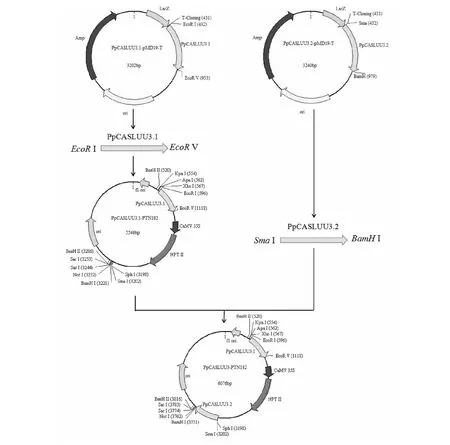
圖1 PpCASLUU3-PTN182載體構建示意圖Fig.1 Schematic diagram of PpCASLUU3-PTN182 vector construction

表4 目的片段及載體體系Table 4 Objective fragment and vector enzyme cutting system

A圖中1為PpCASLUU3.1目的基因,2為陰性對照。 B圖中1為PpCASLUU3.2目的基因,2為陰性對照。 M:Marker= 15 000 bpFig.A1, PpCASLUU3.1; 2. Negative control. Fig.B 1, PpCASLUU3.2; 2. Negative control. M: Marker= 15 000 bp圖2 PpCASLUU3.1、PpCASLUU3.2目的基因的獲取Fig.2 Acquisition of target genes of PpCASLUU3.1 and PpCASLUU3.2
2.3 PpCASLUU3.1-PTN182-PpCASLUU3.2載體構建
通過篩選后的質粒用EcoR I、EcoR V酶切后如上圖4A中的1號泳道所示,用BamH I、SmaI酶切驗證如上圖4B中的1號泳道所示,兩者均能切出與目的片段大小的條帶,2號為對照(未用限制性內切酶酶切),在目的片段大小的位置處無條帶出現,表明PpCASLUU3.1、PpCASLUU3.2目的片段均已插入PTN182中。
由圖5可見,經測序PpCASLUU3.1-PTN182-PpCASLUU3.2 載體的PpCASLUU3.1序列與原始PpCASLUU3.1序列比對,相似高度達100 %。而載體上的PpCASLUU3.2序列與原始PpCASLUU3.2序列比對,相似度為99.63 %,證明PpCASLUU3.1-PTN182-PpCASLUU3.2敲除載體構建成功。

A為PpCASLUU3.1-pMD19-T質粒酶切驗證圖,1表示用EcoR I、EcoR V酶切的質粒,2表示未酶切的PpCASLUU3.1-pMD19-T質粒。B為PpCASLUU3.2-pMD19-T質粒酶切驗證圖,1表示用BamH I、Sma I酶切的質粒,2表示未酶切的PpCASLUU3.2-pMD19-T質粒,M:Marker = 15 000 bpNote: A. Verification diagram of plasmid digestion of PpCASLUU3.1-pMD19-T. 1, plasmid digestion with EcoR I and EcoR V; 2, plasmid digestion of PpCASLUU3.1-pMD19-T without enzyme digestion. B, enzyme digestion verification diagram of PpCASLUU3.2-pMD19-T plasmid, 1, plasmid digested by BamH I and Sma I; 2, plasmid digested by PpCASLUU3.2-pMD19-T without enzyme digestion, M: Marker = 15 000bp圖3 PpCASLUU3.1-pMD19-T、PpCASLUU3.2-pMD19-T質粒酶切驗證圖譜Fig.3 PpCASLUU3.1-pMD19-T and PpCASLUU3.2-pMD19-T plasmid digestion verification diagram

A 圖中1用EcoR I、EcoR V酶切的質粒,2未經過酶切的PpCASLUU3.1-PTN182-PpCASLUU3.2質粒。B圖中1用BamH I、Sma I酶切的質粒,2表示未經過酶切的PpCASLUU3.1-PTN182-PpCASLUU3.2質粒A, plasmid 1 was digested by EcoR I and EcoR V; 2, undigested PpCASLUU3.1-PTN182-PpCASLUU3.2 plasmid. B, plasmid 1 was digested by BamH I and Sma I; plasmid 2 was undigested PpCASLUU3.1-PTN182-PpCASLUU3.2圖4 PpCASLUU3.1-PTN182-PpCASLUU3.2質粒酶切驗證圖譜Fig.4 PpCASLUU3.1-PTN182-PpCASLUU3.2 plasmid digestion verification diagram

圖5 PpCASLUU3.1與PpCASLUU3.2插入片段測序Fig.5 PpCASLUU3.1 and PpCASLUU3.2 insert fragment sequencing results
3 討 論
隨著生物技術的發展,構建敲除載體的方法也越來越多,如Gateway、in-fusion、TA克隆技術等。Gateway技術是一種快速構建載體的方法,主要利用噬菌體體外位點特異性重組構建載體,其特點是反應時間短,不需要限制性內切酶和連接酶參與便可完成[21]。in-fusion是一種快速將片段與載體進行無縫連接的方法,能夠一次性插入多個片段,無需酶切和連接步驟,操作簡單,轉化率高等特點[22]。但以上兩種方法成本都較高[21]。而TA克隆技術(TA cloning)是利用Taq聚合酶具有末端轉移酶(TdT)活性,但卻不具有3′和5′端外切酶校準活性的特點,可在PCR產物的3′端加上一個非模板依賴堿基A。pMD19-T載體的3′攜帶一個堿基T。能高效地與帶A尾的PCR產物連接,極大地提高了克隆的效率。TA克隆是目前克隆PCR產物最簡便、快捷的方法[23]。鑒于此,試驗選用了TA 克隆技術將PCR產物直接克隆到pMD19-T中,測序驗證后將其酶切、連接到PTN182載體中,此法的酶切效率比直接酶切PCR產物高,可獲得較純的酶切片段,使得后續實驗更為順利。在獲取PCR產物時,以小立碗蘚DNA為模板,使用引物設計軟件設計的小立碗蘚PpCASLUU3基因上、下游同源臂的引物,利用PCR技術擴增得到小立碗蘚PpCASLUU3基因的上、下游同源臂,如圖2A、B中的2號泳道(對照)出現的條帶均低于250 bp,這可能是引物自身結合形成的二聚體所導致,試驗采取割膠的方法回收PCR產物,此結果對后續試驗無影響。
在載體構建過程中,酶切位點的選擇尤為關鍵,試驗在同一載體中分2次插入,進行酶切位點分析的時候應將2條片段同時放入DNAMAN軟件中進行分析,避免所選擇的酶在另一片段中存在作用位點。盡量選擇一些能共用Buffer、作用溫度相同的酶,這樣可以進行同步酶切,相對于分步酶切可節約大量時間。限制行內切酶在識辨太近、以及共用堿基對的酶切位點時會出現錯誤,所以在選擇酶切位點時應盡量避開兩個酶切位點之間堿基相隔少、共用堿基對這兩者因素,因此在選擇載體的酶切位點時需避開以上述情況,保證載體能夠充分的被切開。
構建載體時若采用內切酶直接切割PCR產物的方式進行載體構建,得到的陽性克隆極少,載體構建效率低下。而采用此法后,得到的陽性克隆明顯增多,載體構建的效率得到極大的提升。
4 結 論
用T4-DNA連接酶將酶切得到的目的片段與相同酶切后的PTN182載體連接,通過PCR陽性檢測、酶切和測序驗證等結果證明PpCASLUU3.1-PTN182-PpCASLUU3.2敲除載體構建成功。該載體的構建成功,為小立碗蘚中PpCASLUU3基因敲除提供了條件,為PpCASLUU3基因功能的研究奠定了基礎。

