奧美沙坦酯對阿霉素腎病大鼠klotho蛋白表達及氧化應激的影響
高 華,張 靜,周忠涵,劉麗秋
(青島大學附屬醫院 腎病科,山東 青島266003)
Klotho基因是于1997年被發現的一種“抗衰老”基因,表達在多種組織,如腎臟、甲狀旁腺、腦、卵巢、胰腺等,腎臟(主要是腎小管上皮細胞)和腦脈絡膜為其高表達部位[1]。Klotho基因編碼的klotho蛋白(KL)有膜型及分泌型兩種形式,膜型KL(mKlotho)是I型跨膜蛋白,主要作為纖維細胞生長因子-23(FGF-23)的協同受體發揮鈣磷代謝調節作用[2];分泌型KL(sKlotho)可以在血液及體液中被檢測到,其除了具有mKlotho的鈣磷調節作用外,還具有抗氧化應激、抗炎癥反應、抗細胞凋亡、抗纖維化及抑制血管鈣化等多種保護功能[3]。動物實驗提示腎臟klotho基因表達的下調在血管緊張素II(Ang II)誘導的腎臟損害中起重要作用[4]。Ang II受體拮抗劑(ARB)可以阻斷Ang II與AT1受體結合從而阻止血管收縮,減少血管加壓素和醛固酮釋放,減少腎臟水鈉重吸收,減緩心臟血管、腎臟細胞的生長,但其在減少尿蛋白、延緩腎病進程的作用及具體機制方面的研究較少。奧美沙坦酯是臨床中常用的ARB類藥物,本研究將阿霉素腎病模型大鼠作為研究對象,探討奧美沙坦酯對阿霉素腎病大鼠KL表達及氧化應激的影響。
1 材料與方法
1.1 實驗材料
1.1.1一般材料 清潔級雄性Wistar大鼠35只,體質量240±12 g,購自北京維通利華實驗動物技術有限公司,許可證號 SCXK(京)2016G006,飼養于青島大學醫學院動物房。
1.1.2儀器試劑 鹽酸阿霉素(MedChemExpress),奧美沙坦酯[第一三共制藥(上海)有限公司],兔抗鼠anti-klotho多克隆抗體(英國Abcam),β-actin(北京 博奧森),Trizol試劑(美國Invitrogen),cDNA 反轉錄試劑盒和RT-PCR試劑盒(北京 Takara),免疫組化試劑盒(北京 中杉金橋),DAB顯色試劑盒(福州 邁新),蘇木精-伊紅染色試劑(北京 索萊寶),Olympus AU640日立全自動生化分析儀(日本Olympus公司)。
1.2 試驗方法
1.2.1阿霉素腎病模型建立及實驗動物分組 大鼠適應性喂養1周后,隨機分為模型組(25只)和正常對照組(NC組)(10只)。模型組給予一次性尾靜脈注射阿霉素6.5 mg/kg造模,對照組大鼠注射等體積的生理鹽水。存活的大鼠造模1周后放入代謝籠留取24 h尿,測定尿蛋白含量。模型組24 h尿蛋白>100 mg/24 h,提示造模成功。共有22只大鼠造模成功,隨機將模型組分為阿霉素腎病組(ADR組)、奧美沙坦酯干預組(OLM組),每組11只。
1.2.2給藥方法 造模成功后,OLM組每日給予奧美沙坦酯10 mg/(kg·d)灌胃[5],NC組與ADR組每日給予等量生理鹽水灌胃。每日灌胃連續8周,每周稱重1次,調整藥物用量。試驗期間各組大鼠分籠喂養,標準飲食,自由飲水。
1.2.3標本的制備 連續灌胃8周后,各組大鼠放入代謝籠,留取24 h尿液,測定尿蛋白含量。標本的收集過程中及時清理黏附在代謝籠內壁的食物殘渣和大鼠糞便,以排除其對尿蛋白定量測定的影響。用10%水合氯醛3.5 ml/kg腹腔麻醉,下腔靜脈取鮮血3-5 ml,3 000 r/min離心10 min后取血清移入EP管中,-20℃保存;同時取出雙側腎臟組織,左側腎臟由液氮冷藏快速轉移至-80℃冰箱,留作West blot和實時熒光定量PCR(q-PCR),右側腎臟組織放入10%中性甲醛轉移至4℃冰箱保存,用于蘇木精-伊紅染色和免疫組織化學染色。
1.2.4一般項目的檢測 觀察各組大鼠精神狀態、攝食、大小便、體型等。全自動生化分析儀檢測大鼠24 h尿蛋白、血清白蛋白、甘油三酯、總膽固醇、尿素氮、肌酐水平,以上實驗重復3次,取均值。
1.2.5Klotho mRNA、KL、超氧化物歧化酶(SOD)和丙二醛(MDA)水平的測定 取-80℃冰箱保存的左側腎組織,采用q-PCR檢測KL mRNA的表達;Western blot檢測KL的含量,用ImageJ軟件分析KL的相對表達量;采用羥胺法檢測大鼠腎組織中SOD活性,比色法檢測MDA含量。以上檢測均嚴格按照試劑盒說明進行操作。所有實驗重復3次,取均值。
1.2.6組織病理學觀察 取4℃冰箱保存的右側腎組織,包埋制成3 μm石蠟切片,切片脫蠟、復水后經蘇木精-伊紅染色、脫水、透明、封片,光鏡下觀察腎小球和腎小管間質形態學改變。
1.3 數據處理
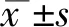
2 結果
2.1 一般情況
造模后NC組精神狀態、飲食、大小便、體重等生長發育情況良好;ADR組及OLM組逐漸出現精神萎靡、脫毛、體重減少、陰囊水腫等癥狀,ADR組較OLM組癥狀明顯,至第8周,ADR組大鼠死亡2只。
2.2 各組大鼠24 h尿蛋白及血清生化指標測定
與NC組相比,ADR組、OLM組24 hUPr、TC、TG明顯升高,ALB明顯降低,且ADR組差別更明顯,差異具有統計學意義(P<0.05);三組間BUN、SCr水平差異無統計學意義(P>0.05)(見圖1)。
2.3 各組大鼠KL mRNA、KL表達和氧化應激因子水平
如圖2所示,與NC 組相比,ADR組、OLM組大鼠腎組織中KL mRNA的表達和SOD活性明顯降低,MDA水平上升,差異具有統計學意義(P<0.05);與ADR組相比,OLM組大鼠腎組織中KL mRNA的表達和SOD活性明顯升高,MDA水平明顯下降,差異具有統計學意義(P<0.05)。Western blot(圖3)顯示:ADR組及OLM組腎組織KL表達均低于NC組,但OLM組KL表達高于ADR組,差異具有統計學意義(P<0.05)。
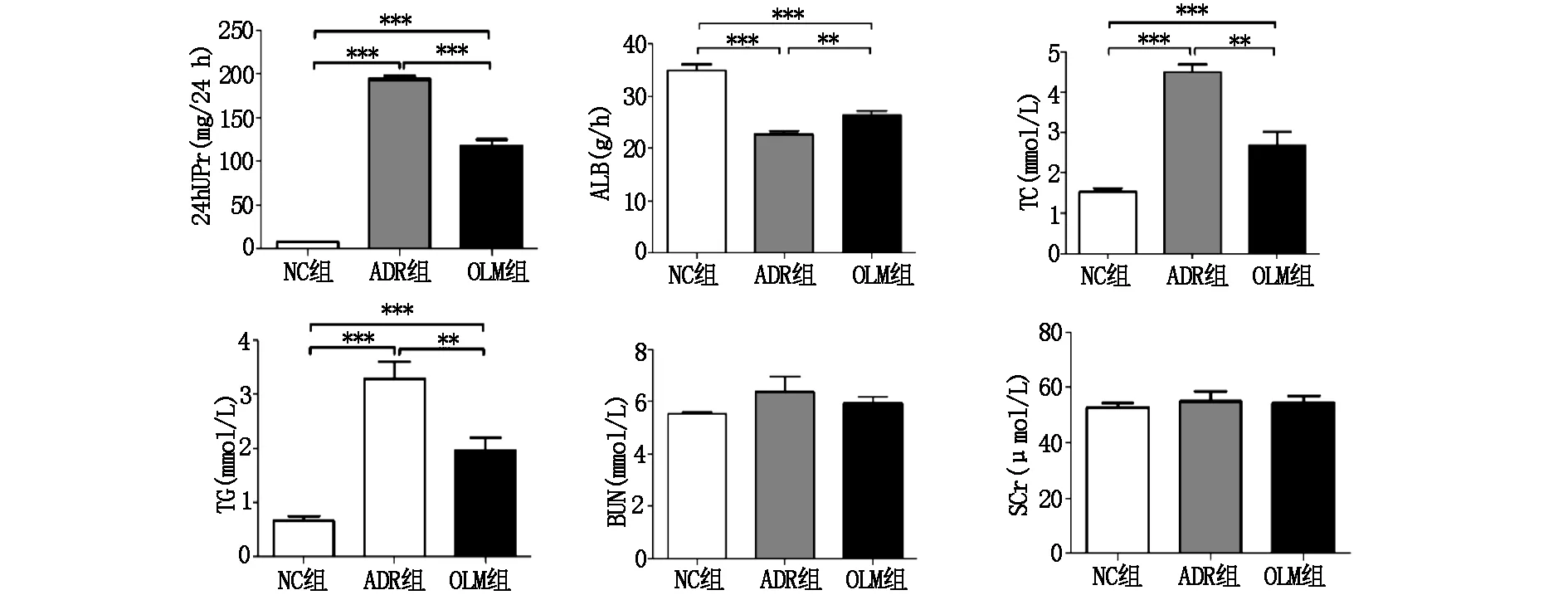
圖1 各組大鼠24 h尿蛋白、血清生化指標水平
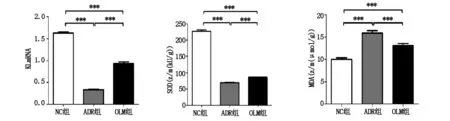
圖2 各組大鼠KL mRNA表達、SOD活性及MOD水平

圖3 各組大鼠大鼠腎組織KL的表達量
2.4 24hUPr與KL表達、SOD活性、MDA水平的相關性
24hUPr與KL水平呈負相關(r=-9728,P<0.0001),與SOD活性呈負相關(r=-0.9766.P<0.0001),與 MDA含量呈正相關(r=0.9322,P<0.0001) (見圖4)。
2.5 各組大鼠腎臟形態變化
如圖5,HE染色結果顯示,NC組腎小球、間質形態基本正常;ADR組可見球囊粘連,伴系膜區擴大、基質增生,腎小球硬化明顯,腎小管上皮細胞明顯萎縮,可見空泡及顆粒變性,腎小管內可見蛋白管型,間質血管腫脹明顯,間質內可見炎性細胞浸潤;OLM組大鼠腎小球病理改變較ADR組明顯減輕。
3 討論
阿霉素腎病模型大鼠的病理改變類似于人類局灶節段性硬化(FSGS)引起的慢性進展性腎臟病[6],臨床上主要表現為持續性大量蛋白尿、低蛋白血癥、高脂血癥、水腫及腹水等,是目前公認的能較好模擬人類慢性腎臟病的動物模型,被廣泛應用于研究慢性腎病潛在的機制及治療策略[7]。
Aizawa等[8]報道在慢性腎病中,腎臟klotho基因的表達呈下調趨勢,這提示KL可能是作為一種腎臟的保護性因子,參與了延緩慢性腎病的進展。本實驗中,ADR組及OLM組大鼠與NC組相比,KL表達量明顯降低,24hUPr、TC、TG明顯升高,腎小球、間質病變明顯,OLM組較ADR組上述改變明顯減輕,這與Aizawa的研究結果相一致,KL確實可以延緩腎病的進展。多項國內外研究顯示,KL對腎臟的保護作用主要體現在以下幾個方面:①調節鈣磷代謝:近年來有研究表明,FGF-23/KL軸在慢性腎臟病礦物質與骨代謝中起著關鍵的作用,FGF-23通過KL發揮生物學作用[9]。②抗氧化應激:關于KL抑制氧化應激的研究發現,sKlotho能夠通過增強SOD的表達,減少ROS的產生,從而抑制氧化應激。也有研究[10]指出,胰島素/胰島素樣生長因子-1(insulin/insu1in-like growth factor-1,IG-1)調控的FoxO蛋白是KL的靶點之一。有動物研究結果表明,KL-FoxO-SOD-ROS是腎臟內抗氧化應激的信號機制[11]。本實驗中,OLM組大鼠較ADR組KL表達、SOD活性明顯升高,MDA明顯降低,提示KL能夠增強SOD的表達,抑制氧化應激,與已有相關研究結果相同,但其是通過KL-FoxO-SOD-ROS途徑,抑或通過其他尚未發現的途徑,發揮抑制氧化應激作用,仍需進一步驗證。③抗炎癥反應:Zeng等[12]的研究證實,在衰老導致的腎臟損傷和炎癥反應中,高表達的KL能夠通過調控RIG-I/NF-κB信號通路來實現抗炎作用。④抗凋亡作用:在急性腎損傷的動物模型研究中顯示,給予外源性的sKlotho,能夠顯著抑制腎小球細胞的凋亡,這一作用可能是通過增強熱休克蛋白70(Hsp70)的表達來實現的[13]。⑤抗纖維化:國內學者證實補充外源性KL或上調KL的表達可以顯著延緩腎間質纖維化的進程。研究表明KL可能通過影響MMP-9、TIMP-1和PAI-1基因的表達而調控ECM降解過程,也可能通過抑制TGF-β1與其II型受體的結合,抑制TGF-β1的信號轉導通路[14],進而減緩腎間質纖維化的進程。KL還可以抑制Wnt/β-catenin[15]、ERK1/2-p38[16]激酶信號轉導途徑,抑制腎組織纖維化。⑥抑制血管鈣化:KL通過加強FGF-23活性促進腎臟對磷的排泄,調節磷代謝,延緩血管鈣化的發生[17];體外實驗證明,KL也可以直接抑制磷誘導的血管平滑肌細胞鈣化,阻礙血管平滑肌細胞向成骨細胞的轉化[18]。
圖4 24hUPr與KL表達、SOD活性、MDA水平的相關性
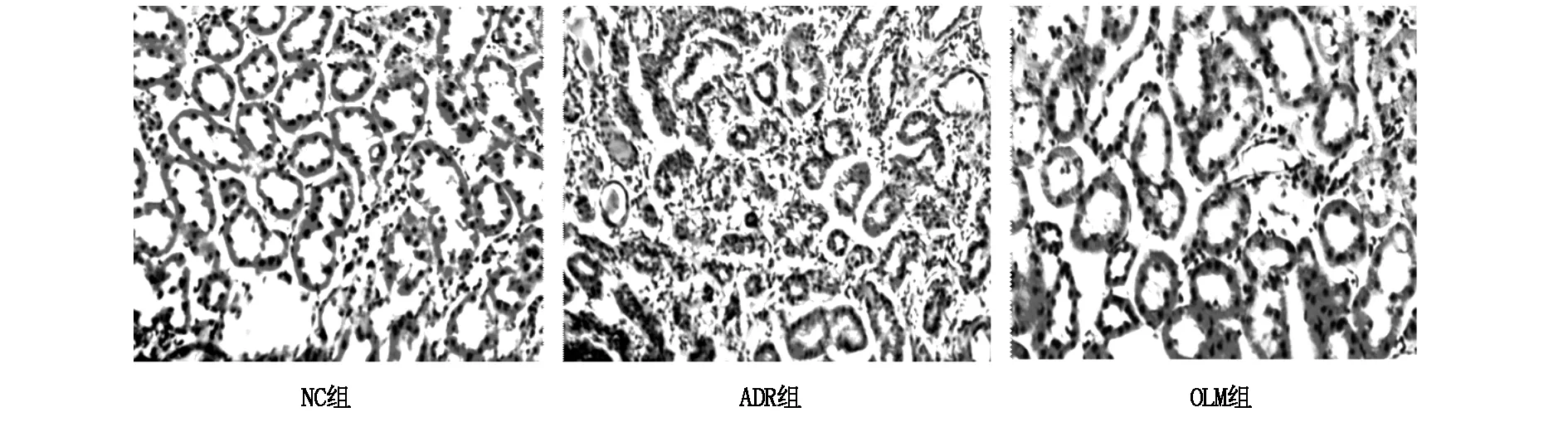
圖5 各組大鼠腎臟HE染色(×400)
目前KL水平降低的原因尚不完全清楚,可能與氧化應激損失、微炎癥狀態、鈣磷代謝紊亂、Ang II的作用及血管內皮功能紊亂等有關。Ishizaka等[19]認為Ang II介導了KL的表達下調,且該作用是Ang II 1型受體依賴性的。奧美沙坦酯是一種新型的ARB類藥物,通過選擇性阻斷Ang II與血管平滑肌AT l受體的結合而阻斷Ang II,口服后在小腸內完全去酯轉化為活性代謝產物奧美沙坦,不需經過肝細胞色素CYP-450酶代謝。奧美沙坦可以與AT1受體的2個位點結合,一個是-OH組,另一個是-COOH組,即所謂的“雙鏈占領”,而其他的ARB類其他藥物只能與AT1的-OH組結合[20,21]。奧美沙坦酯高度選擇性決定了其與AT1受體的高親和力和持久穩定的作用,因其獨特的藥代動力學和藥效動力學特性而被廣泛應用于臨床。研究表明,腎臟RAAS的過度激活與許多腎臟疾病有關,RAAS過度激活的主要效應包括氧化應激、NF-κB激活、纖維母細胞增殖等[22]。OLM組較ADR組24hUPr、TC、TG水平明顯降低,且腎臟病理改變明顯減輕,證實奧美沙坦酯可以降低尿蛋白,減緩大鼠腎臟損害進展。有研究[5,23]顯示,ARB類藥物可提高大鼠KL的表達,抑制氧化應激。本實驗中,OLM組大鼠較ADR組KL表達上調,SOD活性明顯升高,MDA水平明顯降低,氧化應激反應明顯減弱。綜上,OLM很可能是通過上調KL的表達,抑制氧化應激,從而延緩腎病的進展。
眾多研究[24]顯示,在慢性腎臟病的早期即可檢測到KL的降低,而且隨著腎功能不全的進展,其降低趨勢也越發明顯。KL的減少在一定程度上反映了CKD患者腎臟損傷的程度,有可能作為腎功能損傷的血清學標志物。同時,KL的減少在一定程度上促進了慢性腎臟病患者病情進展,有可能成為CKD患者預測腎功能惡化的標志物之一。關于KL延緩腎臟疾病進展的具體機制、通路研究極其重要,奧美沙坦酯如何上調KL表達,改善腎臟功能的具體機制目前尚不明確,還需進一步的研究。

