乙酰紫草素聯合奧沙利鉑對人結腸癌HT29 細胞增殖及凋亡的影響
趙景明,李 惠,李國峰
(長春中醫藥大學附屬醫院,吉林 長春 130000)
結腸癌為消化道高發腫瘤,致死率高居惡性腫瘤的第2 位[1],該疾病早期癥狀不明顯,多數患者確診時即為晚期,失去了手術的最佳時機,化療是主要治療手段,但其較大的毒副作用及耐藥性而難以讓人滿意[2]。乙酰紫草素為紫草主要活性成分,對黑色素瘤B16F10、骨肉瘤S180、Lewis 肺癌及胃癌細胞SGC-7901 等均有較好的抑制作用[3-6]。研究發現,中藥聯合化療藥物能提高抗腫瘤療效,顯著降低化療藥物的毒副作用[7],因此,本研究探討乙酰紫草素聯合奧沙利鉑對人結腸癌HT29 細胞增殖及凋亡的影響。
1 材料
1.1 試劑與藥物 乙酰紫草素(成都德思特生物技術有限公司,批號20160518,純度>98%);奧沙利鉑(美國Sigma 公司,批號20160608);MTT檢測試劑盒(美國Sigma 公司,批號20160921);Annexin V-FITC /PI(上海翊圣生物科技有限公司,批號 40302ES60);逆轉錄試劑盒(批號20161125)、實時定量PCR 檢測試劑盒(批號20160917)(日本TaKaRa 公司);p-PI3K(批號ab32089)、p-Akt(批號ab38449)、GAPDH 抗體(批號ab8245)購自英國Abcam 公司。
1.2 細胞 人結腸癌HT29 細胞,來源于中國科學院上海細胞庫。
1.3 儀器 WD-2102A 型全自動酶標儀(北京六一儀器廠);FACS Canto II 流式細胞儀(美國BD公司);ABI 7500 快速實時熒光定量PCR 儀(美國ABI 公司);EBX-700 蛋白電泳轉印系統(上海書俊儀器設備有限公司)。
2 方法
2.1 細胞增殖抑制率檢測 常規條件下,將HT29 細胞培養至對數生長期,調整細胞濃度為1×105/mL,以每孔200 μL 接種于96 孔細胞培養板中,分為空白組、乙酰紫草素組(10 μmol/L)、奧沙利鉑組(1 μmol/L)和聯合給藥組(10 μmol/L 乙酰紫草素+1 μmol/L 奧沙利鉑),各組的藥物劑量設置依據于徐錦程[8]、薛德冬等[9]報道,并結合預實驗。細胞培養箱中培養24 h,棄去培養液,加入含有相應終濃度藥物的完全培養基處理24、48、72 h,測定490 nm 處光密度值(OD),細胞增殖抑制率=(1-OD給藥組/OD空白組)×100%。
2.2 細胞凋亡率檢測 常規條件下,將HT29 細胞培養至對數生長期,以每孔1×106個細胞接種于6 孔細胞培養板中,分為空白組、乙酰紫草素組(10 μmol/L)、奧沙利鉑組(1 μmol/L)和聯合給藥組(10 μmol/L 乙酰紫草素+1 μmol/L 奧沙利鉑),細胞培養箱中培養24 h,棄去培養液,加入含有相應終濃度藥物的完全培養基繼續培養48 h。4 ℃下離心收集細胞,并在預冷的磷酸鹽緩沖液中重懸細胞,加入5 μL Annexin V-FITC /PI 溶液,避光孵育20 min 后在流式細胞儀中檢測,Cell Quest 軟件分析細胞凋亡率。
2.3 細胞凋亡相關基因檢測 按“2.2”項下方法處理細胞后收集,TRIzol 提取細胞總RNA,逆轉錄法獲取cDNA,實時定量PCR 反應體系為6 μL蒸餾水、2 μL cDNA、1 μL 正向引物、1 μL 反向引物、10 μL 2×SYBR Green Mix。采用2-△△Ct法,以GAPDH 為內參基因,引物由上海基爾頓生物公司合成,序列見表1。

表1 引物序列Tab.1 Primer sequences
2.4 細胞PI3K/Akt 通路相關蛋白檢測 按“2.2”項下方法處理細胞后收集,加入適量RIPA裂解液提取細胞總蛋白。BCA 法測定細胞總蛋白濃度,確定蛋白上樣量后,經12% SDS-PAGE 凝膠電泳,半干法轉印至PVDF 膜上,加入稀釋后的p-PI3K、p-Akt 及GAPDH 抗體(均為1∶2 000),4 ℃下孵育過夜,加入對應二抗,室溫下孵育0.5 h。洗膜后顯色、曝光、拍照,分析各條帶光密度值,并計算蛋白相對表達量。
2.5 統計學分析 采用SPSS 17.0 軟件進行處理。計量資料以(±s)表示,多組間比較采用單因素方差分析,兩兩比較采用Bonferroni 法。以P<0.05表示差異具有統計學意義。
3 結果
3.1 乙酰紫草素聯合奧沙利鉑對HT29 細胞增殖的影響 HT29 細胞經乙酰紫草素、奧沙利鉑和聯合給藥處理24、48、72 h 后,細胞增殖抑制率均增加(P<0.05);與乙酰紫草素組比較,奧沙利鉑組的細胞增殖抑制率增加(P<0.05);聯合給藥組的細胞增殖抑制率高于乙酰紫草素組及奧沙利鉑組(P<0.05)。見表2。
表2 乙酰紫草素聯合奧沙利鉑對HT29 細胞增殖的影響(±s,n=5)Tab.2 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell proliferation(±s,n=5)
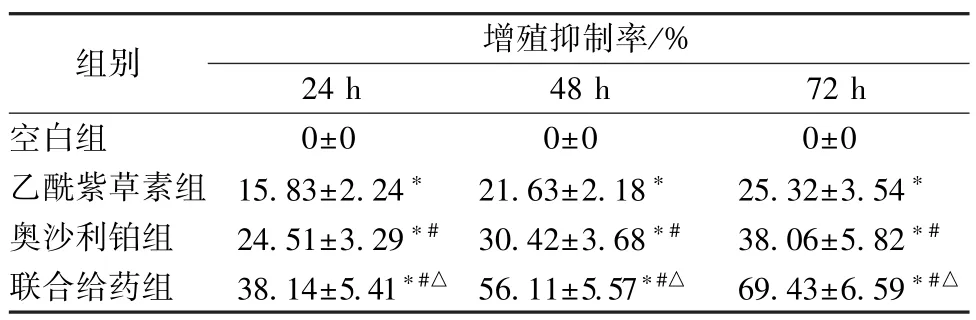
表2 乙酰紫草素聯合奧沙利鉑對HT29 細胞增殖的影響(±s,n=5)Tab.2 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell proliferation(±s,n=5)
注:與空白組比較,?P<0.05;與乙酰紫草素組比較,#P<0.05;與奧沙利鉑組比較,△P<0.05。
3.2 乙酰紫草素聯合奧沙利鉑對HT29 細胞凋亡率的影響 HT29 細胞經乙酰紫草素、奧沙利鉑和聯合給藥處理48 h 后,細胞凋亡率均增加(P<0.05);與乙酰紫草素組比較,奧沙利鉑組的細胞凋亡率增加(P<0.05);聯合給藥組的細胞凋亡率高于乙酰紫草素組及奧沙利鉑組(P<0.05)。見圖1。
3.3 乙酰紫草素聯合奧沙利鉑對HT29 細胞Ki-67、Bcl-2 及BaxmRNA 表達的影響 HT29 細胞經乙酰紫草素、奧沙利鉑和聯合給藥處理48 h 后,BaxmRNA 表達增加,而Ki-67、Bcl-2 mRNA 表達降低(P<0.05);與乙酰紫草素組比較,奧沙利鉑組BaxmRNA 表達增加,而Ki-67、Bcl-2 mRNA 表達降低(P<0.05);聯合給藥組對BaxmRNA 表達的促進作用,Ki-67、Bcl-2 mRNA 表達的抑制作用最強(P<0.05)。見表3。
表3 乙酰紫草素聯合奧沙利鉑對HT29 細胞Ki-67、Bcl-2及Bax mRNA 表達的影響(±s,n=5)Tab.3 Effects of acetyl shikonin combined with oxaliplatin on the mRNA expressions of Ki-67,Bcl-2 and Bax in HT29 cells(±s,n=5)
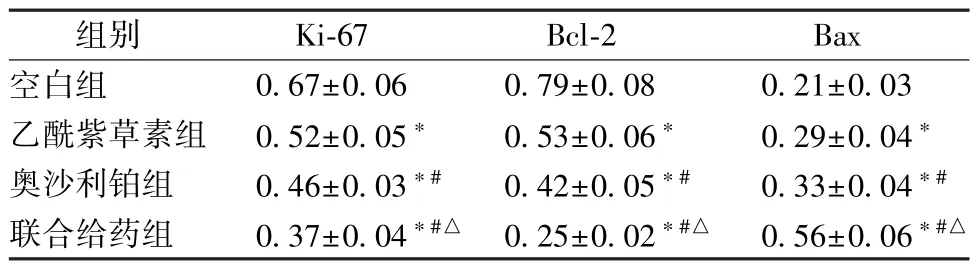
表3 乙酰紫草素聯合奧沙利鉑對HT29 細胞Ki-67、Bcl-2及Bax mRNA 表達的影響(±s,n=5)Tab.3 Effects of acetyl shikonin combined with oxaliplatin on the mRNA expressions of Ki-67,Bcl-2 and Bax in HT29 cells(±s,n=5)
注:與空白組比較,?P<0.05;與乙酰紫草素組比較,#P<0.05;與奧沙利鉑組比較,△P<0.05。
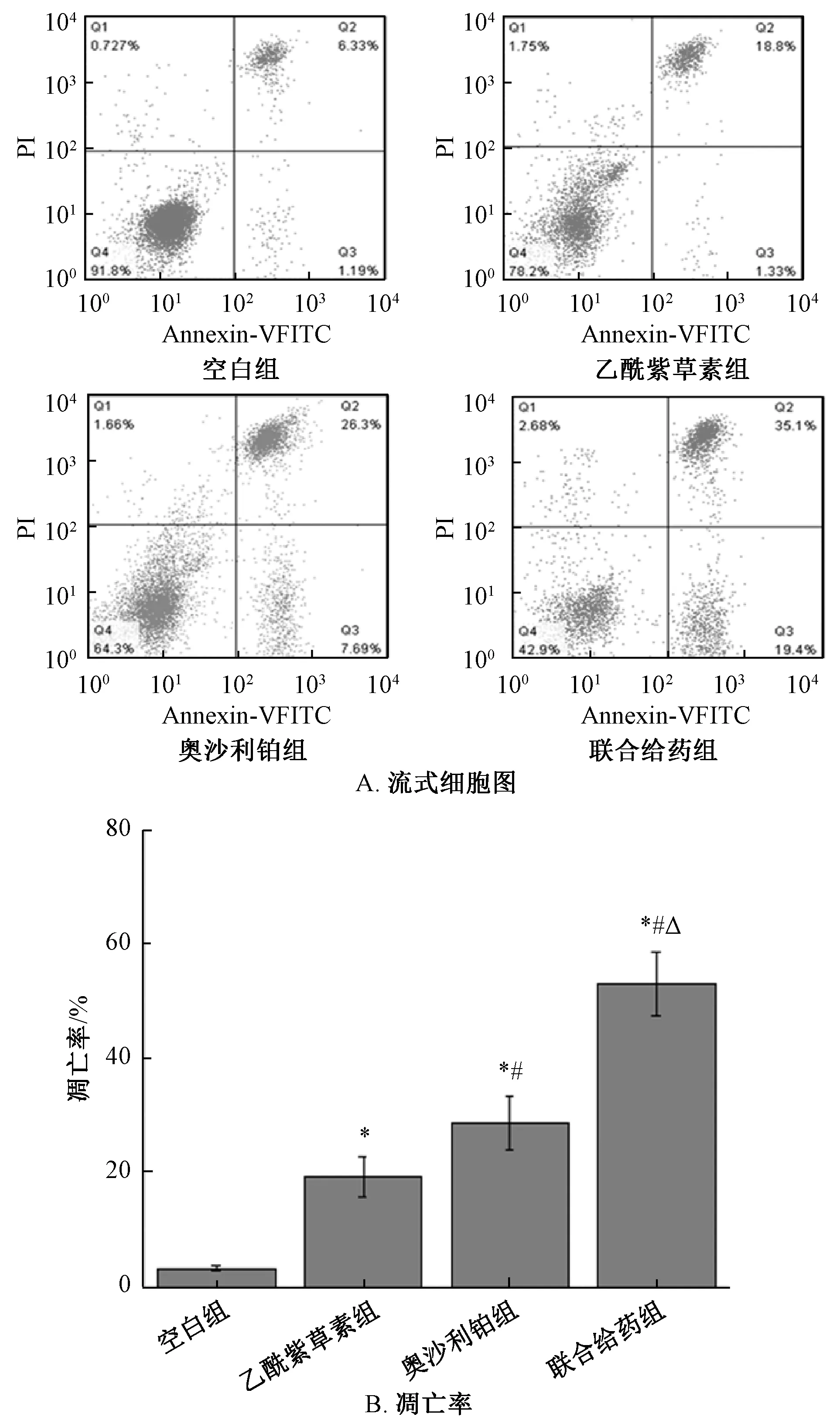
圖1 乙酰紫草素聯合奧沙利鉑對HT29 細胞凋亡率的影響(±s,n=5)Fig.1 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell apoptosis rate(±s,n=5)
3.4 乙酰紫草素聯合奧沙利鉑對HT29 細胞PI3K/Akt 信號通路的影響 人結腸癌HT29 細胞經乙酰紫草素、奧沙利鉑和聯合給藥處理48 h 后,p-PI3K、p-Akt 蛋白表達均降低(P<0.05);與乙酰紫草素組比較,奧沙利鉑組的p-PI3K、p-Akt 蛋白表達降低(P<0.05);聯合給藥組的p-PI3K、p-Akt 蛋白表達均低于乙酰紫草素組及奧沙利鉑組(P<0.05)。見圖2、表4。
4 討論
隨著人們攝入膳食纖維和碳水化合物減少,脂肪增加,結腸癌的發病率逐年遞增[10]。乙酰紫草素存在于紫草科植物紫草的根中,可以抑制人結腸癌HCT116 細胞的增殖并誘導其凋亡,但關于該成分與化療藥物的聯合使用未見報道[9]。本研究發現,與空白組比較,乙酰紫草素組、奧沙利鉑組及聯合給藥組細胞增殖抑制率均明顯增加,以聯合給藥組更明顯。
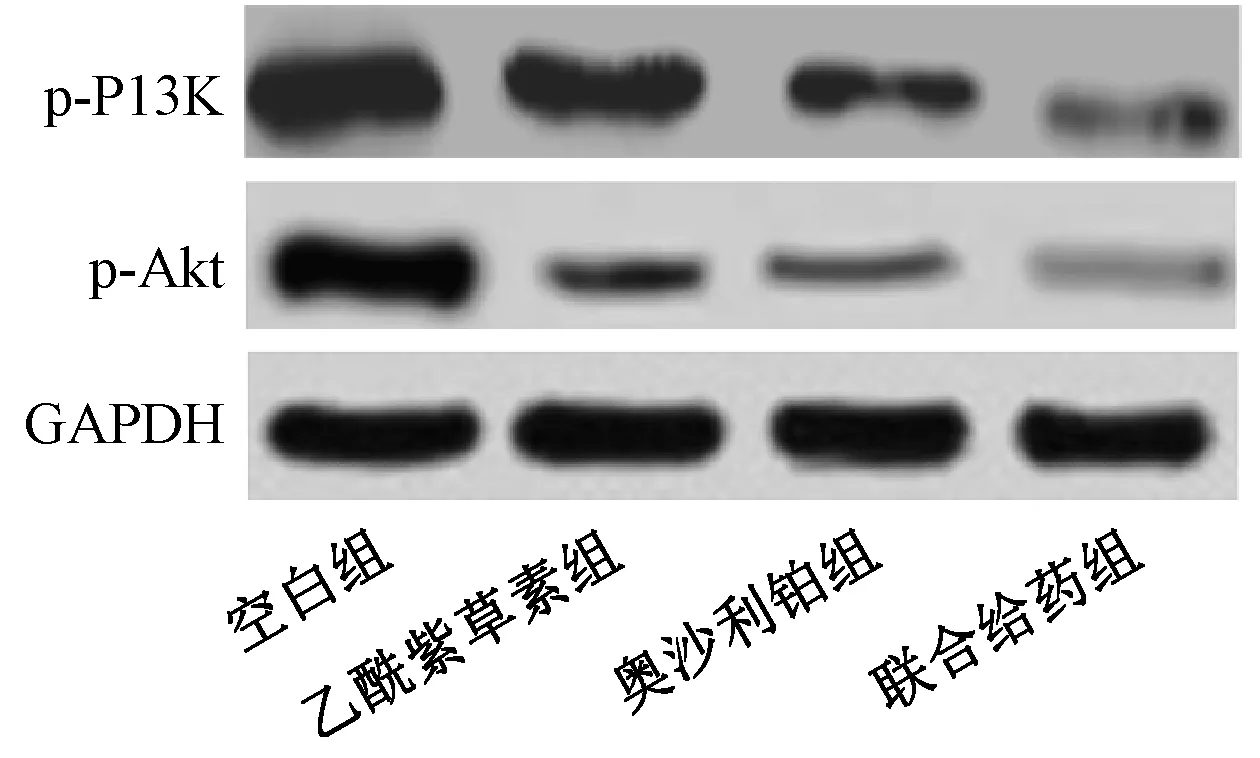
圖2 Western blot 檢測HT29 細胞p-PI3K、p-Akt 蛋白表達Fig.2 Expressions of p-PI3K and p-Akt protein in HT29 cells detected by Western blot
表4 乙酰紫草素聯合奧沙利鉑對HT29 細胞PI3K/Akt 信號通路相關蛋白表達的影響(±s,n=5)Tab.4 Effects of acetyl shikonin combined with oxaliplatin on the expressions of PI3K/Akt signaling pathwayrelated proteins in HT29 cells(±s,n=5)

表4 乙酰紫草素聯合奧沙利鉑對HT29 細胞PI3K/Akt 信號通路相關蛋白表達的影響(±s,n=5)Tab.4 Effects of acetyl shikonin combined with oxaliplatin on the expressions of PI3K/Akt signaling pathwayrelated proteins in HT29 cells(±s,n=5)
注:與空白組比較,?P<0.05;與乙酰紫草素組比較,#P<0.05;與奧沙利鉑組比較,△P<0.05。
腫瘤的形成除了與細胞增殖失控有關外,死亡過程受阻也是重要原因[11],因此,可以通過抑制細胞分裂、增殖,以及誘導細胞凋亡達到預期治療效果。Ki-67 在多種腫瘤組織中呈現高表達,是評價腫瘤細胞凋亡水平的重要指標[12];Bcl-2 家族蛋白成員間的相互作用在調控腫瘤細胞凋亡過程中也發揮著關鍵性作用,存在于胞漿或線粒體外膜的促凋亡蛋白Bax 與抗凋亡蛋白Bcl-2 結合后可以激活caspase 途徑,最終促進腫瘤細胞凋亡的發生[13]。本研究發現,聯合給藥組細胞凋亡率、BaxmRNA表達高于乙酰紫草素組和奧沙利鉑組,而Ki-67、Bcl-2 mRNA 表達更低。
在細胞的凋亡和增殖過程中,PI3K/Akt 信號通路均發揮重要作用,在腫瘤組織和腫瘤細胞中異常激活[14],p-PI3K 及p-Akt 表達均明顯升高[15]。研究[16]表明,抑制PI3K/Akt 信號通路的活化是多種化療藥物的共同機制;胡澤成等[17]報道,青龍衣多糖在體外可直接殺傷或抑制人結腸癌HCT-116細胞,其作用機制與抑制PI3K/Akt 信號通路的活化有關;本研究也發現,與空白組比較,乙酰紫草素組、奧沙利鉑組及聯合給藥組細胞p-PI3K、p-Akt 蛋白表達均明顯降低,以聯合應用組更明顯。
綜上所述,乙酰紫草素和奧沙利鉑對人結腸癌HT29 細胞均具有抑制增殖及誘導凋亡作用,可能與調控PI3K/Akt 信號通路有關,而且兩者聯合作用時效果更好。

