雙歧桿菌四聯活菌輔助治療對高尿酸血癥的臨床分析
詹雅萍,李 嫻,朱香順,王國芬,童筱君
(臺州市中心醫院 風濕免疫科,浙江 臺州 318000)
隨著人們生活水平和膳食結構的改變,高尿酸血癥(HUA)的發病率呈明顯升高趨勢,可高達21%[1]。HUA是一種因嘌呤代謝紊亂使尿酸(UA)生成過多和(或)排泄減少所致的一種代謝性疾病,其與痛風發作、腎臟疾病及代謝綜合征等疾病的發生息息相關[2]。其有害代謝作用可能通過可溶性尿酸增加氧化應激作用、線粒體和內質網功能障礙、內皮功能障礙、腎素-血管緊張素系統激活以及促炎因子的合成和分泌增加等機制致病[3-5],因此,維持血UA正常水平是預防和治療相關并發癥和合并癥的有效途徑。UA是嘌呤代謝的最終產物,約2/3 UA通過腎臟排出,另外1/3通過腸道排泄[6]。近年來研究發現HUA可能與腸道菌群失調有著密切關系,腸道菌群結構可能直接影響UA在胃腸道的代謝過程。因此,探討HUA患者的腸道菌群結構特點及其與疾病相關性成為目前研究熱點。本研究旨在觀察益生菌干預對HUA患者降UA效果及腸道菌群的影響。
1 資料與方法
1.1病例選擇 2017年1月至2018年11月在本院風濕免疫科門診就診及住院治療的HUA患者100例(男54例,女46例),隨機分為實驗組A組50例(男26例,女24例)及標準組B組50例(男28例,女22例)),另選擇同期健康體檢者C組50例(男27例,女23例)為對照組。3組一般資料差異無統計學意義(P>0.05)。
1.2納入標準 ①符合HUA標準:男性和絕經后女性血UA>420 μmol/L,絕經前女性血UA>350 μmol/L,且處于非痛風急性發作期;②入組前近1個月內未使用過抗生素、微生態活菌制劑等;③無胃腸道疾病、心血管疾病史及肝腎功能異常;④對本次研究知情同意;本研究經醫院倫理委員會審核通過,所有被試者均已簽署知情同意書。
1.3治療 A、B組患者均予非布司他(優立通,江蘇萬邦生化醫藥公司,國藥準字H20130058)40 mg/次,1次/d治療,實驗組在標準組基礎上加用雙歧桿菌四聯活菌片 (杭州龍達新科生物制藥公司,國藥準字S20060010)3粒/次,3次/d治療。服用總療程為2周。兩組被試者在試驗期間均采用低嘌呤飲食,不使用抗生素、其他含益生菌的藥物或發酵奶制品等食物。測定各組治療前及治療2周后的血清學及糞便結果,其中C組只采集1次血便標本。
1.4UA測定 所有患者空腹8 h后抽取靜脈血3 ml,離心后分離血清采用全自動生化分析儀及其配套試劑測定血UA水平。參照文獻[7]取樣后稱取500 mg中段糞便用PBS液按重量比例(糞便∶PBS=1∶2)進行稀釋,混勻后3 000 r/min離心10 min,再取上清分別加入標準的尿酸鹽溶液或碳酸鋰溶液200 μl,定容至1 ml后充分振蕩混勻,37 ℃孵育2 h,然后4 ℃ 15 000 r/min離心15 min,取上清液至比色杯中并立即用酶比色法檢測UA含量。每次實驗需同時設標準品校正和空白對照。結果以1 g糞便內的細菌分解的UA和糞便本身含有的UA表示(μmol/L)。
1.5腸道菌群檢測 采用實時熒光定量PCR檢測3組患者在治療期間雙歧桿菌、乳酸桿菌、多形擬桿菌、大腸埃希菌、糞腸球菌。稱取1 g中段糞便,后由冰盒運送至實驗室,并在2 h內采用DNA提取試劑盒方法(北京天根生化科技有限公司)采提取DNA,使用PCR定量技術檢查各組治療前后腸道菌群變化。每次實驗同時設標準品校正和陰性對照,并根據溶解曲線分析產物特異性。結果以細菌拷貝數的常用對數/g糞便表示。
2 結 果
2.1UA變化 治療前,A、B組患者UA平均水平明顯高于C組(P<0.05)。治療兩周后,兩組HUA患者UA明顯下降,其中A組UA值低于B組,兩者具有統計學意義(P=0.012)。糞便UA變化,A、B兩組在治療前糞便中細菌分解的UA稍高于C組,但差異無統計學意義(P>0.05),而C組被試者糞便本身含有的UA明顯低于HUA人群(P<0.05)。治療后A組患者糞便內細菌分解UA明顯升高,兩組糞便本身含有UA治療后無明顯變化。見表1。
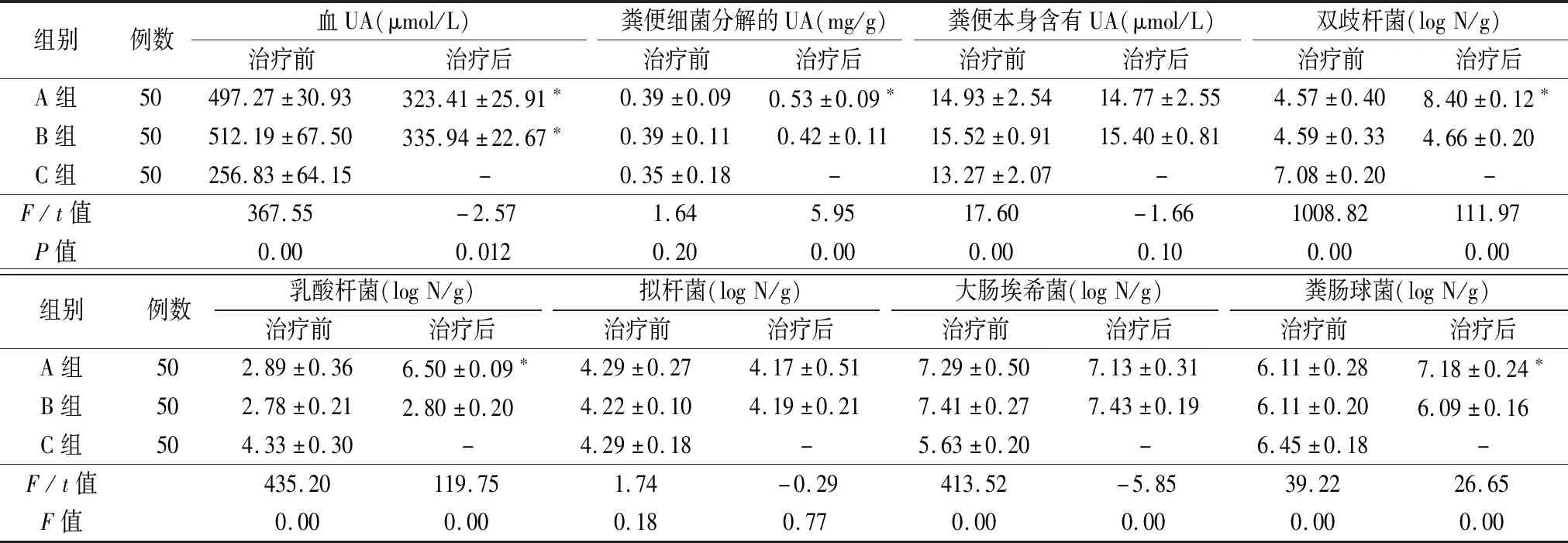
表1 各組UA情況比較
注:與治療前比較,*P<0.05
2.2實時熒光定量PCR檢測腸道菌群 治療前A、B兩組糞便細菌數量差異無統計學意義(P>0.05),A、B組雙歧桿菌、乳酸桿菌、糞腸球菌明顯低于C組,而大腸桿菌數量明顯高于C組(P<0.05)。治療后A組糞便中雙歧桿菌、乳酸桿菌及糞腸球菌較治療前明顯增多,且與B組比較差異有統計學意義(P<0.05),A組大腸桿菌數量較較治療前無明顯變化,但其含量明顯低于B組降(P<0.05),B組治療前后無明顯變化。
3 討 論
HUA是一種由于UA生成過多和(或)排泄減少所致的一種代謝性疾病。在人類和禽類,黃嘌呤氧化酶(XO)是UA生成的關鍵酶,參與機體嘌呤堿分解代謝,其活性增高會可增強對嘌呤的催化作用,導致UA生成增多,繼而引起HUA[8]。而UA的代謝經腎小管分泌經尿道排出,同時可通過腸道上皮細胞內轉運至腸腔直接排出體外或由腸道菌群分解[9]。目前應用于臨床的降UA藥物也以減少合成及促腎臟途徑排泄為主要靶點,如黃嘌呤氧化酶抑制劑、苯溴馬隆等促UA排泄藥物以及促UA分解生物制劑UA酶等,然而這些藥物大都可存在不良反應多,患者耐受性差,不宜長期服用,其中UA酶易產生過敏反應且價格昂貴,市場應用較少,尤其是針對腎臟功能較差的部分患者其治療作用十分有限[10]。
近年來,研究發現HUA與腸道菌群失衡密切相關,提示UA的腸道排泄可能是降低UA的有效治療靶點。腸道菌群結構及其代謝產物在人類年齡、膳食結構及腸道微環境的改變處于不斷動態變化,腸道菌群失衡及其代謝產物異常已被證實與代謝綜合征胰島素抵抗、脂質代謝異常、糖尿病、肥胖、高血壓等代謝性疾病及心房顫動、心力衰竭等心血管疾病的發生存在病理聯系[11-12]。而HUA及痛風的發生與這些代謝性疾病及心血管疾病相互影響,互為風險因素[13-15],提示腸道菌群失衡可能與HUA的發生相關。另外,研究發現痛風患者的腸道菌群整體結構與健康對照人群的菌群具有明顯差異,且在不同種族之間腸道優勢菌群也存在顯著差異[16],同樣,在HUA大鼠模型研究中也得到同樣的結論[17]。對于兩者關系理論的病理機制,曾有學者[18]提出“代謝性內毒素血癥”的假說,認為腸道菌群結構變化可引起腸道通透性增加,使得宿主循環系統中菌群代謝產物內毒素(LPS)增加,LPS能與其受體CD14形成免疫復合物,繼而被免疫細胞表面的Toll樣受體4(TLR4)識別,從而誘發慢性低度炎癥而產生代謝紊亂,提示菌群失調可能參與HUA的發病過程。這一假說在黃勝男團隊[8]通過高嘌呤誘導的鵪鶉HUA動物模型中也得到驗證,表明腸道菌群結構變化可導致外周血中細菌代謝產物LPS水平升高及XO活性增高,可能為HUA發病的重要機制。
趙瓊瓊等[19]在合并冠心病的HUA患者的研究中發現UA水平越高,其糞便中含有的雙歧桿菌及乳酸桿菌數量越少。本研究結果也顯示HUA患者較正常健康C組的糞便中乳酸桿菌、雙歧桿菌及糞腸球菌的含量明顯偏低,而大腸桿菌的含量高于正常組,提示腸道菌群失調可能影響UA的腸道代謝及參與HUA的發病過程。本研究通過對被試者患者糞便UA的分析,我們發現HUA患者糞便本身含有的UA明顯增加,這與UA生成較多致腸道排泄增多引起。另外,研究結果提示糞便中細菌分解的UA稍高于健康對照者,但差異無統計學意義,這與青島地區的研究[20]結論類似,提示由于HUA患者由于腸道UA排泄增多,腸道菌群UA處理能力可能會代償性增加,以加強UA分解。根據HUA患者菌群失調情況,本研究在通過對HUA患者常規降UA基礎上加服雙歧桿菌四聯活菌片對比治療前后UA變化。研究結果顯示治療后A組UA水平明顯低于非布司他單藥治療組,糞便本身含有UA含量兩組無明顯變化,而糞便細菌分解量A組也高于B組,提示在常規降UA方案上加服雙歧桿菌活菌可通過改善腸道菌群失調,提高其UA處理能力增加腸道排泄從而降低UA。本研究結果發現治療后糞便中雙歧桿菌、乳酸桿菌及糞腸球菌含量較治療前及B組明顯升高,這與外源性活菌補充有關,但也似乎意味著該菌群可能具有降UA作用,通過加速UA分解參與促UA排泄作用。本研究存在一些局限性,首先研究對象主要為沿海高嘌呤飲食人群,為單中心研究,可能存在地域性、遺傳背景等特殊性。其次,因依從性及經費有限,本研究時間較短且未進行2周以后的隨訪。另外,本次研究未檢測被試者每日熱量攝入及消耗量,可能會影響腸道菌群變化。本研究結論得到國內外一些研究的支持,Li等[21]通過鑒定55種不同的乳酸菌對該關鍵物質的分解能力,得到分解活性最強的DM9218菌株植物乳桿菌,之后用DM9218灌胃HUA模型大鼠,發現與模型組相比,UA水平顯著降低,表明DM9218乳桿菌可能為正常人群HUA的預防性益生菌。針對這個結果,國外有學者通過對大鼠實驗證實補充益生菌飲食可增強UA的排泄以及血氧酸引起的UA體內蓄積,預防HUA的發生,同時也可防止HUA引起的腎臟改變和高血壓[22],本文尚未對外源性活菌對UA腎臟排泄的影響進行研究,但其被證實的降UA作用與本研究結論一致。
綜上所述,本研究結果顯示HUA患者存在腸道菌群失調的情況,可參與其發病過程。通過在標準降UA治療基礎上加用活菌制劑,可改善腸道菌群失調及增加降UA效果,其作用機制可能是通過增強腸道細菌UA處理能力,其中雙歧桿菌、乳酸桿菌及糞腸球菌可能在整個過程中起到了主要作用,腸道菌群與HUA機制的探討,為開發替代治療策略以降低UA濃度具有重要意義。

