新型植物生長調節劑獨腳金內酯生物學功能及應用
鄭晨
摘要:獨腳金內酯(Strigolactones,SLs)是獨腳金醇類化合物的總稱,是近年來發現的一類能夠調控植物內源性發育過程的信號分子,被稱為新型植物生長調節劑。近幾年來,對獨腳金內酯的研究已經越來越多,新的獨腳金內酯類化合物及其功能研究報道較多。綜述了最近幾年來獨腳金內酯生物學功能及在農作物種植方面的應用,并對獨腳金內酯的研究方向進行了展望。
關鍵詞:獨腳金內酯;植物生長調節劑;生物學功能
中圖分類號:Q946.885? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2020)02-0009-05
DOI:10.14088/j.cnki.issn0439-8114.2020.02.002? ? ? ? ? ?開放科學(資源服務)標識碼(OSID):
Biological function and application of new plant growth regulator strigolactones
ZHENG Chen
(Forestry College of Fujian Agriculture and Forestry University,Fuzhou 350000,China)
Abstract: Strigolactones (SLs) is a general term of the alcohol compounds of striga. It is a kind of signal molecule which can regulate the endogenic development of plants in recent years. It is called a new plant hormone. Recently, much researches have been done on SLs, there are many reports on the study of striga compounds and their functions. The research and crop cultivation application of the biological functions of SLs were reviewed,and the future research of SLs was also forecasted.
Key words: strigolactones; plant hormone; biological function
獨腳金內酯屬于萜類小分子化合物[1],是一些天然的獨腳金醇類化合物及人工合成類似物的總稱,廣泛存在于高等植物中,主要在根中合成[2]。最先發現的獨腳金內酯類化合物是獨腳金醇(Strigol),由Cook等[3,4]從獨腳金的非寄主植物棉花的根際分泌物中分離得到;1998年Yokota等[5]從小列當四葉草中提取出列當醇(Orobanchol),并確定列當醇結構與獨腳金醇互為異構體。獨腳金內酯可以誘導獨腳金屬(Striga spp.)、列當屬(Orobanche spp.)種子的萌發。2008年,Gomez-Roldan等[6]、Umehara等[7]發現獨腳金內脂調節植物分枝功能不同于傳統的植物莖分枝由生長素和細胞分裂素兩種生長調節劑調控,因此,將其確定為調控植物分枝的第三種生長調節劑[6,7]。近年來,關于獨腳金內脂化合物的分離和生物學功能的研究成為了植物學界研究的熱點。
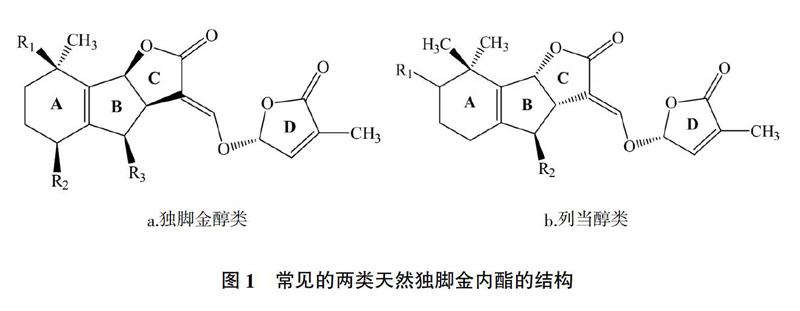
截至目前,從不同的植物中提取到大約36種天然獨腳金內酯化合物(SLs),其具有相似的結構,根據立體結構不同一般分為:獨腳金醇類,BCD環和(+)-獨腳金醇的立體結構一致(圖1a);列當醇類,BCD環則與(-)-列當醇類似(圖1b)。
從圖1可以看出,兩類天然獨腳金內脂的ABC環均是通過1個烯醇醚鍵與環丁烯羥酸內酯(D環)相連,但C環的構型不同。研究表明,CD環及其之間的烯醚鍵對獨腳金內脂的生物活性至關重要[8-10],AB環取代基對獨腳金內酯的生物活性有一定的影響,而D環上增加1個甲基可以導致獨腳金內酯誘發寄宿種子萌發的能力大幅降低[11]。關于獨腳金內酯的分離、生物合成機理及其調節機制的研究進展,國內外已有相關文獻報道[12-15],本文主要對獨腳金內酯的生物學功能及其應用研究進行比較全面的概述,旨在更好地利用獨腳金內酯這一新型生長調節劑。
1? 獨腳金內酯的生物學功能
作為一種新型的植物生長調節劑,隨著研究的不斷深入,獨腳金內酯化合物的很多生物功能被發現,獨腳金內酯的主要生物學功能表現在誘導種子萌發、促進叢枝菌根真菌菌絲分子以及調節植物的生長等方面。
1.1? 誘導根寄生植物種子萌發
國內外學者對獨腳金內酯化合物誘導植物萌發的生物學機理進行了廣泛研究。研究發現,獨腳金內脂化合物的C環和D環之間的烯醚鍵是誘導根寄生種子萌發的關鍵部位,獨腳金內酯通過其受體蛋白質htl-3、AtHTL、ShHTLs傳遞信號喚醒根寄生種子,同時,根寄生種子的對獨腳金內脂的敏感度取決于受體的敏感度[16-20]。Nomura等[21]研究發現,結構不同的SLs對同一種寄生植物種子萌發的誘導活性不一樣,盡管現在發現的天然獨腳金內酯均可誘導根寄生植物種子的萌發,但誘導效果不同,萌發率最低為10%,最高可達50%。同時,同一種SLs對不同寄生植物的效果也不同。Kisugi等[22]研究發現,0.1 nmol/L的獨腳金醇可誘導獨腳金種子萌發,但對小列當種子萌發卻不起作用。
1.2? 促進叢枝菌根真菌菌絲分枝
叢枝菌根真菌(Arbuscular Mycorrhiza fungi,簡稱AM fungi)是陸地生態系統中的關鍵微生物,是土壤中與植物關系最密切的微生物之一,參與碳、氮、磷等多種元素的生物地球化學循環過程,能與90%以上的陸地高等植物的營養根系形成互惠共生體,是自然界中一種普遍的植物互惠共生現象。叢枝菌根真菌既具有一般植物根系的特征,又具有專屬真菌的特性。對叢枝菌根真菌的研究表明,獨腳金內酯可以促進菌絲分枝。研究者從百脈根中成功分離出可誘發叢枝菌根真菌分枝的SLs類似物:5-脫氧獨腳金醇,并證明其可以促進枝菌根真菌菌絲分枝[23]。同時研究還發現,獨腳金內酯化合物的D環構型或A環或B環是否羥基化對促進叢枝菌根真菌分枝活性有很大的影響[24,25]。因此,在叢枝菌根真菌中發現獨腳金內酯的受體是該生物學功能研究取得突破的關鍵。
1.3? 調節植物分枝生長
作為一種新型的植物生長調節劑,獨腳金內酯能夠抑制植物的分枝和側芽的生長,參與調控植物的分枝數量[26],這是獨腳金內酯最重要的生物學功能。研究表明,天然的5-脫氧獨腳金內酯可以高效抑制依賴水解蛋白D14的擬南芥分枝,而且,獨腳金醇構型的異構體比列當醇構型的異構體活性稍高[10]。在水稻的分蘗試驗中發現,獨腳金內酯的D環的R-構型的異構體顯示出較高的抑制分蘗活性,同樣,獨腳金醇構型的異構體比列當醇構型的異構體活性稍高[27,28],獨腳金內酯調控水稻分蘗機制也得到了很好的研究和分析[29]。在豌豆分枝試驗中發現,獨腳金內酯化合物的D環的R或S構型對抑制分枝表現出相似的生物活性[30]。
1.4? 調控植物根系生長和根瘤菌的形成
獨腳金內酯通過與植物體內的其他生長素、細胞分裂素協同,不僅可以控制植物分枝,還可以調控植物根系的生長。通過對擬南芥、番茄、豌豆等植物的研究發現,獨腳金內酯可促進側根的形成,根毛的伸長以及抑制不定根的生長,調控根系構型[31-33]。根瘤菌具有很強的固氮能力,與豆科植物及另外的9個科植物共生[34],在宿主根部形成根瘤并固定空氣中的氮氣,供給植物氮素營養,參與大氣氮的循環,提高土壤的肥力。研究發現,獨腳金內酯可促進苜蓿根瘤、豌豆根瘤的形成[35,36]。由于根瘤菌在生活過程中分泌一些有機氮到土壤中,加之,根瘤在植物的生長末期會自行脫落,從而大大提高了土壤的肥力。
2? 獨腳金內酯的應用研究
對獨腳金內酯的發現及其生物學功能的研究,特別是對其生物學功能機理的研究促進了其在農業方面的應用研究。但是,由于對獨腳金內酯的研究還不夠充分,限制了其應用。目前,獨腳金內酯的應用研究僅表現在以下幾個方面,而且有些應用僅僅處于實驗室階段。
2.1? 用于控制植物分枝,調控植物株型
獨腳金內酯的生物學功能之一是抑制植物的分枝和側芽的生長,因此,可以通過控制植物體內獨腳金內酯的合成和代謝調控植物的分枝發育。水稻是世界主要糧食作物,水稻的分蘗是其生長發育過程中一種特殊的分枝現象,與水稻產量密切相關。研究表明,獨腳金內酯的合成與信號傳導可以控制水稻、小麥等的分蘗及植株的高度[7,37]。對于一些園藝花卉和經濟類果樹,可通過控制獨腳金內酯的合成來調節植物分枝,達到多開花多結果等調控效果。
2.2? 作為除草劑控制寄生雜草生長
獨腳金和列當均是一年生或二年生寄生草本植物,獨腳金主要寄生在玉米、水稻、高粱、小麥、甘蔗等禾本科植物及大豆、番茄等植物的根上,列當主要寄生在菊科蒿屬(Artemisia)植物根上,與寄主爭奪土壤營養,甚至導致寄主死亡,導致農作物減產[38]。獨腳金內酯可以誘導列當屬和獨腳金屬等根寄生植物種子的萌發,這些種子萌發后如果接觸不到寄主的根將會死亡。因此,可以利用獨腳金內酯作為除草劑,在農作物播種前用含有獨腳金內酯的除草劑噴灑土壤,誘發雜草種子“自殺式”萌發,控制雜草生長。2018年,Uraguchi等[39]研發了一種選擇性獨腳金內酯激動劑Sphynolactone-7(SPL7),SPL7與獨腳金內酯激活種子的受體ShHTL7具有很好的親和力,可以在飛摩爾濃度激活受體,刺激獨腳金種子“自殺式”萌發,從而有效減少獨腳金的寄生,但SPL7不影響寄主體內獨腳金內酯相關的生理過程,如不影響擬南芥分枝或根毛伸長,也幾乎不影響土壤AM真菌菌絲分枝。這項研究為利用獨腳金內酯進行雜草的防治提供了新的思路和策略。
2.3? 作為獨腳金、列當發芽促進劑,使之增產
獨腳金和列當既是農作物寄生雜草,也是中草藥。獨腳金,又名疳積草,具有清熱、消積作用。列當,又名“不老草”,具有補腎壯陽、強筋骨、提高免疫力和潤腸等一系列功效,是名貴的中藥材,為國家三級保護瀕危物種。由于市場需求旺盛及亂挖濫采,導致野生列當受到嚴重破壞,但是,寄生植物的人工栽培及嫁接難度很大,如極其名貴肉蓯蓉種子的胚發育不完全,為球形原胚,沒有胚根、胚軸、子葉及胚芽的分化,僅為幾十個細胞組成的一團胚性細胞[40],自然萌發率極低。利用獨腳金內酯可以有效促進獨腳金和列當種子萌發的生物學功能,可以考慮誘導肉蓯蓉種子的萌發,提高種子自然萌發率。2005年,González-Verdejo等[41]利用獨腳金內酯類似物GR24處理分支列當的種子,種子萌發率達到70%。因此,可以利用獨腳金內酯作為列當發芽促進劑,人工培育珍貴列當,為提高成活率和規模化種植找到了一個比較可靠的方法。研究發現,大多數天然的獨腳金內酯對寄生植物種子萌發具有活性,但對映體通常活性比較低[42],因此,在獨腳金內酯的應用方面還需謹慎對待。目前,中國寧夏采用人工控制寄生培養的方法得到名貴肉蓯蓉,效果不錯[43]。
2.4? 利用叢枝菌根真菌菌絲分枝和根瘤菌的形成,增強貧瘠土壤肥力
叢枝菌根真菌能和90%以上的有花植物形成互惠互利的共生體,菌根真菌分泌的球囊霉素相關蛋白不僅能夠改善土壤的團聚性,同時可以提高土壤有機碳含量,改善土壤微環境,因此,叢枝菌根真菌又稱“生物肥料”。根瘤菌具有很強的固氮能力,與其共生的植物可以通過根瘤菌從大氣中獲得氮素養分。據估測,每公頃苜蓿年均可積累300 kg氮肥,相當于1 500 kg硫銨,并可增加土壤中的腐殖質,大大提高土壤的肥力。中國幅員遼闊,但可耕地面積卻逐漸萎縮,貧瘠土壤面積增加,恢復貧瘠土壤的可耕作能力勢在必行。利用獨腳金內酯可以促進叢枝菌根真菌的分枝和根瘤菌形成的功能,對于貧瘠土壤上的植物接種叢枝菌根真菌,并施以適量的獨腳金內酯刺激物,可以促進叢枝菌根真菌的分枝,同時可適當種植能形成根瘤菌的苜蓿等植物,可以有效恢復貧瘠土壤的肥力。研究表明,在中國西南石漠化的貧瘠土壤地區接種叢枝菌根真菌苗木,如香椿、任豆、喜樹、桑樹、茶條木和降香黃檀等成活率和生長速度明顯提高[44-46]。叢枝菌根真菌可以促進互惠共生的植物的生長,同時抑制互惠植物根系合成獨腳金內酯,從而解除植物自身獨腳金內酯對地上部分蘗的抑制作用,促進植物增加地上部的生物量[47]。
3? 小結
獨腳金內酯從發現至今已經有五十多年,對其生物學功能及其相關作用機理的研究不斷深入,研究表明作為一種新型的植物生長調節劑在植物生長過程中有著不可替代的作用,但仍然有許多難題沒有研究清楚,如SLs受體識別蛋白的認知。SLs信號轉導途徑中有些假定,如SLs對細胞分裂素的生物合成、代謝或者運輸的影響機制等[48],都有待于進一步研究證明,這些關鍵步驟不能破解,加上天然的獨腳金內酯化合物的取得十分困難,這都將阻礙獨腳金內酯的應用。關于獨腳金內酯對植物生長的影響機制的研究是目前植物學、分子生物學及交叉學科研究的熱點,獨腳金內酯研究的每一步突破都對其應用起到推動作用,未來對于獨腳金內酯的研究主要在獨腳金內酯的生物學功能的作用機制、獨腳金內脂類似物的合成及其功能研究、獨腳金內酯化合物的應用推廣等方面。
參考文獻:
[1] ZWANENBURG B,BLANCO-ANIA D,PRANDI C. Strigolactones:New plant hormones in the spotlight[J].J Exp Bot,2018,69(9):2205-2218.
[2] 陳虞超,鞏? 檑,張? 麗,等.新型植物激素獨腳金內酯的研究進展[J].中國農學通報,2015,31(24):157-162.
[3] COOK C E,WHICHARD L P,WALL M E,et al. Germination stimulants. II. Structure of strigol,a potent seed germination stimulant for witchweed (Striga lutea Lour.)[J].J Am Chem Soc,1972,94(17):6198-6199.
[4] COOK C E,WHICHARD L P,TURNER B,et al. Germination of witchweed (Striga lutea Lour.):Isolation and properties of a potent stimulant[J].Science,1966,154(3753):1189-1190.
[5] YOKOTA T,SAKAI H,OHUNO K,et al. Alectrol and orobanchol,germination stimulants for Orobanche minor,form its host red clover[J].Phytochemistry,1998,49(7):1967-1973.
[6] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,et al. Strigolactone inhibition of shoot branching[J].Nature,2008,455 (7210):189-194.
[7] UMEHARA M,HANADA A,YOSHIDA S,et al. Inhibition of shoot branching by new terpenoid plant hormones[J].Nature,2008,455(7210):195-200.
[8] ZWANENBURG B,POSPISIL T. Structure and activity of strigolactones:New plant hormones with a rich future[J].Mol Plant,2013, 6(1):38-62.
[9] ZWANENBURG B,ZELJKOVIE S C,POSPISIL T. Synthesis of strigolactones,a strategic account[J].Pest Manag Sci,2015,72(1):15-29.
[10] SCAFFIDI A,WATERS M T,SUN Y K,et al. Strigolactone hormones and their stereoisomers signal through two related receptor proteins to induce different physiological responses in Arabidopsis[J].Plant physiol,2014,165(3):1221-1232.
[11] ZWANENBURG B,NAYAK S K,CHARNIKHOVA T V,et al. New strigolactone mimics:Structure-activity relationship and mode of action as germinating stimulants for parasitic weeds[J].Bioorg Med Chem Lett,2013,23(18):5182-5186.
[12] NAKAMURA H,ASAMI T. Target sites for chemical regulation of strigolactone signaling[J].Front Plant Sci,2014,5:623.
[13] 劉? 虎,姬朝光,劉? 坤,等.DWARF14響應獨角金內酯信號的分子機制[J].湖北農業科學,2018,57(20):9-12,22.
[14] EVA-SOPHIE W,VADIR L-S,THOMAS G. Strigolactone versus gibberellin signaling:Reemerging concepts?[J].Planta,2016,243(6):1339-1350.
[15] FLEMATTI G R,SCAFFIDI A,WATERS M T,et al. Stereospecificity in strigolactone biosynthesis and perception[J].Planta,2016,243(6):1361-1373.
[16] PRANDI C,ROSSO H,LACE B,et al. Strigolactone analogs as molecular probes in chasing the (SLs) receptor/s:Design and synthesis of fluorescent labeled molecules[J].Mol Plant,2013, 6(1):113-127.
[17] TSUCHIYA Y,YOSHIMURA M,SATO Y,et al. Probing strigolactone receptors in Striga hermonthica with fluorescence[J].Science,2015,349(6250):864-868.
[18] RASMUSSEN A,HEUGEBAERT T,MATTHYS C,et al. A fluorescent alternative to the synthetic strigolactone GR24[J].Mol Plant,2013,6(1):100-112.
[19] TOH S,HOLBROOK-SMITH D,STOGIOS P J,et al. Structure-function analysis identifies highly sensitive strigolactone receptors in Striga[J].Science,2015,350(6257):203-207.
[20] CONN C E,BYTHELL-DOUGLAS R,NEUMANN D,et al. Convergent evolution of strigolactone perception enabled host detection in parasitic plants[J].Science,2015,349(6247):540-543.
[21] NORMURA S,NAKASHIMA H,MIZUTANI M,et al. Structural requirements of strigolactones for germination induction and inhibition of Striga gesnerioides seeds[J].Plant cell reports,2013,32(6):829-838.
[22] KISUGI T,XIE X,KIM H J,et al. Strigone,isolation and identification as a natural strigolactone from Houttuynia cordata[J].Phytochemistry,2013,87(3):60-64.
[23] AKIYAMA K,MATSUZAKI K,HAYASHI H. Plant sesquiterpenes induce hyphal branching in arbuscular myeorrhizal fungi[J].Nature,2005,435(7043):824-827.
[24] ARTUSO E,GHIBAUDI E,LACE B,et al. Stereochemical assignment of strigolactone analogues confirms their selective biological activity[J].J Nat Prod,2015,78(11):2624-2633.
[25] AKIYAMA K,OGASAWARA S,ITO S,et al. Structural requirements of strigolactones for hyphal branching in AM fungi[J].Plant cell physiology,2010,51(7):1104-1117.
[26] 陳彩艷,鄒軍煌,張淑英,等.獨角金內酯能抑制植物的分枝并介導植物與樅枝真菌及寄生植物間的相互作用[J].中國科學C輯(生命科學),2009,39(6):525-533.
[27] UMEHARA M,CAO M,AKIYAMA K,et al. Structural requirements of strigolactones for shoot branching inhibition in rice and Arabidopsis[J].Plant cell physiology,2015,56(6):1059-1072.
[28] XU J,DING C,DING Y,et al. A proteomic approach to analyze differential regulation of proteins during bud outgrowth under apical dominance based on the auxin transport canalization model in rice(Oryza sativa L.)[J].J Plant Growth Regul,2015,34:122-136.
[29] 黎舒佳,高? 謹,李家洋,等.獨腳金內酯調控水稻分蘗的研究進展[J].植物學報,2015,50(5):539-548.
[30] BOYER F D,DE SAINT GERMAIN A,PILLOT J-P,et al. Structure-activity relationship studies of strigolactonerelated molecules for branching inhibition in garden pea:Molecule design for shoot branching[J].Plant physiology,2012,159:1524-1544.
[31] KAPULNIK Y,DELAUX P M,RESNICK N,et al. Strigolactones affect lateral root formation and root- hair elongation in Arabidopsis[J].Planta,2011,233(1):209-216.
[32] RASMUSSEN A,MASON M G,CUYPER C D,et al. Strigolactones suppress adventitious rooting in Arabidopsis and pea[J].Plant physiology,2012,158(4):1976-1987.
[33] KOHLEN W,CHARNIKHOVA T,LAMMERS M,et al. The tomato CAROTENOID CLEAVAGE DIOXYGENASE8(SlCCD8) regulates rhizosphere signaling,plant architecture and affects reproductive development through strigolactone biosynthesis[J].The new phytologist,2012,196(2):535-547.
[34] GRIESMANN M,CHANG Y,LIU X,et al. Phylogenomics reveals multiple losses of nitrogen-fixing root nodule symbiosis[J].Science,2018,361(6398):1743.
[35] FOO E,DAVIES N W. Strigolactones promote nodulation in pea[J].Planta,2011,234(5):1073-1081.
[36] SOTO M J,FERNANDEZ-APARICIE M,CASTELLANOS-MO RALES V,et al. First indications for the involvement of strigolactones on nodule formation in alfalfa(Medicago sativa)[J].Soil biology and biochemistry,2010,42(2):383-385.
[37] WANG Y H,LI J Y. Branching in rice[J].Curr Opin Plant Biol,2011,14(1):94-99.
[38] YOSHIDA S,MARUYAMA S,NOZAKI H,et al. Horizontal gene transfer by the parasitic plant Striga hermonthica[J].Science,2010,328(5982):1128.
[39] URAGUCHI D,KUWATA K,HIJIKATA Y,et al. A femtomolar-range suicide germination stimulant for the parasitic plant Striga hermonthica[J].Science,2018,362(6420):1301-1305.
[40] 李天然.寄生被子植物的種子生理及其與寄主的相互關系[J].植物生理學通訊,1996,32(6):450-457.
[41] GONZ?魣LEZ-VERDEJO C I,BARANDIARAN X,MORENO M T,et al. An improved axenic system for studying pre-infection development of the parasitic plant Orobanche ramose[J].Annals of botany,2005,96:1121-1127.
[42] CAVAR S,ZWANENBURG B,TARKOWSKI P. Strigolactones:Occurrence,structure,and biological activity in the rhizosphere[J].Phytochem Rev,2015,14:691-711.
[43] 陳虞超,張? 麗,鞏? 檑,等.管花肉蓯蓉人工控制寄生技術研究[J].時珍國醫國藥,2017,29(10):2507-2510.
[44] 曹? 敏,余? 米,盧? 敏,等.菌根桑苗在石漠化和消落帶地區逆境脅迫下的生態適應性[J].蠶業科學,2017,43(2):189-195.
[45] 甘春雁,姚瑞玲,項東云,等.叢枝菌根化香椿幼苗對干旱脅迫的生長響應[J].廣西林業科學,2013,42(1):20-24.
[46] 張中峰,張金池,周龍武,等.叢枝菌根真菌對石漠化地區造林苗木生長的影響[J].生態學雜志,2018,37(10):2927-2934.
[47] 徐? 鵬,程亭亭,張? 超,等.叢枝菌根真菌對柳枝稷苗期生長作用機制的研究[J].草地學報,2017,26(5):1097-1102.
[48] 高? 雨,李? 穎,謝寅峰,等.獨腳金內酯調控植物側枝發育的分子機制及其與生長素交互作用的研究進展[J].植物資源與環境學報,2013,22(4):98-104.
收稿日期:2019-04-20
基金項目:河南省教育廳科學技術研究重點項目(15A150088)
作者簡介:鄭? 晨(1996-),女,河南洛陽人,本科,研究方向為林業科學,(電話)15093178969(電子信箱)819363425@qq.com。

