有機化學反應機理梳理及其教學新方法構建
吳紅梅, 郭 宇, 張志華, 陳強強
(遼寧工業大學化學與環境工程學院,遼寧錦州121001)
0 引 言
有機化學課程是醫藥、應用化工、化工、林學、食品和環境等眾多專業的學科技術基礎必修課程,其重要性是不言而喻的。傳統的教學主線為化合物的結構—命名—制備—物理性質—化學性質,學生孤立地接受著每個章節的知識,雖然教師也在盡力穿插著不同化合物的關聯性,但是初學者卻構建不起繁多反應之間的關系,對知識的理解和應用能力差,為了通過考試死記硬背的學生多,考完隨著大腦的格式化就忘得一干二凈,沒有真正發揮到基礎、支柱性課程的作用[1-4]。
當前,社會對人才的需求更加要求學生具備對知識的靈活應用能力,如制藥和染料等行業的研發崗位,學生如果不明晰反應過程,何談新產品、新工藝和新技術的升級、開發!在重新審視教學過程中發現了一個很關鍵的問題,授課過程中光顧面面俱到的講授基本知識和原理是不夠的,如何捋順知識脈絡、抓住有機化學的主線才是關鍵。有機反應機理(反應歷程)是化學反應從原料到產物經歷的實際過程,它是有機化學課程的主線和綱,若能緊緊抓住課程主線、圍繞反應規律進行講解,能顯著提高教學效果和質量[5-8],學生便會熟練駕馭有機化學的知識,游刃有余地運用反應規律解釋大量事實、分析和解決實際生產問題,同時也消除了學生在學習過程中存在的“學習興趣差、理解少、記憶多、應用差”的問題。2015年諾貝爾醫學生理獎獲得者屠呦呦,獲獎原因是發現了最有效的抗瘧疾藥物之一“青蒿素”,它可以從黃花蒿中提取,但是黃花蒿中“青蒿素”含量非常少,因此,人工化學合成是解決上述問題的主要途徑。若能夠掌握有機反應機理,指導性地進行有機合成便可以利用化學方法獲得自然界中的化合物,這也是有機反應機理的重要性和魅力所在。然而“反應機理”是有機化學課程的重點和難點問題,學生難理解、抓不住實質性的問題,如何能夠突破這一難題就顯得尤為重要。本文通過教學實踐總結出了學習“反應機理”的關鍵點和切入口,并按照以下順序和框架教授有機化學反應機理:有機物結構(基礎)→電子效應(切入點)→中間體穩定性(反應取向和規律),希望與同行共勉,便于學生理解與應用。
1 夯實基礎,強化基礎知識的學習和訓練
反應機理貫穿于整個有機化學,既是重點又是難點,學生之所以難理解的原因之一為對基礎知識理解深度不夠,應用知識分析問題的能力差,因此在講解反應機理前要注重以下知識的學習與運用。
(1)有機化合物的成鍵方式和結構。化合物結構決定性質、性質又反映結構,每種有機化合物之所以規律性地進行特定反應與化合物的結構密切相關,而結構中最基礎的就是成鍵方式。因此,只有通過有效掌握有機化合物共價鍵(σ鍵和π鍵)的成鍵過程,才能深入了解化合物的結構,從而為學習和應用反應機理做鋪墊。
以烯烴(乙烯,CH2=CH2)為例,碳原子的電子構型為1s22s22p2,按照雜化軌道理論,在形成烯烴過程中首先碳原子的2s軌道的一個電子被激發到2p軌道上,然后碳原子的1個2s軌道與2個2p軌道“雜化”組成3個能量等同的sp2雜化軌道,分別形成2個C—Hσ鍵和1個C—Cσ鍵,相互之間的鍵角接近120°形成平面型結構,其中沒有參與雜化的p軌道對稱軸垂直于該平面,彼此之間側面交疊形成π鍵(見圖1)。從成鍵方式很容易看出σ鍵和π鍵之間分布的電子云不同,σ鍵的電子云集中在2個碳原子核之間,不容易受到外界試劑進攻,π鍵電子云裸露在乙烯平面的上方和下方,電子云密度大、受原子核的束縛小、流動性強,因而具有供電性能,容易受缺電子試劑(親電試劑)的進攻,發生經典化學反應為親電加成反應。同理,其他化合物發生的化學反應也能從成鍵方式及結構推出,有利于學生建立化合物與各類反應的關系、理解有機化學反應規律。
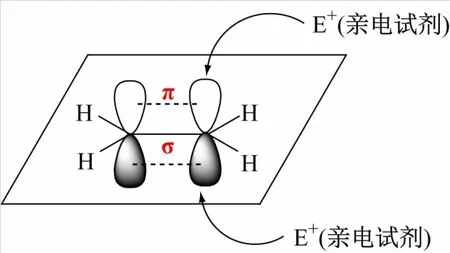
圖1 乙烯分子的成鍵方式及結構
(2)有機化學中的取代基效應。初學者往往對取代基效應的基本意義含糊不清,導致在后續有機化學課程學習中不能夠正確分析反應的過程和機理。因此,明晰取代基效應是學好有機化學的關鍵部分。取代基效應是不同取代基對有機反應的影響,主要包括電子效應和空間位阻(立體效應)效應[9],如圖2所示。其中,電子效應是由于取代基供—吸(推—拉)電子性質,引起化合物某部分的電子云密度升高或下降,使化合物在反應的某個階段帶有負電荷或正電荷的效應。
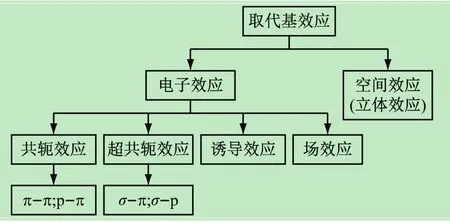
圖2 有機化學反應中的取代基效應
電子效應是反應機理的核心問題,也是教學過程的關鍵點和切入點。因此,只有正確認識電子效應,才能真正開啟反應機理的大門。電子效應根據其作用和傳遞方式不同,可分為誘導效應、共軛效應和場效應。事實上,學生要深入理解的實質性問題可歸納為:①誘導效應具有累加性,通過σ鍵傳遞,并且隨著距離的增加而減弱,一般不超過3個碳原子。②場效應和誘導效應都是電子效應,但它不通過碳鏈(σ鍵)傳遞,二者傳遞方式不同。③“共軛”具有“平均分擔”之意,因此共軛的分子比非共軛分子穩定;超共軛效應比共軛效應弱;共軛鏈中π電子轉移時正負電荷交替出現。
只要學生透過概念充分理解每種電子效應實質,才能夠應用電子效應處理如下問題:①判斷有機分子整體或局部電子云分布;②判斷反應物或中間體總體電子云密度減少或增多的情況;③判斷有機反應中間體的穩定性;④判斷有機物酸堿性強弱。學生根據上述原理,便能夠判斷化合物發生反應的類型、影響因素,甚至可以設計新的化合物和反應,對有機化學及其相關學科學習十分有益。
與電子效應截然不同的是空間位阻效應,它是由于分子中某些基團(或原子)占據一定的空間位置,影響反應產物的取向和反應活性的效應,是物理的相互作用。因此,當有機反應機理大門打開后,反應到達終極目標前還會受到電子效應、空間效應和溶劑效應的協同影響,學生需要根據具體情況做出有效判定。
2 以電子效應為切入點開啟反應機理大門
要靈活掌握各類反應及其機理,關鍵要引導學生分析化合物的結構和電子云的分布情況,得出化合物是富電子體系還是缺電子體系,找出反應的“入口”,從而判斷化合物能夠發生的反應類型(親電類反應、親核類反應和自由基反應等)和反應規律。在有機化學反應中,由于反應物電子云分布不均勻使共價鍵發生異裂而發生離子型反應,以親電或親核機理進行。正是電子云分布不均勻的結果,給外界試劑提供了進攻的機會,決定著反應以何種機理進行。
以化合物乙烯、苯、鹵代烴和醛(或酮)來說明反應機理的切入過程,如圖3所示。
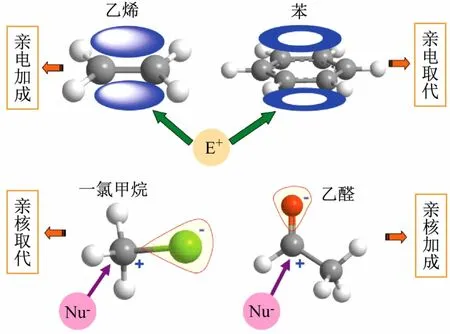
圖3 以電子效應為切入點判斷不同有機化合物反應機理的示意圖
乙烯的π電子云處于所在平面的上方和下方,電子云分布均勻,是富電子體系,易受缺電子的親電試劑(E+)進攻,導致π鍵斷裂完成親電加成反應。苯(芳烴)π電子云平均化,完全離域到整個環形軌道上構成閉合形狀,處于苯環所在平面的上方和下方,是富電子體系,易受親電試劑(E+)進攻,但由于π電子云的高度離域使6個C-C鍵鍵長完全相等,既不是一般的單鍵,也不是一般的雙鍵,形成異常穩定的分子結構(具有芳香性),親電試劑進攻后不容易破壞它的共軛大Π鍵,因此主要發生的是親電取代反應。鹵代烴(R—X),如一氯甲烷,由于碳原子的電負性比鹵素小得多,因此C—X鍵是極性共價鍵,容易斷裂;另外,由于鹵素的電負性大,電子云偏向鹵素(—X),使裸露的α—C帶部分正電荷(缺電子),易受親核試劑(Nu-)進攻,發生親核取代反應(鹵素被取代)。醛(或酮)的官能團碳-氧雙鍵(—C=O),與烯烴碳-碳雙鍵(—C=C—)的共性是都由一個σ鍵和一個π鍵組成,具有平面型結構,然而由于碳的電負性小于氧,因而電子云偏向氧原子,使羰基碳原子帶部分正電荷(缺電子),易受親核試劑(Nu-)進攻發生親核加成反應。從以上幾類典型化合物的分析,得出以化合物結構為基礎,以電子效應為切入點便可預測反應的類型,為進一步優化反應奠定基礎。
3 運用取代基效應分析反應中間體的穩定性,明析反應活性和反應規律
反應“入門”后,要經歷“中轉站”(中間體)而到達終點。化合物中間體是在反應過程中暫時生成且瞬間存在的物種,它較難分離、非常活潑。因此,在確定反應類型的基礎上,明晰不同中間體的穩定性,才能確定反應的取向、活性和反應速率等規律,有效地調控反應[10-12]。根據共價鍵的斷裂方式,可分碳正離子(R3C+)、碳負離子(ClCH-2)和自由基(R3C·)3 種中間體,不同反應經歷的中間體也不同,如圖4所示。
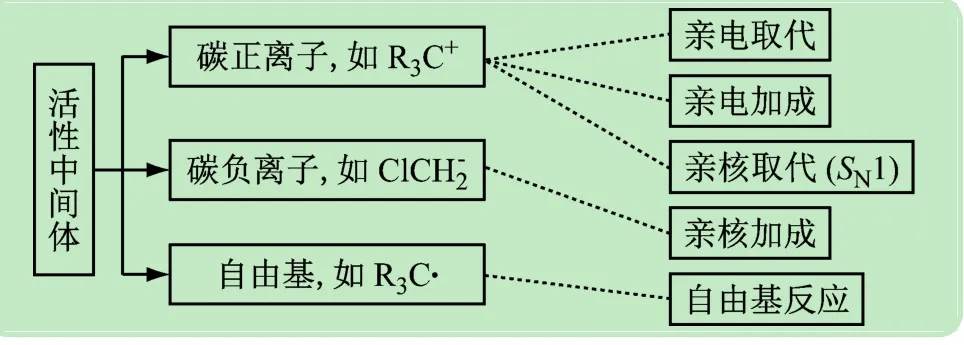
圖4 反應中活性中間體的組成及其參與的反應類型
以烯烴親電加成(中間體為碳正離子)為例,具體說明如何通過分析中間體的特性深入學習和理解有機反應的過程,如圖5所示。
烯烴(A—CH=CH2)的反應活性取決于取代基A的特性。若A為供電子基團則增大了烯烴的電子云密度,使其進行親電加成反應的活性增加,反之,若A為吸電子基團則降低了烯烴的電子云密度,進行親電加成反應的活性降低。當烯烴(A—CH=CH2)被親電試劑E+(如H+)進攻后,首先生成中間體碳正離子(A—C+H—CH3和A—CH2—C+H2),主產物的取向與碳正離子的穩定性有關。A的性質直接影響反應的過程。①當A為供電子基團時,與中間體正電中心直接相連的A基團和—CH3的供電子誘導作用分散了碳正離子的正電荷,因此A—C+H—CH3的穩定性高于A—CH2—C+H2,碳正離子越穩定、反應越容易進行,繼而得到Markownikoff規則主產物。②當A為吸電子基團時,與正電中心直接相連,A基團的吸電子誘導作用會使碳正離子的正電荷更集中,穩定性下降,使A—C+H—CH3的穩定性低于A—CH2—C+H2,所以主產物是反Markownikoff規則產物。
除此之外,對于不對稱烯烴(如3-甲基-1-戊烯)而言,在反應過程中通過氫或者甲基遷移等途徑,重排為更穩定的碳正離子,得到重排產物(主產物),見圖6。由此可見,中間體穩定性的導向作用決定著反應的方向、活性和速率等因素,學會綜合運用這些效應分析化合物的結構、中間體和反應的影響因素,使學生能夠游刃有余地解決各類有機反應問題。
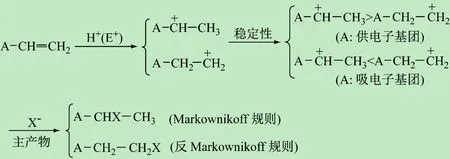
圖5 烯烴A—CH=CH2親電加成反應規律
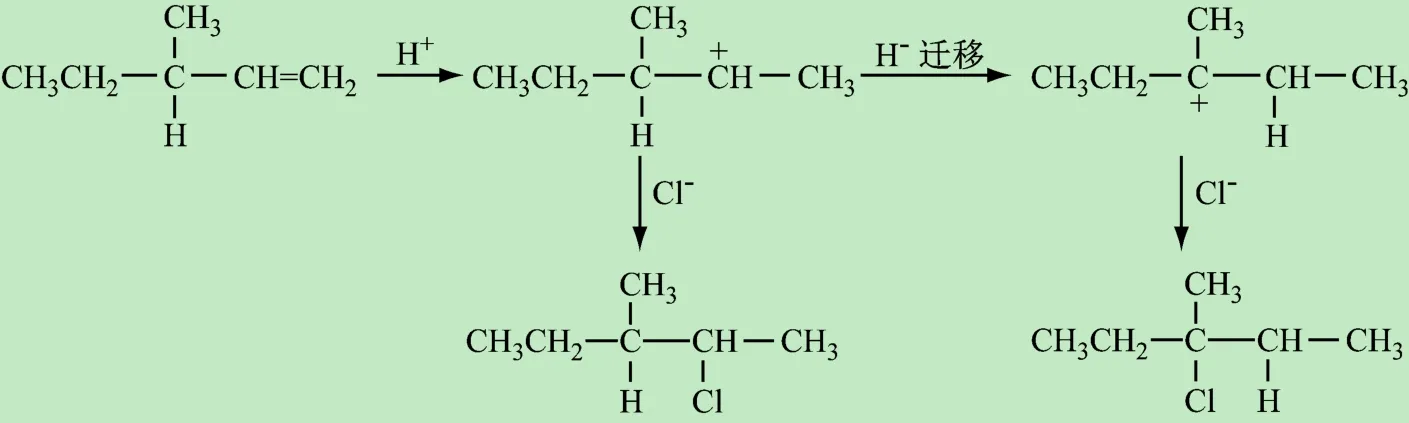
圖6 3-甲基-1-戊烯親電加成重排機理
4 思維導圖構建有機化合物與反應機理的關聯
通常,基礎有機化學的教材主要是按照官能團來分章節編寫的,如何將不同化合物與反應機理相關聯是授課的難點和重點。為解決上述問題,筆者在授課過程中以課程主線—反應機理來授課,并利用思維導圖來逐步構建不同化合物、不同類型有機化學反應的關聯、整體把握知識脈絡,這樣可以極大地提高大腦的記憶、運行速率,提高對知識的儲存、分析、管理和應用拓展能力[13-15]。
圖7所示是根據不同的反應機理,構建的思維導圖。以“反應機理”為核心問題(中心),不同類型的反應機理為主要節點展開,將有機化學教材中的反應過程囊括在三大分支(離子型反應、自由基反應、協同反應)上。根據該思維導圖,學習反應機理與不同化合物的關聯性可分為3個階段。
(1)由中心“反應機理”發散出來的3個節點是并列關系。如,經過活性中間體碳正離子或碳負離子進行的離子型反應、經過自由基中間體的自由基反應、無中間體一步完成的協同反應。
(2)大方向確定后,根據反應條件及反應過程中化學鍵的斷裂和形成方式發散出更為細化的機理類型。離子型反應進一步引申出親電加成、親電取代、親核加成、親核取代、消除反應;自由基反應(光照或過氧化物催化)引申出自由基加成反應和自由基取代反應。
(3)將具體的化學反應對號入座,以化合物結構為基礎、電子效應為切入口、經中間體的導向作用建立反應與機理間清晰的關聯網絡。如烯烴、二烯烴和炔烴都是富電子體系(π電子云),易受親電試劑進攻,π鍵斷裂形成碳正離子中間體,再加成得到飽和σ鍵,最終完成親電加成反應。這里需要注意的是炔烴雖然電子云密度比烯烴高,但親電加成反應的活性低于烯烴,并且在催化劑(如HgSO4等)存在下也易于進行親核加成反應。這是因為炔烴sp雜化軌道的電負性大于烯烴雙鍵sp2雜化,易受到親核試劑進攻,催化劑先與炔烴形成π絡合物,使π電子向金屬的空軌道轉移,在一定程度上降低炔烴的電子云密度,從而有利于親核試劑進攻,進行親核加成反應。
該思維導圖對有機化學瑣碎的反應信息進行了分類整理,每個分支都是按照邏輯層次展開,歸類分明、層次細化,以反應機理為主線向學生展示了整個教材的框架,使學生能夠在短時間內總攬知識、把握脈絡,有利于發散思維的形成,提高學生的學習興趣和學習效率。
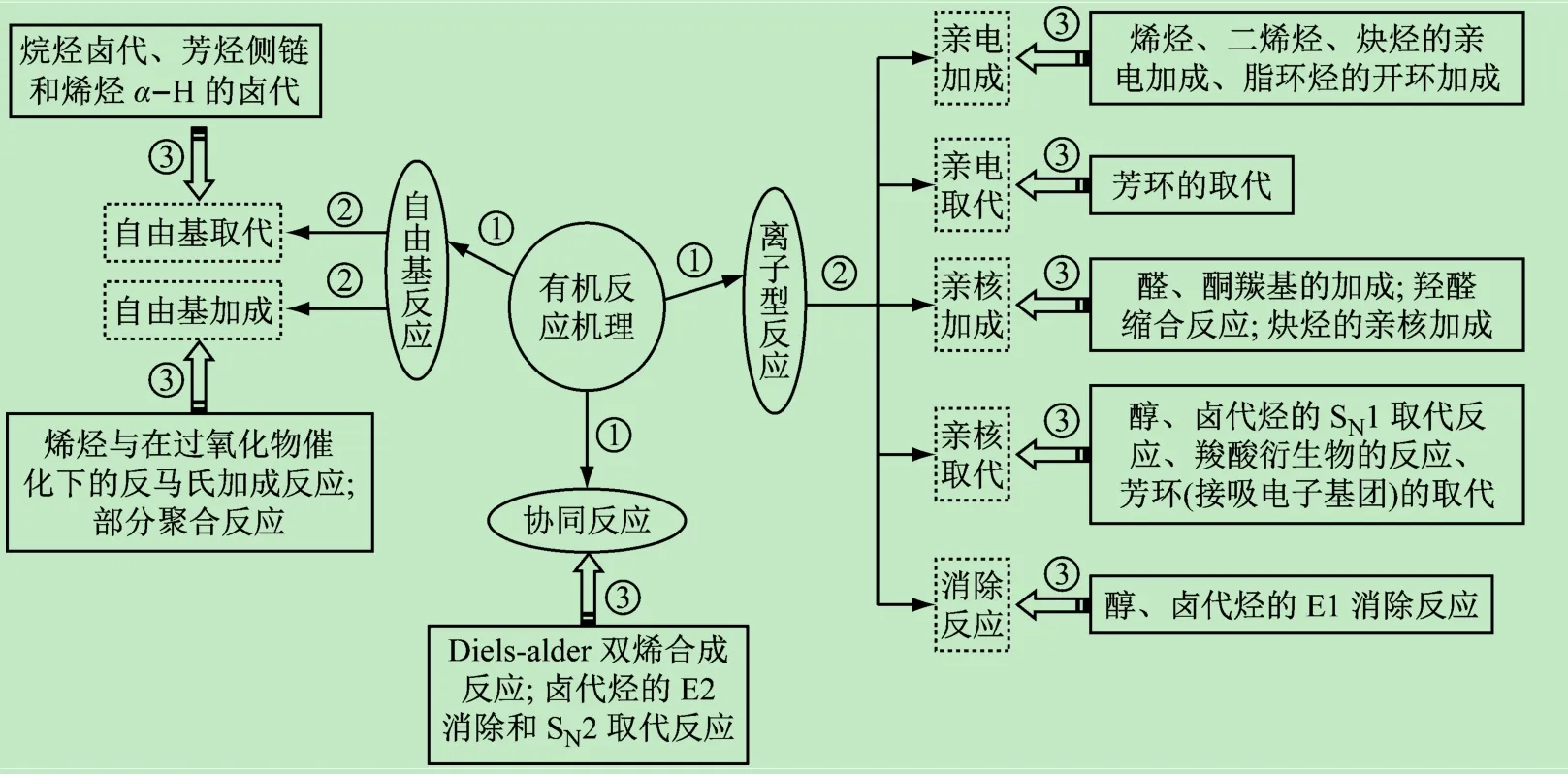
圖7 有機化合物反應機理思維導圖
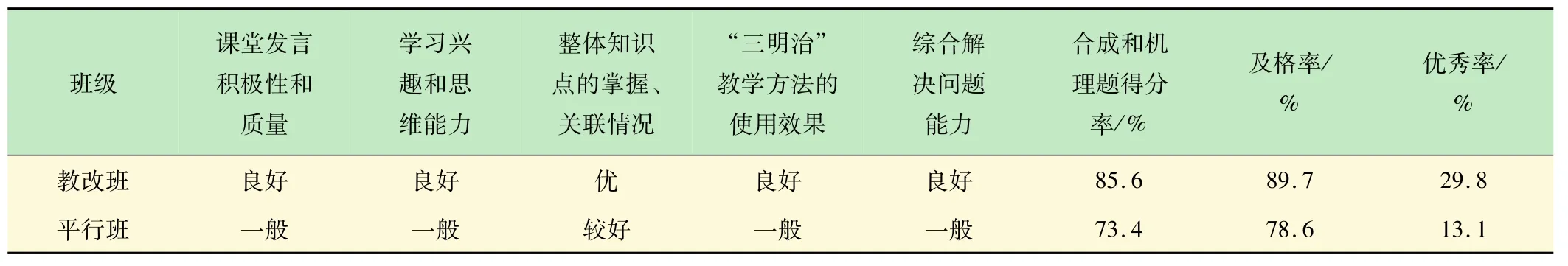
表1 教改班與平行班教學成效分析結果
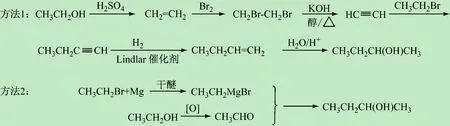
圖8 2-丁醇的合成路線
5 成效分析
通過對教改班(化工161班,反應機理主線授課)和平行班(化工162班和163班,按照官能團分章授課)教學效果進行對比分析(見表1),得出如下結果:①教改班課堂教學效果好,同學們能夠循序漸進地跟進教師的步伐,思路清晰、積極發言,正確率高;對整體知識的把控較好,能夠根據思維導圖建立清晰的脈絡,舉一反三能力、思維判斷及推理能力、綜合分析和解決問題能力較高;在期末考試中合成和機理題得分率為85.6%、及格率為89.7%、優秀率高達29.8%;②平行班學生在授課前期效果較好,到了后期部分學生力不從心,覺得知識繁多記不住,無法構建眾多化合物和反應及機理間的關聯,教學效果和綜合解決問題能力一般,因此合成和機理題得分率、及格率和優秀率都比教改班低;③“有機反應機理”主線式授課思路易于與新教學方法相融合、并促進新教學方法的高效實行和推廣。筆者在前期教學改革工作中,將“三明治”教學方法[16]應用于有機化學課程,取得了一些成效。結果表明,教改班對有機化學課程內容掌握效果較好。這主要是由于該班以反應機理為主線授課,思路清晰、關聯性較強,學生只要能夠聽懂一到二個機理的推演過程,便能夠聞一知十地理解其他反應機理,對化合物的反應和機理理解較為深入,尤其在團隊合作處理新問題方面顯得更為突出。如,教改班的學生提出了兩種“以乙醇為原料合成2-丁醇(中間產物)”的方法(見圖8)。第1種方法應用了消除反應、親電加成和催化加氫等反應機理;第2種方法應用了氧化反應和親核加成的反應機理。這充分體現了他們勇于探索、分析和解決問題能力較強,使新的教學方法得到了升華。由此可見,有機反應機理授課主線和思路的應用對教師授課、學生聽課和新教學方法的推行極為有利,將來有望在MOOC教學中取得更好的效果。
6 結 語
為了更有效地發揮有機化學課程基礎性和支柱性的作用,理清教學主線是十分必要的,通過反應機理這一主線進行教學能夠使學習者明晰有機化合物性質、運用反應規律分析和解決實際問題,是教學過程的重中之重。通過多年的教學實踐,得出反應機理的教學過程要分層次、分步驟、循序漸漸地進行:首先以化學鍵的形成為突破口掌握不同化合物的結構和電子云分布;然后以電子云的分布為切入點分析反應進行的機理(反應類型);再綜合利用取代基效應和溶劑效應等因素分析反應過程中活性中間體的穩定性,進而判斷反應的取向和反應規律。從中可以看出電子效應在反應機理的教學和學習過程中起著至關重要的作用,應用電子效應可以找到反應的切入口,分析反應中間體的穩定性,因此在教學過程中要著重對其進行講解和靈活運用。從成效分析可以看出,以反應機理為主線的授課思路和方式不僅能夠提高學生的學習興趣、提升教學效果和成績的及格率和優秀率,而且有利于深化教學改革。

