新型蛋白酶體抑制劑膝關腔內注射對兔骨關節(jié)炎的治療作用及其機制
吳培剛,楊學棟,曹振昊,姜厚森,李忠
1濰坊醫(yī)學院,山東濰坊 261000;2濰坊市人民醫(yī)院
骨性關節(jié)炎(OA)是中老年人群中最常見的疾病,嚴重影響患者的身體健康和生活質量,近年對其研究越來越重視[1~7]。OA發(fā)生后,關節(jié)滑膜中的NF-κB功能增強,能夠促進炎癥因子的大量產(chǎn)生與釋放,最常見有炎癥因子如白細胞介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)、轉化生長因子-β(TGF-β)[8~12]。同時,上述炎癥介質及細胞因子均為NF-κB的誘導劑或激活劑,炎癥因子會通過IL-1β/IκB激酶β(IKKβ)/核因子-κB(NF-κB)/基質金屬蛋白酶-9(MMP9)通路進行信號轉導來減輕炎癥反應的過程,保護關節(jié)軟骨[13,14]。新型蛋白酶體抑制劑(YSY-01A)是通過化學合成的一種新型的蛋白酶體抑制劑,具有很強的殺傷腫瘤細胞及抗乳腺癌的作用,機制是可以抑制腫瘤細胞的增殖,誘導細胞周期阻滯于G2/M期,并調節(jié)周期相關蛋白的表達[15~17]。本研究觀察了YSY-01A對兔OA的治療作用,并探討其機制。
1 材料與方法
1.1 主要藥物 YSY-01A,由濰坊醫(yī)學院藥理學實驗室合成并提供,純度均在99%以上,溶于DMSO中,配制成濃度0.01 mol/L,-20 ℃保存。
1.2 實驗動物及分組 健康成年新西蘭大白兔36只,體質量2.5~3.0 kg,雌雄不限。將36只健康新西蘭大白兔隨機分為干預組、模型組、對照組各12只。
1.3 OA模型制備、YSY-01A給予方法 干預組、模型組均制備OA模型,即在嚴格無菌操作下,取5%氯胺酮2.0 mL,用生理鹽水稀釋至6.0 mL,以3 mL/1 000 g肌肉注射麻醉后,取仰臥位,將新西蘭兔固定于操作臺,剔除右后肢毛并消毒。由膝關節(jié)內側處切開2.5 cm進入膝關節(jié)腔。膝關節(jié)稍屈曲,將髕骨推向一側,切除前1/3內側半月板、切斷前交叉韌帶。抽屜實驗證明前交叉韌帶完全斷裂后,用大量生理鹽水沖洗刀口,用1號絲線縫合切口,制模后每只樣本連續(xù)3天腹腔注射4萬U青霉素,飼養(yǎng)期間如有出現(xiàn)感染則該只大白兔突出實驗,健康的大白兔補入各組。手術結束后,為防止實驗動物之間因相互咬傷、攻擊造成的不確定因素的增加,所有的動物標記后在標準飼養(yǎng)條件下單兔單籠飼養(yǎng),注意保溫和補液。制模1周后,干預組膝關腔內注射YSY-01A 1 mL,模型組和對照組膝關腔內注射0.9%生理鹽水1 mL,每周2次,共8次,共4周。
1.4 兔膝關節(jié)軟骨組織病理觀察 制模后4周處死所有兔,手術切開膝關節(jié)腔,切取右側股骨內側髁處厚度約2 mm關節(jié)軟骨,將取出的膝關節(jié)軟骨組織立即進行4%多聚甲醛固定,石蠟包埋、切片于-20 ℃冰箱保存。取出石蠟切片,室溫靜置15 min,經(jīng)二甲苯脫蠟,梯度乙醇梯度脫水,HE染色6 min,鹽酸乙醇分化30 s,后伊紅液染色2 min。再次梯度酒精脫水,二甲苯石碳酸(3∶1)1 min,二甲苯(Ⅰ)、二甲苯(Ⅱ)各1 min,中性樹脂封片。然后在光學顯微鏡下觀察軟骨細胞,并拍照記錄。
1.5 兔滑膜組織IL-1β、TNF-α、TGF-β蛋白檢測 取制模后4周處死兔的關節(jié)滑膜組織,行4%多聚甲醛固定,石蠟包埋,切片于-20 ℃冰箱保存。采用免疫組化SP法檢測滑膜組織IL-1β、TNF-α、TGF-β蛋白,具體步驟:將切片室溫放置 15 min;正常山羊血清37 ℃封閉30 min,傾去多余血清,滴加兔抗兔IL-1β、TNF-α、TGF-β多克隆抗體(1∶200),4 ℃過夜;滴加生物素化山羊抗兔二抗工作液,37 ℃孵育 60 min;滴加辣根過氧化物酶標記的鏈霉卵白素工作液,37 ℃孵育60 min;DAB避光顯色1~3 min。以上各步驟之間除山羊血清封閉外,均需用0.01 mol/L PBS沖洗。反應完畢后,切片行蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片,光鏡下觀察,計數(shù)陽性細胞數(shù),取平均值。
1.6 兔滑膜組織MMP9、NF-κB、IKKβ mRNA檢測 取制模后4周處死兔的關節(jié)滑膜組織,TRIzol法提取組織總RNA,按逆轉錄試劑盒操作說明將2 μg總RNA進行逆轉錄和聚合酶鏈反應。PCR反應體系:Premix Taq 25 μL,上、下游引物各1 μL,模板2 μL,加滅菌雙蒸水補足至50 μL。PCR反應條件:94 ℃預變性5 min,94 ℃、30 s,60 ℃(NF-κB、IKKβ)或56 ℃(MMP-9、GAPDH)、30 s,72 ℃、30 s,35個循環(huán);72 ℃延伸10 min。PCR擴增產(chǎn)物行2%瓊脂糖凝膠電泳,利用Gel圖像分析系統(tǒng)分析電泳條帶,以目的基因與內參GAPDH基因條帶OD值比值表示目的基因相對表達量。

2 結果
2.1 各組兔膝關節(jié)軟骨病理變化 對照組:軟骨表面排列平滑、整齊,軟骨細胞層次清楚,排列規(guī)則,潮線流暢(圖1A);模型組:軟骨表面可見缺損,局部裂隙伸入下方,軟骨細胞層次不清,細胞呈重度的彌漫性增生,結構紊亂,增厚鈣化,潮線模糊(圖1B);干預組:各層結構相對于模型組好轉,分層比價清楚,軟骨細胞輕、中度增生,呈現(xiàn)多層次潮線(圖1C)。

注:A為對照組,B為模型組,C為干預組。
圖1 各組膝關節(jié)軟骨病理變化
2.2 各組兔關節(jié)滑膜組織中IL-1β、TNF-α、TGF-β蛋白陽性細胞數(shù)比較 兔關節(jié)滑膜組織中IL-1β、TNF-α、TGF-β蛋白陽性細胞數(shù)比較見表1。

表1 各組兔滑膜組織IL-1β、TNF-α、TGF-β蛋白陽性細胞數(shù)比較(個,
注:與對照組比較,*P<0.05;與模型組比較,△P<0.05。
2.3 各組兔關節(jié)滑膜組織MMP9、NF-κB、IKKβ mRNA相對表達量比較 兔關節(jié)滑膜組織MMP9、NF-κB、IKKβ mRNA相對表達量比較見表2。
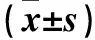
表2 各組滑膜組織MMP9、NF-κB、IKKβ mRNA相對表達量比較
注:與對照組比較,*P<0.05;與模型組比較,△P<0.05。
3 討論
OA是一種常見于老年人的退行性關節(jié)疾病,嚴重影響患者的身體健康和生活質量,給家庭及社會帶來了巨大的經(jīng)濟負擔。OA臨床上以慢性的關節(jié)疼痛、僵硬、骨性肥大、骨性摩擦音及活動受限最為常見,藥物治療中非類固醇類抗炎藥通常被認為是治療OA的首選的一線藥物治療[16],但是長期使用非類固醇類抗炎藥引起的不良反應[17]。關節(jié)軟骨是OA發(fā)生、發(fā)展過程中最易侵犯的部位,軟骨細胞是關節(jié)軟骨內合成軟骨基質的惟一細胞,對維持關節(jié)軟骨的正常結構和功能至關重要。當軟骨細胞受到炎癥因子、機械應力等刺激時,會通過細胞內的信號轉導途徑,將信號傳遞給各種轉錄因子,從而調控軟骨組織的發(fā)生、改建、內環(huán)境的穩(wěn)定以及創(chuàng)傷修復等病理生理過程。YSY-01A是一種新型的蛋白酶體抑制劑,能抑制多種細胞的增殖和分化,具有很強的殺傷腫瘤細胞及抗乳腺癌的作用,機制是可以抑制腫瘤細胞的增殖,誘導細胞周期阻滯于G2/M期,并調節(jié)周期相關蛋白的表達,這與其能抑制CT-L、T-L、PGPH活性關系密切相關[18],YSY-01A可能對兔OA起到基因治療作用。
IL-1β由免疫細胞分泌合成,是IL-1最常見的亞型,其正常情況下滑膜細胞及軟骨細胞內少量存在,關節(jié)炎發(fā)生時其含量會升高,與其受體特異性結合后參與多種信號的傳導,從而引起一系列炎癥級聯(lián)反應[19]。TNF-α是在相關炎癥反應中最早出現(xiàn)的炎癥因子,通過刺激淋巴細胞、中性粒細胞,進而增加血管內皮細胞的通透性,并能促進其他細胞因子的產(chǎn)生。IL-1β、TNF-α 兩者在OA的發(fā)生過程中,能加快軟骨的破壞,軟基質降解,促進軟骨細胞的分化、再生。TGF-β是一種起重要調控作用的多效性細胞因子,加快軟骨的自身修復,促進急性炎癥消退及修復。目前的研究認為OA的預防及治療可以通過抑制關節(jié)軟骨組織中IL-1β及TNF-α的產(chǎn)生來進行[20]。大量研究表明,作為關節(jié)軟骨內的要膠原成分的Ⅱ型膠原的含量高低與OA有密切。通過測量膠原蛋白的含量高低可以得知骨軟骨破壞的程度,其含量與OA的進展存在相關性[21~23]。本研究發(fā)現(xiàn),模型組和干預組中兔膝關節(jié)滑膜組織中IL-1β、TNF-α陽性細胞數(shù)高于對照組,但干預組膝關節(jié)滑膜組織中IL-1β、TNF-α陽性細胞數(shù)低于模型組,這說明YSY-01A能抑制滑膜組織中IL-1β、TNF-α表達。模型組和干預組關節(jié)滑膜組織中TGF-β陽性細胞數(shù)低于對照組,但干預組關節(jié)滑膜組織中TGF-β陽性細胞數(shù)高于模型組,這說明YSY-01A能促進TGF-β的表達。同時軟骨的病理結果顯示模型組軟骨表面可見缺損,局部裂隙伸入下方,軟骨細胞層次不清,細胞呈重度的彌漫性增生,結構紊亂,增厚鈣化,潮線模糊,而行YSY-01A治療的干預組相對于模型組各層結構分層相對清楚,軟骨細胞輕、中度增生,呈現(xiàn)多層次潮線。
當IL-1β和其受體IL-R結合后,會激活相關信號傳導通路,并進一步將信號傳遞給相對應的載體,并聚集IKK復合體,激活NF-κB復合體從而進入細核內,促進TNF-α、TGF-β、MMP9等諸多炎癥因子基因表達。IL-1β-NF-κB通過正反饋作用,促使MMP9、TGF-β、TNF-α大量表達,大量產(chǎn)生的炎癥因子通過直接細胞毒作用、收縮毛細血管破壞軟骨細胞。同時MMP系統(tǒng)抑制MMP9從而可以減少對軟骨基質的降解,IL-1β的激活是上述兩種傷害軟骨途徑的關鍵。但是當YSY-01A在阻斷IKKβ激活時,NF-κB復合體不能夠通過核膜進入核內,抑制了IL-1β的基因表達,MMP系統(tǒng)受到抑制,最終減慢軟骨的退化[24],IL-1β/IKKβ/NF-κB/MMP9信號轉導通路阻斷與實驗中兔軟骨細胞降解速度明顯減慢,軟骨退變速率明顯減慢密切相關。本研究顯示,與對照組比較,干預組和干預組滑膜組織MMP9、NF-κB、IKKβ mRNA表達升高;與模型組比較,干預組滑膜組織MMP9、NF-κB、IKKβ mRNA表達降低。說明YSY-01A可以通過阻斷NF-κB信號轉導通路從而干預了軟骨基質的降解,抑制軟骨細胞代謝,阻斷軟骨細胞的凋亡,延緩軟骨退變,緩解OA的進展。
總之,YSY-01A對兔OA有治療作用,其機制可能是通過抑制IL-1β、TNF-α表達,增強TGF-β表達,進而阻斷IL-1β/IKKβ/NF-κB/MMP9正反饋信號通路。

