黃芪多糖對梗阻性黃疸大鼠腸損害的治療作用及其機(jī)制探討
黃忠義,陳飛,張貫啟,鄔善敏
武漢大學(xué)人民醫(yī)院,武漢 430000
梗阻性黃疸(OJ)在充分的術(shù)前評(píng)估和術(shù)后護(hù)理仍具有較高的病死率,其主要原因?yàn)槟c黏膜屏障破壞、腸源性毒血癥形成,最終導(dǎo)致多器官功能不全[1,2]。基礎(chǔ)和臨床研究[1]已證明,OJ可導(dǎo)致腸內(nèi)細(xì)菌移位和內(nèi)毒素血癥,這是導(dǎo)致全身炎癥反應(yīng)及嚴(yán)重并發(fā)癥的關(guān)鍵因素,其中小腸黏膜屏障功能損害是最關(guān)鍵的環(huán)節(jié)。所以,減輕OJ患者腸損害對預(yù)后至關(guān)重要。全身炎癥反應(yīng)又可加重OJ的病情,炎癥因子包括促炎因子和抗炎因子,TNF-α、IL-1β、IL-6、IL-8作為促炎因子可促進(jìn)炎癥的發(fā)展,相反抗炎因子IL-1Ra、IL-4、IL-6、IL-10、IL-11、IL-13可通過調(diào)節(jié)促炎因子的反應(yīng)來阻止這一過程,這是生物組織對炎性過程的保護(hù)反應(yīng)[3]。APS是從黃芪根中提取的多糖,具有免疫調(diào)節(jié)、抗炎、抗氧化、抗腫瘤和抗病毒活性等功能[4~9]。雖然有許多研究表明APS具有抗炎作用,但是對OJ腸功能是否有保護(hù)作用仍然不清楚。2019年4~9月,我們觀察了APS對OJ大鼠腸損害的治療作用,并探討其可能機(jī)制。
1 材料與方法
1.1 藥物及主要試劑 APS生理鹽水溶液(40 mg/mL,Sigma公司)。TLR4、NF-κB P65、PCNA一抗購自南京建成公司,TNF-α、IL-1β、IL-Ra、IL-10的ELISA試劑盒購自安迪生物,DAO檢測試劑盒和I-FABP檢測試劑盒購自武漢谷歌生物有限公司。
1.2 實(shí)驗(yàn)動(dòng)物及分組 雄性Wistar大鼠48只,10~12周齡,均購自北京維通利華實(shí)驗(yàn)動(dòng)物有限公司。所有大鼠均在武漢大學(xué)人民醫(yī)院動(dòng)物中心飼養(yǎng),環(huán)境溫度控制在25 ℃,模擬12 h白天/12 h夜晚的晝夜循環(huán),自由進(jìn)食水。所有大鼠隨機(jī)分為干預(yù)組、模型組、對照組各16例。
1.3 OJ模型制備、APS應(yīng)用及標(biāo)本取材 手術(shù)操作均在異氟烷吸入麻醉下進(jìn)行。腹部正中行長約2 cm左右的縱切口切開皮膚,再用止血鉗向上輕提腹壁,剪刀剪開腹壁進(jìn)入腹腔。充分止血后將胃向上翻起露出十二指腸及膽總管,再用眼科鑷鈍性分離膽總管至左右膽管匯合處。模型組及干預(yù)組在靠近左右膽管匯合處雙重結(jié)扎并離斷,對照組僅分離膽總管。術(shù)后每天灌胃時(shí)觀察大鼠毛發(fā)及鞏膜黃染情況來評(píng)估造模情況。模型組有1只在術(shù)后9天死亡,解剖發(fā)現(xiàn)為膽漏造成腹腔感染而死,其余老鼠正常,該老鼠直接剔除未進(jìn)行增補(bǔ)。在造模24 h之后,干預(yù)組大鼠灌胃給予APS生理鹽水溶液(100 mg/kg),對照組及模型組灌胃給予同量生理鹽水,2次/d,分別為08∶00和20∶00兩個(gè)時(shí)間點(diǎn)。各組大鼠在實(shí)驗(yàn)14天時(shí)取血,血液均取自下腔靜脈,靜止30 min后于4 ℃低溫下離心,以12 000 r/min速度離心10 min,取血清,并凍于-80 ℃深低溫冰箱備用。取血后處死,取肝臟左外葉肝組織和上段小腸組織,部分用4%中性多聚甲醛固定24 h,制備石蠟切片,待光鏡觀察。另一部分放入凍存管,于-80 ℃深低溫冰箱冰凍保存,用于后續(xù)實(shí)驗(yàn)指標(biāo)檢測。
1.4 大鼠血清DOA、I-FABP及組織增殖細(xì)胞核抗原(PCNA)蛋白檢測
1.4.1 血清DOA、I-FABP 采用ELISA法。具體操作步驟:①抗鼠二胺氧化酶單抗包被于酶標(biāo)板上,標(biāo)本和標(biāo)準(zhǔn)品中的二胺氧化酶會(huì)與單抗結(jié)合,游離的成份被洗去。②加入酶標(biāo)抗體,抗鼠二胺氧化酶抗體與結(jié)合在單抗上的鼠二胺氧化酶結(jié)合而形成免疫復(fù)合物,游離的成分被洗去。③加入顯色底物,若反應(yīng)孔中有二胺氧化酶,辣根過氧化物酶會(huì)使無色的顯色劑現(xiàn)藍(lán)色,加終止液變黃。在450 nm處測OD值,二胺氧化酶濃度與OD450值之間呈正比,可通過繪制標(biāo)準(zhǔn)曲線求出標(biāo)本中的二胺氧化酶濃度。I-FABP的方法原理同DAO的檢測方法。
1.4.2 組織增殖細(xì)胞核抗原(PCNA)蛋白 采用Western blotting法。具體步驟:①小腸組織總蛋白提取,在冰上配置裂解液,體積比為RIPA∶cocktail∶PMSF=100∶2∶1,超聲裂解小腸組織,裂解液12 000 g,4 ℃離心5 min。②BCA法測定蛋白濃度,比色分析,測定595 nm處的OD值。于Excel表中根據(jù)標(biāo)準(zhǔn)品繪制標(biāo)準(zhǔn)曲線,根據(jù)得出的公式計(jì)算樣本濃度。③SDS-PAGE電泳。④轉(zhuǎn)膜。⑤封閉:膜用TBST沖洗干凈,將膜用移至含有脫脂牛奶的平皿中搖床上室溫封閉1.5 h。⑥孵育一抗,從封閉液中取出膜,用TBST清洗3次,每次5 min。將一抗PCNA(1∶2 000),GAPDH(1∶8 000)用封閉液稀釋至適當(dāng)濃度。⑦孵育二抗,選擇和一抗種屬相對應(yīng)的二抗,室溫孵育1.5 h。用TBST在室溫下脫色搖床上分別清洗10、5、5 min,3次。免疫反應(yīng)條帶在奧德賽雙色紅外激光掃描系統(tǒng)(LI-COR Biosciences)上顯示。蛋白定量采用Image Pro 6.0軟件對條帶進(jìn)行掃描定量,統(tǒng)計(jì)灰度值的結(jié)果。
1.5 大鼠小腸組織腺窩深度、絨毛高度觀察及上皮細(xì)胞凋亡數(shù)計(jì)數(shù)
1.5.1 組織腺窩深度、絨毛高度 將小腸組織切成厚薄為14 μm的切片,并行HE染色,光學(xué)顯微鏡下觀察腺窩深度、絨毛高度,評(píng)估小腸病理損害程度。
1.5.2 組織上皮細(xì)胞凋亡數(shù) 采用末端脫氧核苷酸轉(zhuǎn)移酶dUTP鎳端標(biāo)記法(TUNEL)。具體步驟:①石蠟切片脫蠟,依次將切片放入二甲苯Ⅰ、20 min,二甲苯Ⅱ、20 min,無水乙醇Ⅰ、10 min,無水乙醇Ⅱ、10 min,85%酒精、10 min,75%酒精、10 min,蒸餾水。②修復(fù),切片稍微甩干后用組化筆在組織周圍畫圈,在圈內(nèi)滴加蛋白酶K工作液覆蓋組織,37 ℃溫箱孵育25 min,稍后用PBS(pH7.4)清洗3次,每次5 min。③破膜,將切片稍微甩干后在圈內(nèi)加破膜工作液覆蓋組織,常溫下孵育20 min,稍后用PBS(pH7.4)清洗3次,每次5 min。④加試劑1、2,取Tunel試劑盒內(nèi)適量試劑1(TdT)和試劑2(dUTP)按1∶9混合,加到圈內(nèi)覆蓋組織,置于濕盒內(nèi)37 ℃溫箱孵育2 h。⑤DAPI復(fù)染細(xì)胞核,切片用PBS(pH7.4)洗滌3次,每次5 min。稍甩干后在圈內(nèi)滴加DAPI染液,避光室溫孵育10 min。最后封片觀察。有熒光表達(dá)的為凋亡細(xì)胞。
1.6 大鼠小腸組織IL-1β、TNF-α、IL-1Ra、IL-10檢測 取小腸組織勻漿液,以3 000 r/min的速度離心10 min,取上清液,利用ELISA檢測試劑盒檢測。具體步驟:①ELISA試劑盒實(shí)驗(yàn)前在室溫下平衡20 min后再從鋁箔袋中取出所需板條。②設(shè)置標(biāo)準(zhǔn)品孔和樣本孔,標(biāo)準(zhǔn)品孔各加不同濃度的標(biāo)準(zhǔn)品50 μL。③樣本孔中加入待測樣本50 μL,空白孔不加。④除空白孔外,標(biāo)準(zhǔn)品孔和樣本孔中每孔加入辣根過氧化物酶(HRP)標(biāo)記的檢測抗體100 μL,用封板膜封住反應(yīng)孔,37 ℃水浴鍋或恒溫箱溫育60 min。⑤棄去液體,吸水紙上拍干,每孔加滿洗滌液(350 μL),靜置1 min,甩去洗滌液,吸水紙上拍干,如此重復(fù)洗板5次(也可用洗板機(jī)洗板)。⑥每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。⑦每孔加入終止液50 μL,15 min內(nèi)在450 nm波長處測定各孔的OD值。為了保證實(shí)驗(yàn)結(jié)果的準(zhǔn)確性,每種炎癥因子均檢測3次,最后取平均值作為最終結(jié)果。
1.7 大鼠小腸組織TLR4、NF-κB P65陽性細(xì)胞數(shù)及蛋白檢測
1.7.1 TLR4、NF-κB P65陽性細(xì)胞數(shù) 采用免疫熒光染色法。具體步驟:①石蠟切片脫蠟,依次將切片放入二甲苯Ⅰ、15 min,二甲苯Ⅱ、15 min,無水乙醇Ⅰ、5 min,無水乙醇Ⅱ、5 min,85%酒精、5 min,75%酒精、5 min,蒸餾水。②抗原修復(fù),將石蠟切片脫水后于EDTA抗原修復(fù)緩沖液(pH8.0)中在微波爐中進(jìn)行抗原修復(fù),中火8 min,停火8 min,轉(zhuǎn)中低火7 min。修復(fù)過程中防止干片,自然冷切后置于PBS(pH7.4)中洗滌3次,每次5 min。③用組化筆在組織周圍畫圈,用BSA封閉30 min。④加一抗,一抗TLR4(1∶200),P-P65(1∶100)。輕輕甩掉封閉液,加一抗后置于濕盒內(nèi)4 ℃孵育過夜。⑤加二抗,熒光二抗CY3山羊抗兔(1∶300)。PBS洗滌3次,每次5 min。加二抗后避光室溫孵育50 min。⑥D(zhuǎn)API復(fù)染細(xì)胞核,再用PBS洗滌3次,每次5 min,加DAPI染液,避光室溫孵育10 min。最后封片觀察。
1.7.2 TLR4、NF-κB P65蛋白 采用Western blotting法,具體步驟參照“1.4.2”方法。

2 結(jié)果
2.1 各組血清DAO、I-FABP水平及組織PCNA蛋白表達(dá)量比較 血清DAO、I-FABP水平及組織PCNA蛋白表達(dá)量比較見表1。
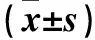
表1 各組血清DAO、I-FABP水平及組織PCNA蛋白表達(dá)量比較
注:與對照組比較,▲P<0.05;與模型組比較,★P<0.05。
2.2 各組小腸組織黏膜腺窩深度、絨毛高度比較 小腸組織黏膜腺窩深度、絨毛高度比較見表2。
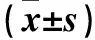
表2 各組小腸組織黏膜腺窩深度、絨毛高度比較
注:與對照組比較,▲P<0.05;與模型組比較,★P<0.05。
2.3 各組小腸組織上皮細(xì)胞凋亡數(shù)比較 干預(yù)組、模型組、對照組小腸上皮細(xì)胞凋亡數(shù)分別為(10.5±1.1)、(118.4±5.0)、(50.38±3.2)個(gè)/104μm2,模型組與對照組比較,干預(yù)組與模型組比較,P均<0.05。
2.4 各組小腸組織IL-1β、TNF-α、IL-1Ra、IL-10表達(dá)量比較 組織IL-1β、TNF-α、IL-1Ra、IL-10表達(dá)量比較見表3。
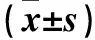
表3 各組小腸組織IL-1β、TNF-α、IL-1Ra、IL-10表達(dá)量比較
注:與對照組比較,▲P<0.05;與模型組比較,★P<0.05。
2.5 各組小腸組織TLR4、NF-κB P65陽性細(xì)胞數(shù)及蛋白表達(dá)量比較 組織TLR4、NF-κB P65陽性細(xì)胞數(shù)及蛋白表達(dá)量比較見表4。
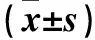
表4 各組小腸組織TLR4、NF-κB P65陽性細(xì)胞數(shù)及蛋白表達(dá)量比較
注:與對照組比較,▲P<0.05;與模型組比較,★P<0.05。
3 討論
OJ發(fā)生時(shí),腸黏膜屏障功能障礙是胃腸道主要的病理改變。這是由于腸道膽汁缺乏、腸道菌群失衡、氧化應(yīng)激、腸黏膜萎縮、腸上皮細(xì)胞間的緊密連接被破壞所致[1,10]。其次,OJ會(huì)導(dǎo)致胃腸道平滑肌張力降低,蠕動(dòng)減弱,消化腺萎縮分泌減少,出現(xiàn)腹脹、便秘、消化吸收不良的癥狀。所以,保護(hù)OJ腸功能對臨床治療很有意義。對OJ腸功能的保護(hù)還處于研究階段,臨床上還沒有特異性的保護(hù)OJ腸功能的藥物。劉俊等[11]發(fā)現(xiàn),前列腺素E1對OJ腸黏膜屏障有保護(hù)作用,可減少內(nèi)毒素血癥的發(fā)生,對改善預(yù)后有一定得作用。重組人生長激素可影響OJ腸黏膜IL-18表達(dá)從而改善腸黏膜屏障功能[12]。黃芩苷能抑制OJ大鼠腸道炎性反應(yīng),減輕腸黏膜損傷,保護(hù)腸黏膜屏障的功能[13]。在臨床上,采用蛋白質(zhì)型制劑的腸內(nèi)營養(yǎng)(EN)可保護(hù)患者腸黏膜屏障功能,促進(jìn)胃腸肝臟功能恢復(fù),改善機(jī)體免疫功能有積極作用,可顯著減少并發(fā)癥,降低病死率[14]。
黃芪含有黃芪皂苷、多糖、蛋白質(zhì)、黃酮等有效成分,多糖是黃芪的水溶性主要成分之一[4]。APS由阿拉伯糖、木糖、甘露糖、鼠李糖、半乳糖和葡萄糖組成,具有抗氧化、免疫調(diào)節(jié)、抗腫瘤、抗炎等多種生理功能[5~9]。文獻(xiàn)[15]報(bào)道,APS可抑制胃癌MGC-803細(xì)胞、人非小細(xì)胞肺癌A549細(xì)胞、人肝癌HepG2細(xì)胞。在胃癌治療上,放療結(jié)合APS治療可明顯減小腫瘤體積[16]。APS治療哮喘可降低痰液細(xì)胞炎癥水平、恢復(fù)肺功能,還能通過調(diào)節(jié)患者免疫功能、減少炎癥反應(yīng)、改善老年患者早期糖尿病腎病的腎功能[17,18]。OJ隨病程進(jìn)展可出現(xiàn)明顯損傷腸道,小腸上段的病理改變可發(fā)現(xiàn)OJ腸黏膜絨毛稀疏、高度減低伴有明顯的水腫且排列紊亂,上皮細(xì)胞部分壞死脫落,可見炎性細(xì)胞浸潤。其次,OJ可導(dǎo)致腸黏膜屏障受損,而血清DAO及I-FABP兩個(gè)指標(biāo)可反應(yīng)腸黏膜屏障功能。OJ 14 d后血清這兩項(xiàng)指標(biāo)要明顯高于對照組。除此之外,OJ影響小腸上皮細(xì)胞再生、促進(jìn)凋亡。PCNA與細(xì)胞DNA合成密切相關(guān),在細(xì)胞增殖中發(fā)揮重要作用,是細(xì)胞增殖的指標(biāo),OJ可以使小腸組織PCNA蛋白表達(dá)下降,凋亡增多。
APS干預(yù)后可明顯抑制OJ腸組織促炎因子TNF-α、IL-1β的表達(dá),上調(diào)促進(jìn)抗炎因子IL-10、IL-Rα的表達(dá)。TNF-α和其他炎性細(xì)胞因子共同作用可引起嚴(yán)重的腸損傷。IL-1β的過表達(dá)參與機(jī)體急性和慢性炎癥反應(yīng),并且是促進(jìn)其他促炎因子分泌的關(guān)鍵因子[19]。為了進(jìn)一步探究維持這種炎性平衡的可能機(jī)制,我們發(fā)現(xiàn)腸組織TLR4蛋白表達(dá)增高,TLR4介導(dǎo)炎癥反應(yīng)具有重要意義。有研究表明,APS可激活TLR依賴的MyD88信號(hào)通路來調(diào)節(jié)機(jī)體的免疫功能[9],還可通過抑制促凋亡和調(diào)節(jié)PI3K/AKT/mTOR信號(hào)通路來減輕IL-1β刺激成纖維滑膜細(xì)胞的促炎作用[20]。Vieira等[21]利用腸上皮細(xì)胞培養(yǎng)模型加入TNF-α細(xì)胞因子可顯著增加一氧化氮、單核細(xì)胞化學(xué)引誘物蛋白1、血管內(nèi)皮生長因子、IL-8、細(xì)胞間黏附分子1和活性氧的含量。TNF-α和其他炎性細(xì)胞因子共同作用可引起嚴(yán)重的腸損傷。IL-1β的過表達(dá)參與機(jī)體急性和慢性炎癥反應(yīng),并且是促進(jìn)其他促炎因子分泌的關(guān)鍵因子[22]。Sablet等[23]發(fā)現(xiàn),TNF-α和IL-1β在通過促進(jìn)Ly6c+炎性細(xì)胞增殖和浸潤導(dǎo)致腸道屏障功能損中起關(guān)鍵作用。IL-1Ra具有廣譜抗炎作用。抗炎因子IL-1Ra可通過抑制P53依賴的凋亡,保護(hù)腸隱窩上皮細(xì)胞,減輕腸黏膜炎癥反應(yīng)[24]。本研究在APS干預(yù)后,大鼠小腸組織促炎因子TNF-α、IL-1β水平明顯降低,小腸組織的抗炎因子IL-10、IL-Rα水平顯著升高,可保護(hù)OJ腸功能。
總之,APS可通過TLR4/NF-κB P65通路調(diào)節(jié)小腸促炎與抗炎因子的平衡、減輕OJ大鼠小腸炎癥反應(yīng)、減少細(xì)胞凋亡、維持腸道細(xì)胞增殖活性、降低腸道通透性、保護(hù)腸道功能。

