基于高通量測序技術(shù)的釀酒葡萄產(chǎn)區(qū)土壤微生物多樣性
王 偉 ,布麗根·加冷別克,胡曉東,夏俊芳,張志東,顧美英 ,武 運
(1.新疆農(nóng)業(yè)大學食品科學與藥學學院,烏魯木齊 830052; 2.新疆農(nóng)業(yè)科學院微生物應用研究所,烏魯木齊 830091)
0 引 言
【研究意義】葡萄種植業(yè)是重要的果園生態(tài)系統(tǒng)之一,其土壤中蘊含著豐富的微生物,近年來,有學者開展了葡萄園土壤微生物的研究[1]。在自然發(fā)酵過程中,葡萄酒中的微生物主要來源于釀酒葡萄、葡萄園土壤、釀造設備等,這些微生物會隨著葡萄果粒和釀造工序進入發(fā)酵罐參與發(fā)酵過程,對葡萄酒的品質(zhì)產(chǎn)生一定影響[2]。【前人研究進展】目前,國外科研人員對其葡萄酒產(chǎn)地的土壤微生物菌群多樣性進行了廣泛的研究,例如Renouf等[3]研究發(fā)現(xiàn),土壤中的優(yōu)勢真菌菌屬為Saccharomyces、Sordaria、Tetracladium和Geomyces;Hirano等[4]、Park等[5]研究發(fā)現(xiàn),土壤中的優(yōu)勢細菌菌屬為Kaistobacter、Arthrobacter、Skermanella和Sphingomonas。中國釀酒葡萄栽培區(qū)域廣闊,釀酒葡萄適栽區(qū)的生態(tài)地理條件復雜多樣,蘊藏著豐富的釀酒微生物資源[6-7]。【本研究切入點】鮮有關(guān)于釀酒葡萄園土壤微生物群落多樣性與土壤環(huán)境關(guān)系的研究。自然環(huán)境中僅有1%左右甚至更少的微生物具有可培養(yǎng)性[8],利用傳統(tǒng)技術(shù)對土壤微生物進行研究已不能滿足微生物資源的開發(fā)和利用[9]。Illumina Miseq高通量測序是目前應用最廣泛的高通量測序技術(shù),具有準確度高和通量大的特點,已被大量應用于微生物群落多樣性研究[10-11]。【擬解決的關(guān)鍵問題】采用Illumina MiSeq高通量測序技術(shù)結(jié)合生物信息學分析,研究中國新疆吐哈盆地、伊犁河谷、焉耆盆地、天山北麓4大釀酒葡萄產(chǎn)區(qū)土壤微生物群落結(jié)構(gòu)及多樣性,為新疆釀酒葡萄主產(chǎn)區(qū)微生物菌庫的構(gòu)建提供理論依據(jù)。
1 材料與方法
1.1 材 料
1.1.1 土壤樣品
土壤樣品分別采自釀酒葡萄產(chǎn)區(qū)中8年樹齡赤霞珠葡萄園土壤,每種樣品采集3份。新疆吐哈盆地為1號樣(E89.194908°,N42.950894°)、伊犁河谷為2號樣(E82.217131°,N43.490168°)、焉耆盆地為3號樣(E87.107208°,N42.271358°)、天山北麓為4號樣(E86.057281°,N44.056999°)
V3基因測序試劑盒,美國Illumina公司;TopTaqDNA Polymerase試劑盒,北京全式金生物技術(shù)有限公司;AgencourtAMPureXP核酸純化磁珠,美國Beckman Coulter公司。
1.1.2 儀器與設備
Illumina Misq測序平臺,美國Illumina公司;5810R離心機,德國Eppendorf公司;ABI 2720 PCR儀、Nanodrop 2000微量紫外分光光度計及Qubit3.0熒光定量儀,美國Thermo Fisher Scientific公司;Agilent 2100生物分析儀,美國Agilent Technologies公司;Optima 2100 ICP-AES分析儀,美國PE公司。
1.3 方 法
1.3.1 樣品制備
采用五點取樣法采集土樣,去除葡萄園地表的植物等殘體,用滅菌土鏟垂直切開土壤,在10~20 cm深度處取樣,每個取樣點取樣約0.5 kg,保存于滅菌的密封袋,置于冰袋中冷藏迅速帶回實驗室,土樣在-80℃下保存?zhèn)溆谩?/p>
1.3.2 土壤理化性質(zhì)的測定
不同葡萄園土壤樣品進行以下理化性質(zhì)分析:pH值、有機質(zhì)(SOM)含量、全氮(N)含量、速效氮(N)含量、全磷(P)含量、速效磷(P)含量、Fe含量及Mn含量。土壤pH值采用pH計法測定;土壤有機質(zhì)測定采用重鉻酸鉀外加熱法[12];土壤全氮測定采用凱氏定氮法[13];土壤速效氮測定采用堿解擴散法[14];土壤全磷測定采用鉬藍比色法[15];土壤速效磷測定采用碳酸氫鈉浸提-鉬銻抗比色法[14];土壤Fe及Mn元素含量測定采用ICP-AES法[16]。
1.3.3 土壤樣品總DNA的提取及PCR擴增[17-18]
土壤中微生物原基因組總DNA的提取采用TopTaqDNA Polymerase試劑盒(Transgen)進行。
采用細菌16S rDNA V3-V4擴增通用引物和真菌ITS1區(qū)進行PCR擴增,細菌引物為341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5’-GACTACHVGGTATCTAATCC-3');真菌引物為ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3');ITS2(5'-GCTGCGTTCTTCATCGATG-3')。PCR反應擴增體系(20 μL):5×PCR BufferⅡ 4 μL,2.5 mmol/L dNTPs 2 μL,0.4 μmol/L正、反向引物各0.8 μL,TransStart FastPfu DNA Polymerase 0.4 μL,DNA模板2 μL,ddH2O補充至20 μL。PCR擴增程序:94℃預變性2 min;94℃變性20 s,55℃退火30 s,72℃延伸60 s,反應25個循環(huán);72℃延伸10 min。瓊脂糖凝膠電泳檢測擴增產(chǎn)物是否單一和特異,將同一個樣本的3個平行擴增產(chǎn)物混合,每個樣本加入等體積的AgencourtAMpureXP核酸純化磁珠對產(chǎn)物進行純化。
1.3.4 高通量測序
混樣后的文庫通過Agilent 2100 Bioanalyzer檢測測序文庫插入片段的大小,確認在120~200 bp無非特異性擴增,并準確定量測序文庫濃度。采用Illumina MiSeq高通量測序平臺,2×250 bp的雙端測序策略對文庫進行測序。為了得到高質(zhì)量的測序數(shù)據(jù),需要對原始下機數(shù)據(jù)進行質(zhì)控和過濾,主要步驟如下:
(1)使用TrimGalore軟件去除序列末端質(zhì)量低于20的堿基并去除可能包含的嵌合體序列,之后去除長度小于100 bp的短序列;(2)使用FLASH2軟件[19]將雙末端測序得到的成對序列進行拼接,得到拼接序列,進一步去除拼接后低質(zhì)量序列(超過90%的堿基質(zhì)量低于20);(3)使用mothur軟件[20]查找并去除序列中的引物;(4)使用usearch去除總堿基錯誤率大于2的序列以及長度小于100 bp的序列,得到質(zhì)量和可信度較高的優(yōu)化序列,該數(shù)據(jù)將用于后續(xù)生物信息分析。
OTU(Operational taxonomic unit)聚類分析通過在QIIME中調(diào)用Uclust[21]方法對優(yōu)質(zhì)序列按相似度0.97進行聚類,選取每個類最長的序列為代表序列。OTU注釋通過在QIIME中采用BLAST[22]的方法對序列數(shù)據(jù)庫進行比對,獲得每個OTU分類學信息。OTU維恩圖利用R軟件生成樣本間(或組間)OTU的維恩圖。根據(jù)OTU列表中的各樣品物種豐度情況,應用Mothur軟件計算常用的生物多樣性指數(shù)。將優(yōu)勢菌門與土壤理化因子結(jié)合制成RDA圖。
2 結(jié)果與分析
2.1 土壤理化性質(zhì)
植物、土壤和微生物三者相互影響,共同組成一個復雜的土壤生態(tài)系統(tǒng)[23]。微生物是土壤中最具活力的部分,其群落結(jié)構(gòu)與功能特征與植物的定居、營養(yǎng)和生長等關(guān)系極為密切[24]。焉耆盆地的土壤樣品pH值最大(P< 0.05),pH值為8.36,而且該樣品的有機質(zhì)、Fe、Mn的含量也是最高的(P< 0.05),分別為0.96%、4.50 mg/kg及4.81 mg/kg;伊犁河谷的全N含量、速效N含量、全P含量及速效P含量最高(P< 0.05),分別為0.068%、82.18 mg/kg、0.094%及24.81 mg/kg。表1
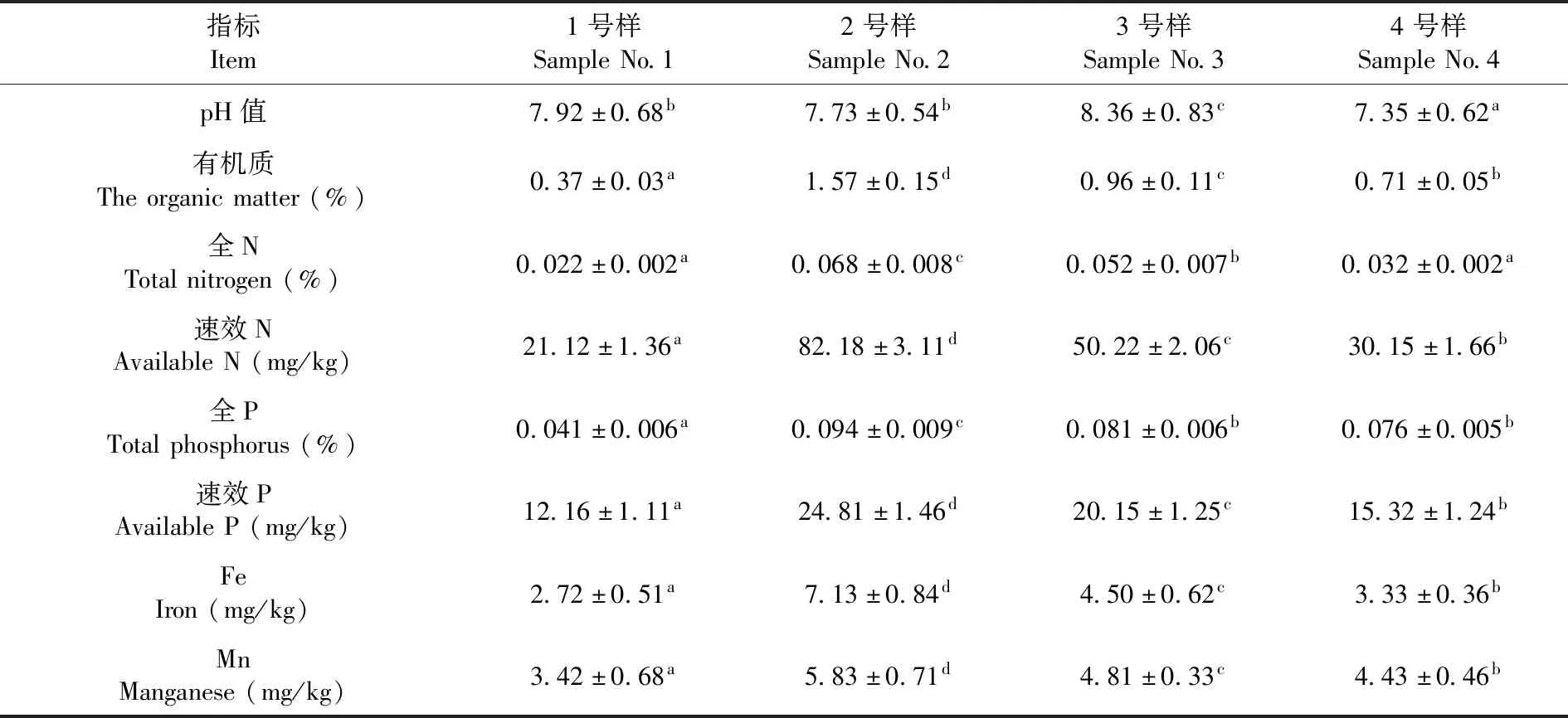
表1 土壤樣品的基本理化性質(zhì)Table 1 Main physical and chemical properties of soil samples
注:同行中的不同小寫字母代表差異顯著(Duncan test,P< 0.05),下同
Note:Mean values in the same line with different letters were significantly different (Duncan test,P< 0.05),the same as below
2.2 微生物多樣性
Shannon與Simpson多樣性指數(shù)為常用的反映微生物alpha多樣性的指數(shù)之一。Shannon值越大,群落多樣性越高;Simpson指數(shù)值越大,群落多樣性越低;Coverage指各樣本文庫的覆蓋率,其數(shù)值越高,則樣本中序列被測出的概率越高,而沒有被測出的概率越低[25]。伊犁河谷土壤中細菌的Shannon指數(shù)最大(P< 0.05),Simpson指數(shù)最小(P< 0.05);天山北麓土壤中細菌的Shannon指數(shù)最小(P< 0.05),Simpson指數(shù)最大(P< 0.05),且各樣品的覆蓋率都大于96%。焉耆盆地土壤中真菌的Shannon指數(shù)最大(P< 0.05),Simpson指數(shù)最小(P< 0.05);吐哈盆地土壤中真菌的Shannon指數(shù)最小(P< 0.05),Simpson指數(shù)最大(P< 0.05),且各樣品的覆蓋率都大于99%。伊犁河谷土壤中細菌的群落多樣性最高,天山北麓土壤中細菌群落多樣性最低;吐哈盆地中真菌群落多樣性最低,焉耆盆地中真菌的群落多樣性最高,且各樣品的微生物物種信息得到了充分的體現(xiàn)。表2
2.3 樣品中所含OTU數(shù)目
研究表明,Group1組中細菌共得到3 096個OTU,Group2組中細菌共得到3 214個OTU,Group3組中細菌共得到2 995個OTU,Group4組中細菌共得到2 283個OTU。分別將這4組兩兩比較發(fā)現(xiàn):Group1與Group2共有細菌的OTU為2 173個,Group1與Group3共有細菌的OTU為2 182個,Group1與Group4共有細菌的OTU為1 723個,Group2與Group3共有細菌的OTU為2 228個,Group2與Group4共有細菌的OTU為1 674個,Group3與Group4共有細菌的OTU為1 813個。Group1中特有細菌的OTU為413個,Group2中特有細菌的OTU為498個,Group3中特有細菌的OTU為227個,Group4中特有細菌的OTU為154個。圖1
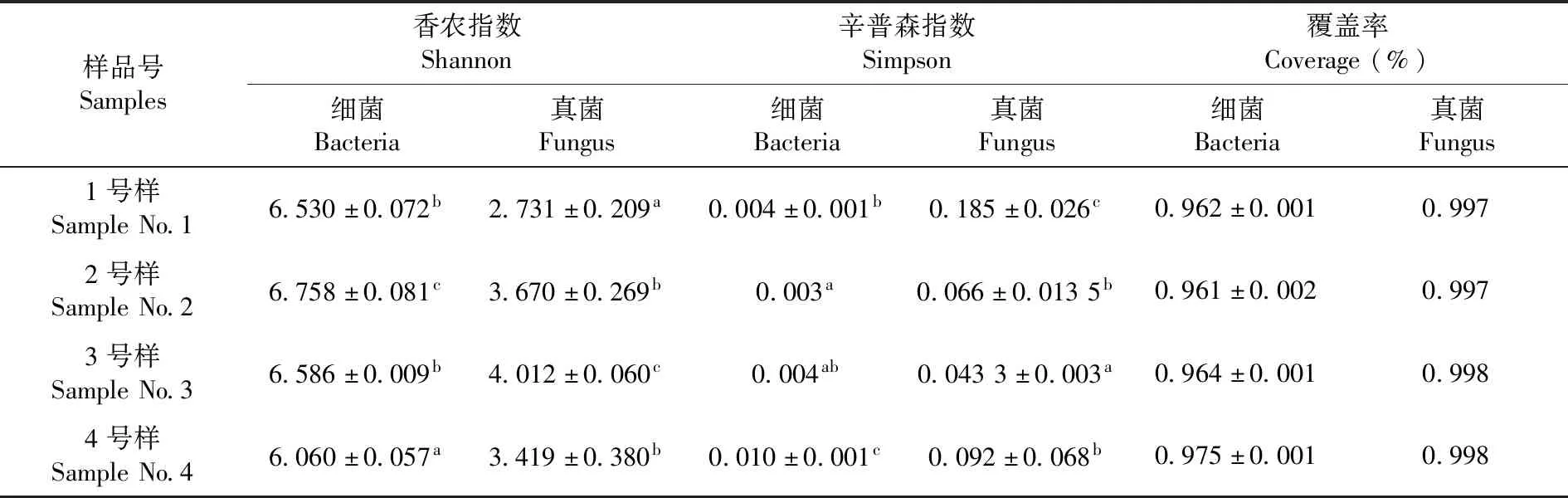
表2 樣品中微生物多樣性指數(shù)Table 2 Analysis of microbial diversity index in the samples
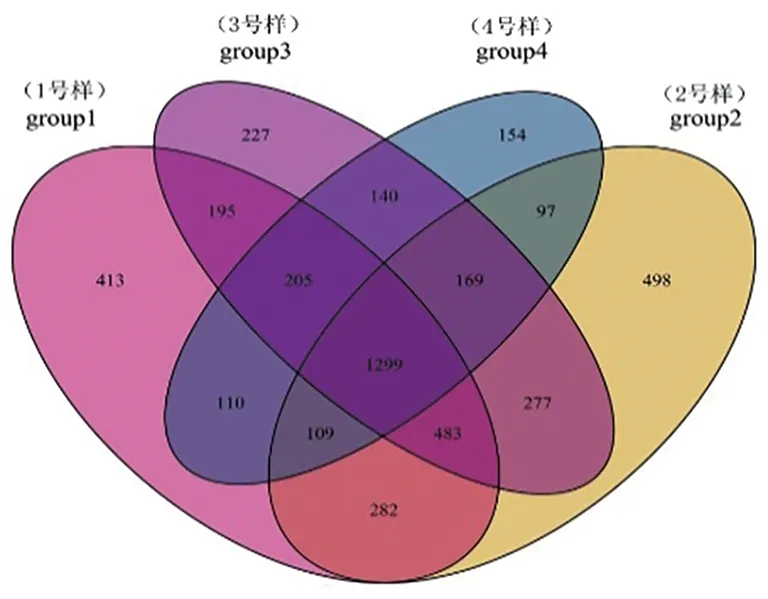
圖1 細菌群落維恩圖
Fig.1 Venn diagram of bacterial communities
研究表明,不同土壤樣品所含細菌類群的OTU數(shù)Group2 > Group1 > Group3 > Group4,伊犁河谷土壤中細菌的類群最豐富,天山北麓土壤中的細菌類群最少。Group2伊犁河谷土壤與Group3焉耆盆地土壤中細菌類群的一致性最高,差異最小;Group2伊犁河谷土壤與Group4天山北麓土壤中細菌類群的一致性較低,差異明顯。這4種土壤類型有部分一致的細菌類群,但從整體來看差異還是比較明顯。圖1
Group1組中真菌共得到665個OTU,Group2組中真菌共得到799個OTU,Group3組中真菌共得到831個OTU,Group4組中真菌共得到649個OTU。分別將這4組兩兩比較發(fā)現(xiàn),Group1與Group2共有真菌的OTU為244個,Group1與Group3共有真菌的OTU為255個,Group1與Group4共有真菌的OTU為234個,Group2與Group3共有真菌的OTU為297個,Group2與Group4共有真菌的OTU為312個,Group3與Group4共有真菌的OTU為266個。Group1中特有真菌的OTU為285個,Group2中特有真菌的OTU為318個,Group3中特有真菌的OTU為380個,Group4中特有真菌的OTU為211個。圖2
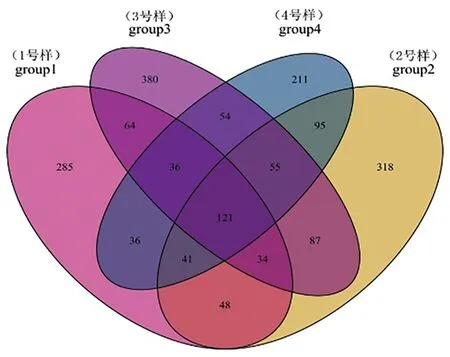
圖2 真菌群落維恩圖
Fig.2 Venn diagram of fungi communities
研究表明,不同土壤樣品所含真菌類群的OTU數(shù)Group3 > Group2 > Group1 > Group4,表明焉耆盆地土壤中真菌的類群最豐富,天山北麓土壤中的真菌類群最少。Group2伊犁河谷土壤與Group4天山北麓土壤中真菌類群的一致性最高,差異最小;Group1吐哈盆地土壤與Group4天山北麓土壤中真菌類群的一致性較低,差異明顯。這4種土壤類型有部分一致的真菌類群,但從整體來看差異還是比較明顯。圖2
2.4 微生物群落組成
研究表明,在12份土壤樣品中未確定類群的細菌所占比例較大,其余按豐度大小排序為:節(jié)桿菌屬(Arthrobacter)、芽單胞菌屬(Gemmatimonas)、糞腸球菌屬(Ohtaekwangia)、鹽水微菌屬(Salinimicrobium)、芽孢桿菌屬(Bacillus)、Saccharibacteria_genera_incertae_sedis屬、鏈霉菌屬(Streptomyces)、鞘氨醇單胞菌屬(Sphingomonas)、胸腺桿菌屬(Steroidobacter)、類諾卡氏屬(Nocardioides)、抗銻斯科曼氏球菌屬(Skermanella)、Chryseolinea屬、Subdivision3_genera_incertae_sedis屬、Litorilinea屬、硝化螺菌屬(Nitrospira)、Aridibacter屬、WPS-1_genera_incertae_sedis屬、考克氏菌屬(Kocuria)、大理石雕菌屬(Marmoricola)、小梨形菌屬(Pirellula)、Adhaeribacter屬、地桿菌屬(Pedobacter)及黃桿菌屬(Flavobacterium);其中,吐哈盆地、焉耆盆地及天山北麓葡萄園土壤中節(jié)桿菌屬細菌為優(yōu)勢菌屬,而伊犁河谷葡萄園土壤中芽單胞菌屬細菌為優(yōu)勢菌屬。該研究結(jié)果不同于Hirano等[4]、Park等[5]的發(fā)現(xiàn),在新疆釀酒葡萄產(chǎn)區(qū)土樣中未檢測到Kaistobacter。李翠霞等[26]發(fā)現(xiàn),Oenococcus是葡萄酒蘋果酸-乳酸發(fā)酵階段(malate fermentation,MLF)的優(yōu)勢菌屬,并大量存在于葡萄酒中,研究表明葡萄酒中的Oenococcus并非來自于葡萄園土壤,而由其他途徑進入發(fā)酵罐參與發(fā)酵過程。此外,樣品中檢測到的Bacillus,在葡萄酒發(fā)生MLF后可以有效的降低其酸度,避免葡萄酒在裝瓶、貯存期間發(fā)生2次發(fā)酵,增加葡萄酒的微生物學穩(wěn)定性[27]。圖3
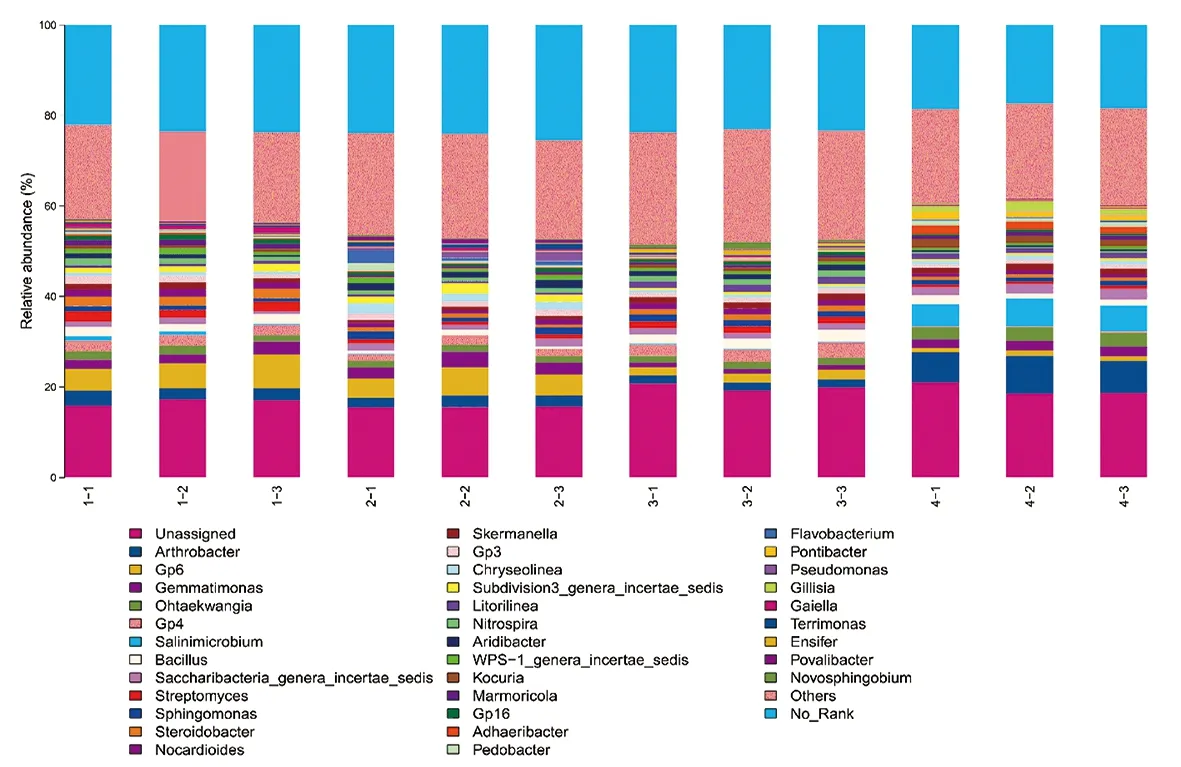
圖3 細菌群落屬水平相對豐度
Fig.3 Relative abundance of bacterial communities at genus level
研究表明,在12份土壤樣品中未確定類群的真菌所占比例較大,其余按豐度大小排序為:耐冷酵母屬(Guehomyces)、赤霉菌屬(Gibberella)、剛毛四枝孢屬(Tetracladium)、假裸囊菌屬(Pseudogymnoascus)、被孢霉屬(Mortierella)、鐮刀菌屬(Fusarium)、枝孢菌屬(Cladosporium)、鏈格孢屬(Alternaria)、隱球酵母屬(Cryptococcus)、螺旋聚孢霉(Clonostachys)、單格孢屬(Ulocladium)、綠僵菌屬(Metarhizium)、Naganishia屬、Mycoarthris屬、叢赤殼屬(Nectria)、支頂孢屬(Acremonium)、球腔菌屬(Mycosphaerella)、葡萄穗霉屬(Stachybotrys)、金孢子菌屬(Chrysosporium)、光黑殼屬(Preussia)、青霉菌屬(Penicillium)、曲霉屬(Aspergillus)及Cystofilobasidium屬;其中,吐哈盆地及天山北麓葡萄園土壤中耐冷酵母屬真菌為優(yōu)勢菌屬,伊犁河谷葡萄園土壤中剛毛四枝孢屬真菌為優(yōu)勢菌屬,焉耆盆地葡萄園土壤中赤霉菌屬真菌為優(yōu)勢菌屬。需要注意的是,Han等[28]研究發(fā)現(xiàn),葡萄樹白粉病對葡萄傷害非常大,使葡萄幼果易開裂腐敗,該病由Erysisphe引發(fā),而研究表明,新疆不同釀酒葡萄產(chǎn)區(qū)土樣中均未檢測到Erysisphe;Ferrari等研究[29]指出,赭曲霉素可以致人死亡,它主要由Aspergillus產(chǎn)生,但它存在于葡萄酒中的可能性風險卻不高;Lachenmeier等[30]指出,霉菌是一種絲狀真菌,能夠侵染葡萄的莖、葉、花、果實等,造成果實減產(chǎn),影響果實品質(zhì),它在儲酒橡木桶內(nèi)外、葡萄酒瓶木塞處很容易生長繁殖,產(chǎn)生令人不愉快的霉味。圖4

圖4 真菌群落屬水平相對豐度
Fig.4 Relative abundance of fungi communities at genus level
2.5 微生物群落與環(huán)境因子RDA
冗余分析(RDA,redundancy analysis)是目前2種常用的約束性排序方法[31],用來解釋環(huán)境因子對于樣本中微生物群落組成的影響。箭頭射線代表不同的環(huán)境因子,射線越長表示該環(huán)境因子影響越大;樣本/菌群-虛線中心連線與箭頭之間的夾角代表了樣本/菌群與環(huán)境因子之間的相關(guān)關(guān)系(夾角為銳角時表示呈正相關(guān)關(guān)系,鈍角時呈負相關(guān)關(guān)系,直角表示不相關(guān))。軸一(橫軸)和軸二(縱軸)的解釋量分別為35.38%和25.42%。環(huán)境因子中土壤樣品pH值對細菌群落屬水平組成影響較大,P元素含量對細菌群落屬水平組成影響最小;Gp6、Gp4、Bacillus、Streptomyces、Sphingomonas、Steroidobacter、Nocardioides、Skermanella及Gp3屬細菌與土壤樣品的pH值呈正相關(guān),而Arthrobacter、Gemmatimonas、Ohtaekwangia、Salinimicrobium、Saccharibacteria_genera_incertae_sedis及Chryseolinea屬細菌與土壤樣品pH值呈負相關(guān)。圖5
研究表明,軸一(橫軸)和軸二(縱軸)的解釋量分別為28.69%和25.61%。環(huán)境因子中Mn元素含量對真菌群落屬水平組成影響最大,P元素含量對真菌群落屬水平組成影響最小;Gibberella、Tetracladium、Mortierella、Cladosporium、Alternaria及Clonostachys屬真菌與土壤樣品的Mn元素含量呈正相關(guān),而Guehomyces、Pseudogymnoascus、Fusarium、Cryptococcus、Ulocladium、Metarhizium及Naganishia屬真菌與土壤樣品的Mn元素含量呈負相關(guān)。圖6
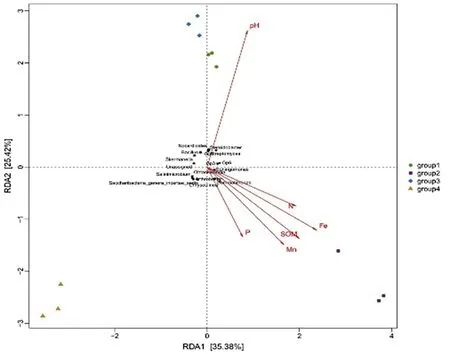
圖5 細菌群落與環(huán)境因子的冗余
Fig.5 Redundancy analysis biplot between the bacterial communities and environment factor
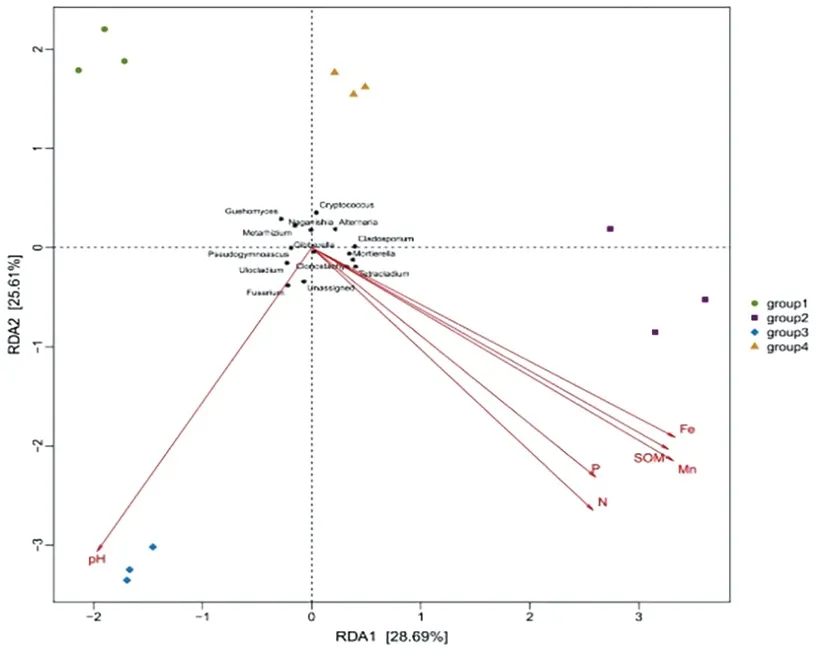
圖6 真菌群落與環(huán)境因子的冗余
Fig.6 Redundancy analysis biplot between the fungi communities and environment factor
3 討 論
3.1 新疆釀酒葡萄主產(chǎn)區(qū)土壤微生物多樣性
土壤是一個天然的微生物資源庫[32],幾乎可以提供微生物生長所需要的所有營養(yǎng)[33]。對于果園生態(tài)系統(tǒng)來說,果園土壤本身的理化性質(zhì)及果園果樹自身的種類、覆草、施肥、農(nóng)藥等措施均會對其土壤微生物的群落結(jié)構(gòu)和功能產(chǎn)生影響[34-35]。陳大勛等[36]對龍眼、香蕉、枇杷等果園土壤微生物多樣性進行研究,發(fā)現(xiàn)不同果園土壤微生物總數(shù)量差異較大。張翔等[37]研究發(fā)現(xiàn)生物有機肥可提高果園土壤微生物的豐富度和多樣性。Baddam等[38]的研究結(jié)果表明,細菌是土壤樣品中的優(yōu)勢菌,真菌相對較少,研究結(jié)果也是如此。魏玉潔等[39]研究發(fā)現(xiàn),新疆天山北麓葡萄園土壤中主要的細菌有放線菌、擬桿菌、泉古菌、厚壁菌、硝化螺旋菌、浮霉菌、變形菌及疣微菌8個菌門,且Kaistobacter屬、節(jié)細菌屬及Skermanella屬細菌大量存在于土壤樣品中;研究還檢測到了酸桿菌門、綠彎菌門Chloroflexi、芽單胞菌門、異常球菌-棲熱菌門及Candidatus_Saccharibacteria門細菌,但沒有檢測到泉古菌門細菌,且節(jié)桿菌屬、芽單胞菌屬及糞腸球菌屬細菌大量存在于新疆4個主要釀酒葡萄產(chǎn)區(qū)土壤樣品中。
魏玉潔等[39]研究還發(fā)現(xiàn),新疆天山北麓葡萄園土壤主要的真菌微生物(門水平)為子囊菌門、擔子菌門、壺菌門、Un-s-fungal sp CC 06_28門及Zygomycota 5個菌門,且酵母屬、糞殼菌屬和Tetracladium屬真菌大量存在于樣品中;研究還檢測到了Glomeromycota門、Cercozoa門、Rozellomycota門真菌,且耐冷酵母屬、赤霉菌屬及剛毛四枝孢屬真菌大量存在于新疆4個主要釀酒葡萄產(chǎn)區(qū)土壤樣品中。上述研究結(jié)果表明,新疆不同釀酒葡萄產(chǎn)區(qū)因為氣候、土壤肥力等因素有較大差異,從而影響土壤微生物群落的組成與分布,與Tan等[40]及Cordero-Bueso等[41]的研究結(jié)果一致。
3.2 新疆釀酒葡萄主產(chǎn)區(qū)環(huán)境因子對微生物群落多樣性的影響
研究表明,影響土壤微生物群落結(jié)構(gòu)組成和多樣性的因素有自然因素和人為因素[42]。牛世全等[43]通過高通量測序技術(shù)研究河西走廊地區(qū)鹽堿土壤中微生物多樣性后發(fā)現(xiàn),環(huán)境因子中土壤pH對微生物群落組成的影響最顯著,這與研究結(jié)果一致。研究的RDA分析表明,環(huán)境因子中土壤樣品pH值對細菌群落組成影響最顯著,P元素含量對細菌群落組成的影響最小;另一方面,Mn元素含量對真菌群落組成影響最顯著,P元素含量對真菌群落組成的影響最小。在通常情況下,土壤中普遍存在適應該環(huán)境特有的微生物群落[44],但由于氣候、土壤肥力及發(fā)展農(nóng)業(yè)生產(chǎn)的同時,用水的管理、調(diào)節(jié)及配套的排灌工程等都會導致土壤微生物的群落組成發(fā)生變化,應用高通量測序技術(shù)就可以更為充分地反映出土壤微生物群落的多樣性和分布情況。
4 結(jié) 論
4.1 新疆伊犁河谷土壤中細菌的群落多樣性最高,新疆天山北麓土壤中細菌群落多樣性最低;新疆焉耆盆地中真菌的群落多樣性最高,新疆吐哈盆地中真菌群落多樣性最低。
4.2 節(jié)桿菌屬細菌和耐冷酵母屬真菌是吐哈盆地和天山北麓葡萄園土壤中的優(yōu)勢菌屬;芽單胞菌屬細菌和剛毛四枝孢屬真菌是伊犁河谷葡萄園土壤中的優(yōu)勢菌屬;節(jié)桿菌屬細菌和赤霉菌屬真菌是焉耆盆地葡萄園土壤中的優(yōu)勢菌屬。
4.3 土壤樣品理化指標中pH值對中國新疆吐哈盆地、伊犁河谷、焉耆盆地、天山北麓4個主要釀酒葡萄產(chǎn)區(qū)土壤微生物細菌群落組成影響最顯著,Mn元素含量對真菌群落組成影響最顯著,而P元素含量對微生物群落組成影響最小。

