鹿血晶增強巨噬細胞抗黑色素瘤作用及其機制研究①
潘宇晨 李京蔓 李 丹 竇 環 侯亞義 (南京大學醫學院,南京 210093)
惡性黑色素瘤是最嚴重的一種皮膚癌,難以根治。盡管免疫檢查點的發現推動了腫瘤免疫療法的進步,但腫瘤免疫療法仍有很多不足之處[1,2]。個體化的腫瘤疫苗提高了腫瘤的治療效果,并有效地防止其復發[3],但由于制備時間久、成本較高,其應用受到較大限制。因此,開發更有效更經濟的方法來輔助治療黑色素瘤是非常重要的。
巨噬細胞是固有免疫系統中被廣泛研究的具有異質性的細胞,是機體抵抗感染的重要組成部分。巨噬細胞通過分泌炎癥因子[如腫瘤壞死因子(TNF-α)]、產生氧化應激反應(如產生一氧化氮、活性氧等)能夠抑制腫瘤的生長、轉移,并通過吞噬作用消除惡性腫瘤細胞[4]。先前的實驗發現,活化巨噬細胞并促進其向促炎的M1型極化有利于黑色素瘤小鼠的治療[5]。
鹿血晶(deer blood crystal,DBC)由鹿血制得,富含多糖、氨基酸、微量元素等。近年來發現鹿血具有治療貧血、調節免疫、抗腫瘤、延緩衰老、改善記憶、抗疲勞、改善性功能等多種治療保健作用[6]。本文旨在研究鹿血晶對巨噬細胞殺傷黑色素瘤的影響及潛在的分子機制,為臨床中藥聯合腫瘤治療的應用提供參考。
1 材料與方法
1.1材料 鹿血晶凍干粉來自蘇州紅冠莊國藥股份有限公司(批號:S1810012);B16F10細胞株和Raw264.7細胞株購自中國科學院細胞庫;DMEM高糖培養基、胎牛血清、胰酶、雙抗均購自上海基峰生物科技有限公司;CCK8試劑盒購自日本同仁化學研究所;凋亡試劑盒、RNA反轉錄試劑盒購自南京諾唯贊生物科技有限公司;Trizol、qRT-PCR mix購自賽默飛世爾科技有限公司(Thermo Fisher Scientific);NO試劑盒購自碧云天生物技術有限公司;IL-1β、IL-6、TNF-α ELISA檢測試劑盒購自達科為生物技術有限公司;β-actin、p-S6、S6、p-4EBP、4EBP抗體購自CST公司(Cell Signaling Technology);兔二抗購自碧云天生物技術有限公司,流式抗體F4/80購自福麥斯生物技術有限公司。
1.2方法
1.2.1細胞培養 Raw264.7及B16F10細胞均種于90% DMEM+10% 胎牛血清的培養基中,5% CO2、37℃培養箱中培養。
1.2.2CCK8檢測 取100 μl 細胞懸液加至96孔板,培養過夜。細胞貼壁后加不同濃度的鹿血晶溶液或巨噬細胞培養上清培養,24 h后棄上清并用無菌PBS洗板3次,每孔加90% DMEM+10% CCK8溶液100 μl,培養箱中培養至顏色變橙,酶標儀測定450 nm處吸光值(A450)。細胞活力計算方式:細胞活力指數=[A450(加藥)-A450(空白)]/[A450(未加藥)-A450(空白)]。
1.2.3RNA提取與qRT-PCR 根據說明書使用Trizol法提取總RNA,按照反轉錄試劑盒說明書進行反轉錄。以β-actin為內參,各基因相對表達量由公式2-ΔΔCt計算得出。
1.2.4流式細胞術 B16F10-GFP與Raw264.7以2∶1比例鋪板,貼壁后加不同濃度鹿血晶處理24 h,胰酶消化并收集細胞,4℃,1 500 r/min離心5 min,棄上清,PBS洗2次,加F4/80抗體避光孵育15 min,加1 ml PBS清洗1遍,上機檢測。凋亡檢測按照試劑盒說明書進行操作。
1.2.5蛋白印跡實驗 收集細胞,加RIPA細胞裂解液,冰上裂解15~30 min,4℃,12 000 r/min離心10 min,取上清。BCA法檢測上清總含量,加相應體積5×蛋白上樣緩沖液,混勻后,99℃金屬浴10 min。蛋白保存至-80℃冰箱或冷卻至室溫上樣。等量蛋白樣品使用15%聚丙酰胺凝膠電泳分離,轉移至PVDF膜,5% BSA-TBST緩沖液室溫封閉1 h,一抗4℃搖床孵育過夜,二抗室溫孵育2 h,TBST洗膜3次,每次10 min。移至曝光儀中,加曝光液顯影并拍照。
1.2.6ELISA實驗 收集不同組細胞上清,按照ELISA試劑盒說明書步驟操作,酶標儀檢測各孔450 nm處吸光度值,利用標曲計算出NO和各炎癥因子的含量。
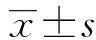
2 結果
2.1鹿血晶處理巨噬細胞后其上清降低黑色素瘤細胞活力 單加鹿血晶低(250 mg/ml)、中(500 mg/ml)、高(1 000 mg/ml)三個濃度均略微增強B16F10的細胞活力,不加鹿血晶的巨噬細胞培養上清對B16F10細胞活力影響不大,而加了鹿血晶之后巨噬細胞的培養上清能夠顯著抑制B16F10的細胞活力(P<0.05)(圖1)。
2.2鹿血晶處理巨噬細胞后其上清促進黑色素瘤細胞凋亡 流式細胞術結果表明,單獨鹿血晶能夠促進B16F10早期凋亡,不影響其晚期凋亡(圖2A~C),而中、高濃度鹿血晶處理后的巨噬細胞上清顯著提高B16F10的早期凋亡和晚期凋亡(P<0.05)(圖2D~F)。
2.3鹿血晶促進巨噬細胞吞噬黑色素瘤細胞 巨噬細胞Raw264.7與帶GFP熒光標簽的B16F10共培后,流式細胞術結果顯示,不同濃度鹿血晶處理組巨噬細胞(F4/80+)的綠色熒光平均熒光強度高于對照組,結果顯示鹿血晶能夠顯著促進巨噬細胞對黑色素瘤細胞的吞噬作用,且呈劑量依賴性(P<0.05)(圖3)。
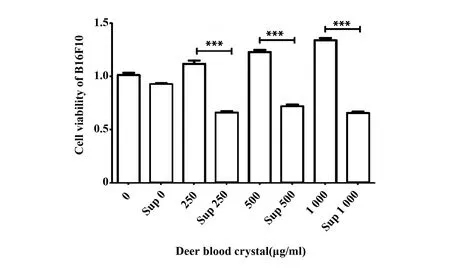
圖1 鹿血晶處理后巨噬細胞培養上清抑制B16F10細胞活力Fig.1 Supernatant of Raw264.7 treated with Deer blood crystal inhibits the cell viability of B16F10Note: Sup.Supernatant of Raw264.7 cells.Data are shown as
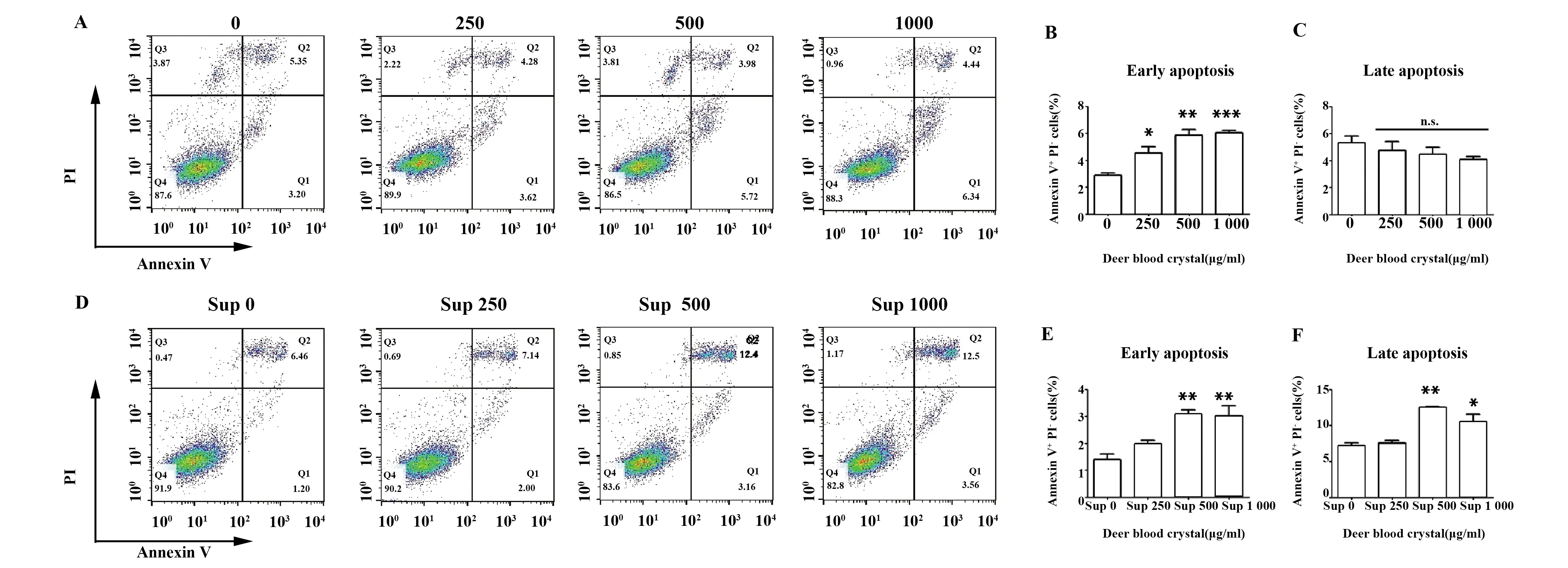
圖2 鹿血晶處理后巨噬細胞培養上清促進B16F10細胞凋亡Fig.2 Supernatant of Raw264.7 treated with Deer blood crystal promotes apoptosis of B16F10Note: Sup:supernatant of Raw264.7 cells.Data are shown as (n=3).*.P<0.05;**.P<0.01;***.P<0.001.
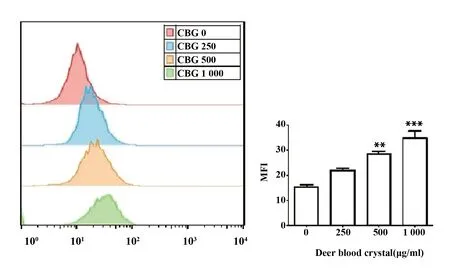
圖3 鹿血晶促進巨噬細胞吞噬B16F10細胞Fig.3 Deer blood crystal promotes phagocytosis of Raw264.7 to B16F10Note: Data are shown as
2.4鹿血晶促進巨噬細胞分泌炎癥因子 結果顯示,低、中、高濃度的鹿血晶均能夠顯著上調巨噬細胞活力(圖4A)。鹿血晶處理后的巨噬細胞形態發生了變化,胞體增大、偽足伸長、呈樹突狀,且隨鹿血晶濃度的增高巨噬細胞形態變化越明顯(圖4B),說明鹿血晶能夠激活巨噬細胞向炎癥形態變化。流式細胞術結果顯示,鹿血晶不會促進巨噬細胞發生凋亡(圖4C)。
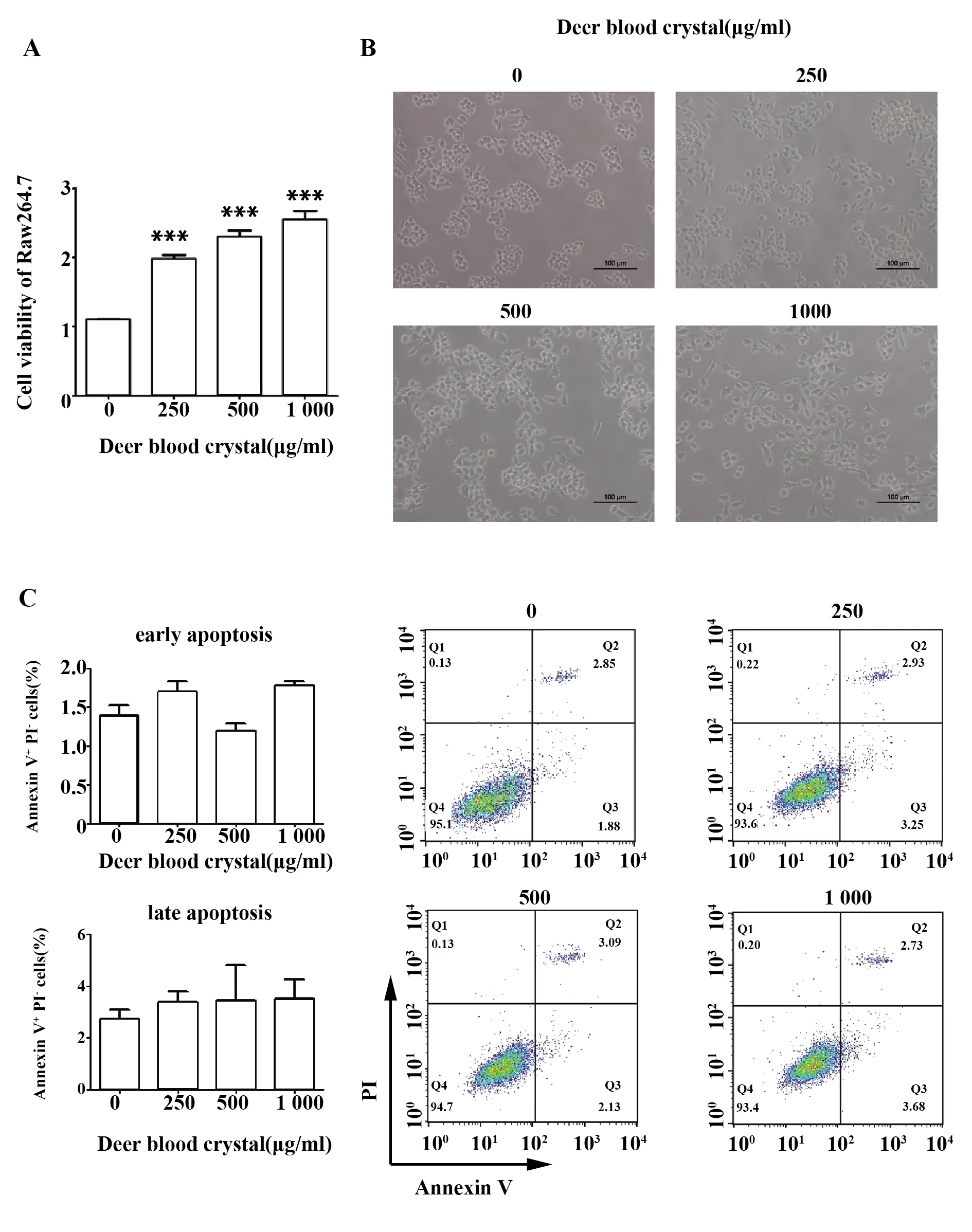
圖4 鹿血晶增強巨噬細胞活力Fig.4 Deer blood crystal promotes cell viability of Raw264.7 cellsNote: Data are shown as
有文獻表明[7,8],增強巨噬細胞的抗腫瘤活性,增強TNF-α、IL-6等炎癥因子的分泌有利于腫瘤的治療。本研究發現,低、中、高三個濃度的鹿血晶處理3 h后均能夠上調巨噬細胞促炎因子iNOS、IL-1β、TNF-α的表達,而IL-6則在高濃度處理12 h時才顯著上調(圖5A~C)。此外,不同濃度鹿血晶均能夠促進巨噬細胞分泌TNF-α和IL-6,而僅有高濃度鹿血晶促進巨噬細胞分泌一氧化氮(NO)和IL-1β(圖5D)。這些促炎因子均為M1型巨噬細胞高表達基因,也是M1型巨噬細胞主要分泌的炎癥因子。上述結果說明鹿血晶能夠促進巨噬細胞產生炎癥因子從而殺傷腫瘤細胞。
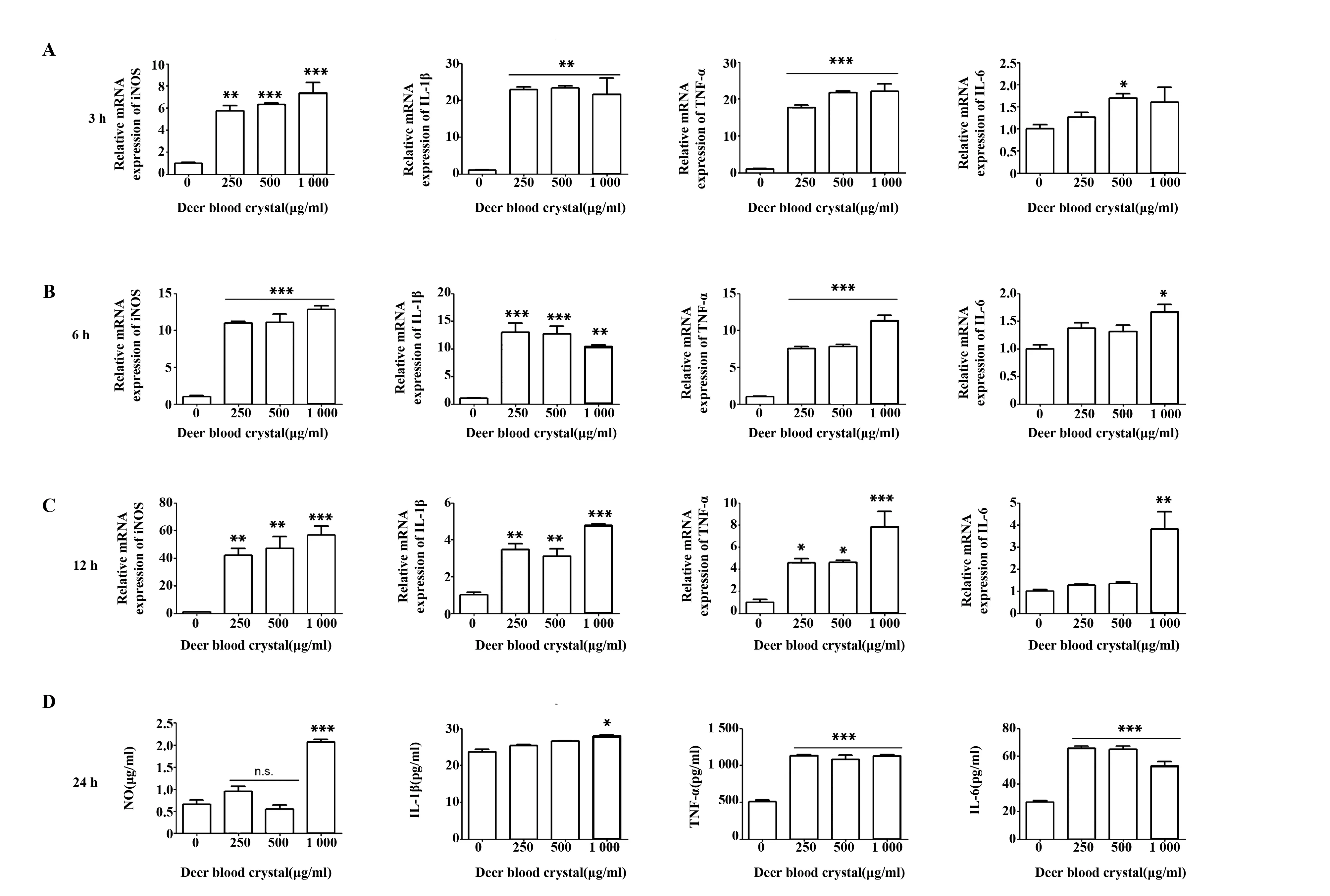
圖5 鹿血晶促進巨噬細胞分泌炎癥因子Fig.5 Deer blood crystal promotes expressions and secretion of inflammatory cytokinesNote: Data are shown as

圖6 鹿血晶活化巨噬細胞mTOR信號通路Fig.6 Deer blood crystal promotes phosphorylation of S6 and 4EBPNote: Data are shown as (n=3).*.P<0.05;**.P<0.01;***.P<0.001.
2.5鹿血晶活化巨噬細胞mTOR信號通路 文獻報道NO、IL-1β、TNF-α等炎癥因子的表達均與mTOR信號通路的活化有關[9,10]。本次實驗結果則表明鹿血晶能夠顯著上調mTOR下游4EBP和S6的磷酸化水平(P<0.05)(圖6)。綜上,鹿血晶能夠活化巨噬細胞mTOR信號通路。
3 討論
巨噬細胞是腫瘤免疫療法的重要成員,近年來針對腫瘤相關巨噬細胞(tumor-associated macroph-age,TAM)的研究層出不窮,誘導TAM向M1型極化、恢復巨噬細胞吞噬能力、增強巨噬細胞對腫瘤細胞的細胞毒作用均有利于腫瘤的治療[11,12]。由于巨噬細胞移植到體內后無法擴增,所以如何調控患者自身體內的巨噬細胞以對抗腫瘤顯得十分重要。
中藥廣泛應用于腫瘤化療后患者恢復和化療相關癥狀的治療。有文獻報道,鹿血晶能夠治療乳腺浸潤導管癌患者化療后白細胞減少癥[13],改善消化道腫瘤化療后骨髓功能[14]。但鹿血晶對機體免疫的直接作用尚不清楚,中藥在黑色素瘤方面的研究也非常匱乏。
在哺乳動物細胞中,mTOR具有多種功能,是細胞代謝的中心調控因子[15,16],腫瘤免疫抑制和抗增殖治療中也常靶向mTOR信號通路。有文獻報道,抑制mTOR信號通路能夠抑制LPS誘導巨噬細胞產生炎癥因子如IL-1β、IL-6、TNF-α等[17]。
體外實驗中,我們發現鹿血晶不僅能夠增強巨噬細胞活力,還能夠活化mTOR信號通路,上調mTOR下游4EBP和S6的磷酸化水平,提高巨噬細胞中炎癥因子的表達水平,促進炎癥因子TNF-α、IL-6、IL-1β和一氧化氮的分泌。含有上述炎癥因子的細胞上清能夠降低黑色素瘤細胞活力,促進腫瘤細胞發生凋亡。此外,鹿血晶還能提高巨噬細胞對腫瘤細胞的吞噬作用,增強巨噬細胞清除腫瘤細胞的能力。
綜上所述,本文通過實驗發現鹿血晶能夠活化巨噬細胞mTOR信號通路,促進巨噬細胞產生促炎因子,提升巨噬細胞對腫瘤細胞的吞噬、殺傷能力,為臨床應用中藥調節免疫抵抗腫瘤提供了理論基礎。

