分支胰管型胰腺導管內乳頭狀黏液瘤臨床分析
岳學良 劉紅山 楊森 閆一洋 趙中原
河南省人民醫院肝膽胰腺外科(鄭州大學人民醫院;河南大學臨床醫學院) 鄭州 450003
胰腺導管內乳頭狀黏液瘤(IPMN)在1980年由日本學者Ohhashi等首次報道[1],經過近40 年的臨床實踐,人們對IPMN的認識逐漸深入。按照病變累及范圍將其分為主胰管型(MD-IPMN)、分支胰管型(BD-IPMN)和混合型(MT-IPMN)。鑒于MD-IPMN較高的惡變率,自2006年國際胰腺病學會第一次發布了IPMN的治療指南至今,美國胃腸病協會、歐洲胰腺囊性腫瘤研究組,以及中華醫學會外科學分會胰腺外科學組,相繼發布了IPMN的相關治療指南,并經過多次修訂,其內容及爭議主要集中在BD-IPMN的治療方面[2-5]。現結合最新文獻復習回顧性分析2例BD-IPMN患者的臨床資料,對BD-IPMN的治療策略、惡變預測等進行探討,以提高對BD-IPMN的認識和治療水平。
1 資料和方法
1.1一般資料患者1,男,69歲。以間斷性上腹部疼痛4月余,無發熱及皮膚鞏膜黃染為主訴入院。血常規、肝腎功能、血尿淀粉酶均正常。CA199為3.13 U/mL,在正常范圍。彩超提示胰腺鉤突部68 mm×40 mm×62 mm囊實性回聲,邊界清,以囊性為主。CT提示胰頭占位,考慮導管內乳頭狀癌可能性大。MRCP提示胰頭占位,胰管擴張(見圖1)。患者2,男,62歲。以反復上腹部疼痛2月余,無發熱及皮膚鞏膜黃染為主訴入院。血常規、肝腎功能、血尿淀粉酶均正常。CA19-9為30 U/mL,在正常范圍。彩超提示胰體部29 mm×10 mm囊性回聲,邊界清,形態欠規則。CT提示胰體部低密度影伴胰管擴張,IPMN可能。MRCP提示胰體部囊性病變,IPMN可能(見圖2)。
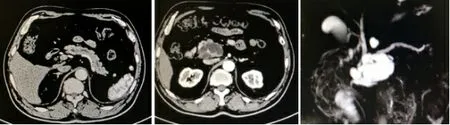
圖1 患者1 CT和MRCP影像

圖2 患者2 CT和MRCP影像
1.2治療方法2例患者均行胰十二指腸切除術。術中均行切緣快速冰凍檢查,結果均為陰性。術后常規予以抗感染、生長抑素、抑酸,以及營養支持。并依據加速康復外科理念,早期應用低分子肝素預防血栓形成。
2 結果
2例患者手術過程順利。術后患者1出現B級胰瘺,患者2出現一過性生化瘺,均經過通暢引流、抗感染、生長抑素、營養支持等治療,順利拔管后出院。患者1病理提示IPMN伴局灶導管周圍腺體不典型增生。患者2病理提示IPMN伴上皮輕-中度異型增生。隨訪6~12個月,均未發現復發、轉移。
3 討論
IPMN具有惡變潛能,其病理形態可表現為良性、輕度異型增生、中度異型增生、重度異型增生甚至浸潤性癌[6]。然而,到目前為止,尚無可靠的指標或方法對其惡變與否做出準確的判斷,也無法預測其病程的發展;另一方面,考慮到手術并發癥、病死率,以及胰腺內、外分泌功能的不足和保守治療帶來的惡變風險,外科醫生常常無法準確權衡手術和保守治療的利弊,亦無法確定最佳手術時機。和MD-IPMN相比,BD-IPMN具有更低的惡變潛能,其治療策略也更具有爭議性[6-7]。目前多個關于IPMN的診療指南已經發布,且經過多次修訂,但無一個指南具有領導地位。其中2017年國際胰腺病協會制定的福岡指南修訂版在臨床決策方面更加具有綜合性和實用性[2]。2018年歐洲胰腺囊性腫瘤研究組發布的關于IPMN的診療指南為最新診療指南,而且為第一部基于循證醫學發布的指南。但其循證多基于回顧性研究,缺乏隨機對照研究等高級別證據。2015年中華醫學會外科學分會胰腺外科學組發布的胰腺囊性疾病診治指南是我國目前唯一的關于IPMN的診療指南。表1、2、3列出了各個指南關于BD-IPMN的手術指征。2017年福岡指南修訂版(表1)中的手術指征為[4]:(1)有高度癌變風險的BD-IPMN。(2)具有任何一種“令人擔憂情況”的BD-IPMN,則進一步行EUS檢查,壁結節≥5 mm、主胰管受累或可疑受累、細胞學見惡性或可疑惡性者。(3)考慮到腫瘤進展的累積風險較高,對年齡<65歲、病變>2 cm,即使無高度癌變風險及“令人擔憂情況”的BD-IPMN患者。2018年歐洲發布的指南(表2)中指出了BD-IPMN的手術絕對適應證和相對適應證。手術指征為[3]:(1)存在絕對手術適應證。(2)有一項或以上的相對適應證且未合并其他嚴重疾病。(3)雖存在其他嚴重疾病,但有2項或以上相對適應證。2015年我國胰腺外科學組發布的指南(表3)中指出,對于BD-IPMN,由于不侵犯主胰管且惡變傾向相對較低,對直徑<3 cm者可隨訪觀察。當合并惡變高危因素,須積極手術處理。主胰管擴張5~9 mm 的患者如合并其他危險因素,根據情況亦可積極手術治療。對于存在嚴重合并癥的高危高齡患者,若僅有腫瘤直徑>3 cm一項高危因素,則可繼續觀察,但隨訪頻率應相應增加[5]。

表1 國際胰腺病協會2017年發布的福岡指南修訂版

表2 歐洲胰腺囊性腫瘤研究組2018年發布的關于BD-IPMN的診治指南

表3 我國中華醫學會外科學分會胰腺外科學組2015年關于BD-IPMN的診治指南
患者1按照我國的指南具有惡變高危因素,直徑>3 cm,具有手術指征;按照歐洲的指南具有手術相對適應證之一(直徑≥40 mm),且不合并其他嚴重疾病,具有手術指征;但按照福岡指南修訂版,存在“令人擔憂情況”則需進一步行EUS檢查。患者2按照福岡指南修訂版符合年齡<65歲,病變>2 cm且無高度癌變風險及“令人擔憂情況”,具有手術指征;但按照我國及歐洲的指南則無手術指征。2例患者的最終病理結果均為非浸潤癌,僅有不典型增生。由此可見,對于BD-IPMN的治療策略尚存爭議,常常使外科醫生難于抉擇治療方法,也使在外科治療策略的制定中,需更多依據患者的依從性、意愿,以及預期壽命和手術風險等因素[2]。
BD-IPMN治療策略的爭議歸根結底是對IPMN自然病程不明了,尚無有效的指標或方法對其惡變潛能進行準確的評估和預測,這也是目前研究的熱點[2]。臨床相關指標、影像學指標、血清學指標、分子診斷或生物學指標,以及各種綜合量表和分層分析評估的建立,都是目前研究的熱點,乃至隨著計算機技術的發展,人工智能深度學習,也被用于IPMN的研究中[6,8-15]。
目前關于BD-IPMN的診療指南中,多將IPMN相關的臨床癥狀,如梗阻性黃疸、胰腺炎、新發糖尿病等列為危險因素,尤其是腫瘤相關的梗阻性黃疸被認為是高危因素或手術的絕對適應證[3-4]。然而,面對BD-IPMN大多無特異性癥狀或無癥狀,就需要我們尋找其他預測指標[16]。
影像學對BD-IPMN的診斷和良惡性預測至關重要。CT、MRI、EUS是最常用的影像學檢查[6]。CT能提供薄層掃描,清晰顯示病變的隔膜、壁結節、鈣化灶,以及周圍的胰腺組織。美國放射學會在2017年發布的白皮書中建議使用多層螺旋CT。通過對比增強序列來評估胰腺囊腫。一項單中心研究表明,多層螺旋CT能對56%~82% 胰腺囊性病變的惡性傾向做出準確預測[6]。基于CT的定量分析評估也被應用于對高風險IPMN的預測,結合臨床指標可有效提高對低危和高危IPMN之間的術前鑒別[6]。除壁結節、胰管擴張、病變大小等常規影像學指標外,鈣化和胰腺脂肪含量亦被認為是可能高危IPMN的預測指標。Tsujimae等[8]研究了鈣化和IPMN的關系,指出鈣化灶尤其是粗大的鈣化灶可能為高危IPMN的預測指標之一,且和指南中的危險因素相結合評估IPMN的惡變傾向時明顯提高了特異性,但敏感性明顯不足。Kashiwagi K等[9]發現囊腫的初始大小和CT測定的胰腺脂肪含量與低風險BD-IPMN的影像學進展密切相關,胰腺脂肪變性本身可能會促進BD-IPMN的進展,并進一步指出指南的監測指標不僅應該基于初始的囊腫大小,還應該基于胰腺脂肪含量[9]。增強MRI和增強CT相比,在分辨危險因素和惡變傾向方面無明顯優勢,然而MRI在識別小囊性病變與胰管的交通方面較CT更為敏感,其評估囊性病變和主胰管交通方面甚至可與超聲內鏡(EUS)相媲美。同時,MRI沒有放射性,且平掃MRI無須增強亦可監測IPMN的異型改變,因此指南中多推薦MRI為IPMN隨訪監測的影像學檢查[6]。EUS在IPMN的診斷評估中是很關鍵的,其對BD-IPMN的壁結節診斷更為敏感。有研究表明其診斷的壁結節中約28%在CT和MRI診斷中是遺漏的[6]。EUS不僅可以顯示囊性病變及壁結節的形態,還可以對囊液進行取樣以及對壁結節和囊壁進行活檢,對囊液及胰液的進一步分析有助于BD-IPMN惡性潛能的評估[6,12-13]。Yamashita等[10]則報道了18-FDG PET/CT有助于IPMN良惡性的鑒別,有助于減少良性IPMN的不必要的手術治療。
作為危險因素的監測指標之一,腫瘤標志物CA19-9已經納入多個BD-IPMN的診療指南中[3-5]。中性粒細胞-淋巴細胞比率(Neutrophil to Lymphocyte Ratio,NLR)在預測IPMN惡性潛能方面逐漸受到關注。Riki等[11]研究發現惡性IPMN較良性IPMN中的NLR明顯升高,認為NLR≥2.2是惡性IPMN的獨立危險預測指標。但其他研究認為,NLR>2.074,NLR≥2.551,NLR >4是IPMN惡變的臨界值,故NLR預測IPMN惡變的臨界值尚存爭議。有研究指出,良性IPMN較健康人群NLR亦明顯升高,提示NLR可能和IPMN異型程度相關。Hiroshi等[12]對胰液中的癌胚抗原(CEA)進行研究發現,CEA不僅對惡性IPMN具有診斷價值,而且其水平高低可以監測IPMN惡性轉化的風險。囊液中膜相關糖蛋白MUC1的過表達被認為和侵襲性癌相關,且在IPMN的胰膽管型和嗜酸細胞型中表達。MUC4的表達被認為和異型增生程度相關[6]。利用囊液進行DNA檢測發現,KRAS和GNAS基因突變和IPMN相關,但無法評估異型增生程度。而囊液中單克隆抗體Das-1對于低危和高危IPMN分辨的特異性達95%,敏感性達85%[6]。Mateos等[13]對40例IPMN患者胰液中游離細胞的DNA進行分析發現,7q21和8q24的擴增和IPMN的病理學分級相關,多在侵襲性癌中出現,并指出突變負荷(mutation burden)和拷貝數改變(copy number alterations,CNAs)可能有助于IPMN惡變風險的評估。
鑒于對IPMN惡性潛能的評估缺乏有效的指標,且診療指南又無法做到個體化評估,各種綜合量表及分層分析評估逐漸被應用研究[6]。這些量表通過患者的年齡、性別、癥狀、體質量變化、壁結節、主胰管、病變大小、血液CEA及CA19-9等,進行綜合評估患者IPMN惡變或具有重度異型增生地風險,以期在IPMN癌變前對患者進行篩查并進行手術干預。然而這些量表間的預測指標差異很大,有待于進一步前瞻性臨床研究的驗證[6]。Kasper A等[14]則研發了荷蘭-美國風險分層工具DART-1(Dutch-American Risk stratification Tool),該工具不同于以往著眼于篩查高危IPMN的量表,而是著眼于篩查評估那些沒有令人擔憂情況及高危因素的低危BD-IPMN患者,以期對這些低危IPMN使用更寬松的監測策略,使其免受冗余醫療干預,并降低醫療系統的成本和負擔。
隨著計算機技術的發展,人工智能深度學習也被用于IPMN的研究中。Takamichi 等首次將人工智能(Artificial intelligence,AI)用于基于EUS的IPMN診斷中,發現AI值在惡性IPMN中較良性IPMN明顯升高,其準確率達86.2%。而AI惡性率(AI malignant probability)的敏感性、特異性、準確性分別高達95.7%、92.6%和94.0%,且其準確性高于人工診斷。指出AI惡性率是預測IPMN惡性潛能的獨立診斷因子,并建議將AI用于術前對IPMN惡性情況的評估中[15]。
手術是目前治療BD-IPMN唯一有效的方法。手術方式根據病變情況可行胰十二指腸切除術、遠端胰腺保脾或聯合脾臟切除術、全胰腺切除術、中段胰腺切除術、局部切除術等,術中建議對淋巴結進行清掃,需保證術中切緣冰凍陰性[3-5,16]。Ratnayake等[17]對局部切除術治療BD-IPMN進行系統評價指出,在低風險的BD-IPMN中,局部切除術似乎是一種合理的替代手術方法,可以保留外分泌和內分泌功能,與其他術式的再手術率和復發率相當。但鑒于BD-IPMN具有惡變潛能,局部切除術不符合腫瘤學處理原則,指南對局部切除多持謹慎態度,且需隨訪監測[3-4]。EUS引導下注射乙醇等消融術治療BD-IPMN目前尚缺乏標準化,且療效尚不確定,各大指南均不推薦[3-5]。Gonzalez等[18]對21例無令人擔憂情況但伴有復發性胰腺炎或餐后腹痛的BD-IPMN患者行ERCP下胰管括約肌切開術,發現70%的患者是安全、有效的,可以避免不必要的或早期的胰腺切除術,且隨訪5 a以上沒有進展為癌癥。在本研究中,2例患者均接受了胰十二指腸切除術,術后患者1出現B級胰瘺,患者2出現一過性生化瘺。均經通暢引流、對癥支持治療后順利出院。這可能和BD-IPMN患者胰腺質地軟而增加胰瘺風險有關,和Hipp等[7]的研究結果相符。提示我們對于老年患者及有嚴重合并癥患者的手術指征更應仔細權衡,嚴格把握。
綜上所述,BD-IPMN作為一種低惡性潛能的腫瘤,尚缺乏有效的指標或方法精準預測其惡性潛能,治療策略尚存爭議。然而,經過近40 年的臨床實踐和研究,以及對BD-IPMN的認識不斷加深,臨床治療策略逐漸向循證醫學的方向發展,治療策略亦更加趨于保守。手術是目前唯一有效的方法,但外科治療策略的制定需結合患者的依從性和意愿,以及考慮患者的預期壽命和手術風險等因素。對老年患者及有嚴重合并癥患者的手術指征應謹慎把握。豐富和完善BD-IPMN的臨床治療策略有待于進一步探索其自然病程,尋找新的危險因素以及建立更加實用可靠的分層、分析評估方法,甚至利用深度學習等人工智能技術,探索BD-IPMN在手術治療和保守治療之間的完美平衡點。

