美拉德反應改善苦蕎蛋白水解物乳化性的研究
(佛山職業技術學院,廣東佛山528137)
通過酶法水解能夠改善蛋白質的多種功能性質,但酶法水解會導致蛋白質分子量顯著降低,影響蛋白質的乳化性,不利于水解蛋白的廣泛應用。近幾年,國內外將研究重點放在美拉德反應初期糖基化改性上。美拉德反應初期生成的產物因擁有良好的功能性質而受到廣泛的關注。糖基化改性蛋白質的功能特性是基于美拉德反應生成蛋白質與糖的衍生物,是一種綠色、自發的反應,具有較高的安全性。糖分子能夠與蛋白質共價結合,顯著改善蛋白質的功能性質[1]。糖分子不僅能夠改善蛋白質由于分子量過小引起的乳化性問題,增加了水解蛋白擴散到油水界面上的速率[2]。此外,能夠有效保護蛋白水解物原有的抗氧化效果。張欣等[3]將豌豆蛋白水解物分別與葡萄糖、麥芽糊精和葡聚糖進行溫和的美拉德反應顯著改善了原有的乳化活性,并保留了抗氧化性。其中,葡聚糖還能夠改善蛋白質的空間結構,起到增稠的作用。但是,美拉德反應處于中后期時容易引起蛋白質交聯,破壞其乳化性[4-5]。為了能夠讓美拉德反應處在糖基化反應階段,所以要控制反應過程[6]。通過研究糖分子與水解蛋白的交聯,提升水解蛋白的乳化性能的作用機理。
苦蕎蛋白由于其較高的營養價值和生理功能受到廣泛關注。苦蕎蛋白不僅具有抗氧化、預防心血管疾病、降血脂、降血糖、降血壓等功效,還能夠減肥敗毒、清理人體垃圾、激活胰島素分泌。因此,本研究采用堿性蛋白酶水解1 h的苦蕎蛋白與3種還原糖(葡萄糖、麥芽糊精、葡聚糖)進行交聯,優化美拉德反應的條件。通過測定游離氨基含量、乳化活性、乳化穩定性以及乳狀液的粒徑、電勢和,比對3種還原糖與苦蕎蛋白水解物反應生成共聚物的乳化性能的變化情況以及對苦蕎蛋白水解物抗氧化能力的影響,為高效、安全的生產乳化劑奠定了理論基礎,在乳化型食品的生產加工方面具有較好的理論和現實意義。
1 材料與方法
1.1 材料
苦蕎麥:吉林省松原市北顯糧油貿易發展有限公司;葡萄糖、麥芽糊精、十二烷基硫酸鈉(SDS)、2,4,6-三硝基苯磺酸:美國Sigma公司;葡聚糖:美國Spectrum公司;堿性蛋白酶:丹麥Novo公司;三氯乙酸、硫代巴比妥酸:美國Fisher公司。
1.2 儀器與設備
DH-9070A型電熱恒溫鼓風干燥箱、DK-8B型電熱恒溫水浴鍋:上海精宏設備有限公司;JB-2型恒溫磁力攪拌器:上海雷磁新徑儀器有限公司;ER型冷凍離心機:湖南湘儀實驗室儀器開發有限公司;TU-1800型紫外分光光度計:北京普析通用儀器有限公司。
1.3 試驗方法
1.3.1 苦蕎蛋白提取
將苦蕎麥粉碎以料液比1∶10(體積比)、pH 8.0、溫度40℃,攪拌提取1 h后6 000 r/min離心分離20 min,取上清液用1 mol/L HCl調pH值至4.5,水洗沉淀后用1 mol/L NaOH調pH值至中性,凍干備用。
1.3.2 苦蕎蛋白水解物的制備
參照Wang等[7]的方法,苦蕎蛋白的底物濃度為4%(質量比),堿性蛋白酶在pH 8.0,55℃條件下水解1 h,酶與底物比為 2∶100(質量比),使用1 mol/L的NaOH維持pH值不變。水解后95℃水浴加熱5 min,用1 mol/L HCl將pH調成中性后在9 000 r/min下離心10 min并將上清液用分子量為100 Da的透析袋進行透析12 h除去鹽后冷凍干燥,并在4℃下保存。
1.3.3 美拉德反應共聚物的制備及反應條件的確定
參照Zhu等[8]的方法。水解苦蕎蛋白分別與葡萄糖、麥芽糊精和葡聚糖混合于磷酸鹽緩沖液中(50 mmol/L,pH 7.0)中。反應條件:反應溫度為70℃,蛋白濃度為2%,糖濃度分別為5%、7.5%、10%,pH值分別為 6.5、7.0、7.5,反應時間分別為 6、8、12、24 h。相同條件處理TBPH(不含糖)做為對照組。反應完成后立即放入冰水中冷卻并且4℃保存。
1.3.4 褐變程度的測定
根據Ajandouz等[9]的方法并作恰當修改。樣品稀釋20倍后在420 nm處進行比色。
1.3.5 游離氨基含量測定
取200 μL樣品加入到2 mL 0.1%SDS中混勻,加入1 mL 0.01%2,4,6-三硝基苯磺酸溶液,避光處理,50℃水浴保溫60 min后加入2 mL 0.1 mol/L Na2SO3進行終止反應,室溫下放置15 min,在420 nm處進行比色。以2 mmol/L亮氨酸做標準曲線,確定水解液中游離氨基含量[10]。
1.3.6 乳化活力及乳化穩定性的測定
參照Li等[11]的方法。取1mg/mL的水解樣品8mL,加入2 mL的大豆油,13 500 r/min下乳化1 min。在乳化0 min和10 min后,分別取50 μL乳狀液加入裝有5 mL 0.1%SDS溶液的離心管中,混勻后在500 nm處進行比色,計算公式如下:
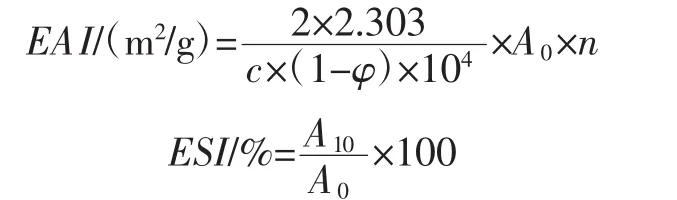
式中:A0為初始乳狀液的吸光值;A10為乳狀液靜置10 min后的吸光值;c為樣品溶液的蛋白濃度(g/mL);φ為乳狀液中油相的比例;n為稀釋倍數。
1.3.7 乳狀液電勢和粒徑的測定
將10%(質量比)的大豆油與90%(質量比)含不同乳化劑的水溶液混合(Tween 20為乳化劑作為對照組),13 500 r/min下乳化2 min后,35 MPa下經高壓均質機均質兩次。加入疊代鈉(0.03%,質量體積比)進行抑菌。取均質后的乳狀液50 μL,加入到裝有5 mL超純水中混勻,注入到彎曲毛細管中,在常溫下使用Malvern激光粒度儀測定不同樣品的ζ-電勢和粒徑。
1.3.8 抑制脂質體氧化能力
根據Decker和Hultin[12]的方法稍作修改。0.2 mg/mL大豆卵磷脂溶解在0.12 mol KCl中,5 mmol/L組氨酸緩沖溶液(pH 6.8)均質后,在4℃進行超聲降解45 min。5 mL脂質體和1 mL樣品測定抗氧化活性,1 mL超純水作陰性對照,0.02%BHA作為陽性對照。在脂質/蛋白溶液(6 mL)中分別加入0.1 mL 50 mmol/L的FeCl3和10 mmol/L的抗壞血酸鹽。樣品在37℃水浴中保溫60 min,加入2 mL 2.8%FeCl3溶液和1 mL 1%硫代巴比妥酸溶液,沸水加熱15 min,冷卻室溫后,加入等量的氯仿。在532 nm處進行比色。計算公式如下:
TBARS/(mg/L)=(A532/Vs)×9.48
式中:A532為溶液在532 nm的吸光值;Vs為待測樣品的體積,mL;9.48為常數。
1.4 統計分析
每個試驗重復3次,結果表示為平均值±標準差。數據統計分析采用Statistix 8.1(分析軟件,St Paul,MN)軟件包中Linear Models程序進行,差異顯著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 11.0軟件作圖。
2 結果與分析
2.1 美拉德糖基化反應條件的確定
圖1為通過測定不同pH值、反應時間下TBPH與葡聚糖美拉德反應產物褐變程度來評價美拉德反應的進程,最終確定反應條件為pH 7.0、反應濃度為10%、反應時間為12 h。
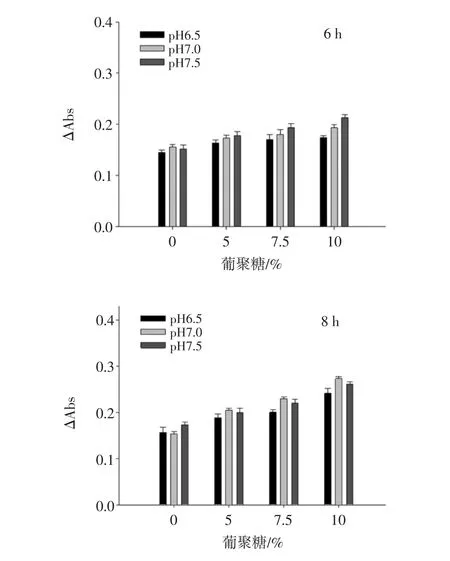
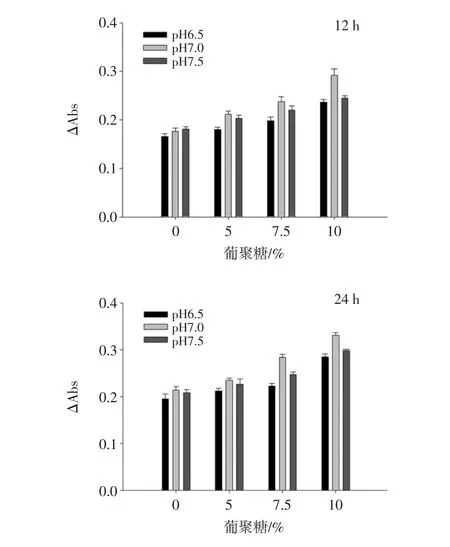
圖1 不同反應條件下苦蕎蛋白水解物與葡聚糖美拉德反應產物的褐變程度Fig.1 The extent of browning in the Maillard conjugation of TBPH and dextran under different conditions
為了有效提高蛋白質功能特性,可以引入糖分子與蛋白質的美拉德反應,但是美拉德反應在中后期時蛋白質的乳化性能逐漸喪失[13]。然而,在美拉德反應中反應初期得到的產物較為溫和,若將美拉德反應控制在初級階段不僅不會減弱功能性質,還能夠增加蛋白質的乳化性能[14]。美拉德反應受到多種因素的影響,反應溫度、反應時間、反應物的濃度和pH值條件都會通過影響蛋白質的聚集和焦糖化反應進程而影響產物的褐變程度。當反應時間為24 h褐變程度過高時,說明反應已向著美拉德反應的中后期進行。增加蛋白質的聚集和焦糖化反應從而加劇糖基化的反應進程,致使蛋白質的一些功能特性減弱,影響蛋白的功能特性[15]。然而,在美拉德反應中反應初期得到的產物較為溫和,不僅不會減弱功能性質,還能夠增加蛋白質的乳化性能[16]。
2.2 游離氨基含量的變化
游離氨基酸的含量能夠表明美拉德反應的進程及糖的活性,能夠反應美拉德反應初期階段的進程情況[17]。不同糖與TBPH形成共聚物的游離氨基含量如表1。
未加熱的TBPH游離氨基的含量為2.75 mmol/g蛋白,而加熱后的TBPH游離氨基的含量降到2.29 mmol/g蛋白,這可以解釋為氨基酸之間發生了交聯引起了游離氨基含量降低[18]。TBPH和還原糖的反應12 h后游離氨基酸的含量顯著降低(P<0.05)。說明氨基和羰基相互結合,具有糖基化反應產物生成。3種還原糖中小分子的葡萄糖與TBPH生成的游離氨基含量為1.58 mmol/g蛋白,顯著低于麥芽糊精及葡聚糖與TBPH生成的游離氨基含量。可見葡萄糖與TBPH的進行美拉德反應時的反應活性要高于大分子的麥芽糊精及葡聚糖的[19]。這可以解釋為分子較大的糖醛基的量較少,并具有一定的空間位阻影響了美拉德反應的進程。

表1 苦蕎蛋白水解物與還原糖反應生成游離氨基的含量Table 1 The content of free amino in tartary buckwheat protein hydrolysate reacted with reducing sugar
2.3 乳化活性和乳化穩定性
TBPH與還原糖發生糖基化反應后,EAI和ESI的變化情況(P<0.05),見表 2。

表2 苦蕎蛋白水解物與還原糖反應產物的乳化活性和乳化穩定性Table 2 EAI和ESI of reaction product of TBPH and reducing sugar
表2中顯示,TBPH與還原糖發生糖基化反應后EAI和ESI顯著提高(P<0.05),這可以解釋為蛋白與糖形成的共聚物能夠減弱油相和水相的界面張力,形成致密的界面膜。糖分子能夠與水相中的水分子產生水和作用,增強空間位阻的同時還能產生更為厚實的界面膜,進一步阻礙聚集現象的發生[20]。3種還原糖中葡聚糖的乳化性最好,這是因為葡聚糖的分子鏈較長,可形成網狀結構增加親水基團和疏水基團的平衡,對TBPH的結構進一步進行修飾,提高液滴的穩定性并能夠防止聚集[21]。除此之外,大分子的糖類還能夠起到增稠的作用,能夠抵御外部環境的破壞[22]。然而,小分子的葡萄糖與TBPH發生的美拉德反應較為活躍,打破了親水基團和疏水基團之間的平衡,減弱了TBPH在界面的吸附能力,因此共聚物的乳化性能并沒有被提高[23]。
2.4 乳狀液的粒徑和電勢
TBPH反應在不同乳化體系生產的共聚物,其粒徑和ζ-電勢的變化情況,如表3。

表3 TBPH-糖共聚物制備乳狀液的粒徑和電勢值(5 mg/mL)Table 3 Particle size and ζ-potential of emulsions prepared with TBPH-saccharide conjugates(5 mg/mL)
乳化液滴的粒徑大小能夠直接反應出乳化劑的乳化效果,即液滴的粒徑值越小,乳化顆粒越為分散,乳化劑的乳化性能越優越。從表3中不難看出,與TBPH為乳化劑相比,TBPH與還原糖反應生產的共聚物粒徑均顯著降低(P<0.05),并且TBPH與葡聚糖反應的共聚物形成乳狀液具有最小的粒徑。這是因為TBPH-葡聚糖共聚物制備乳狀液時,不僅有多肽吸附到了脂滴表面,還有分子鏈較大的葡聚糖一同吸附到了液滴表面,此時產生了較大的空間位阻,減少了聚集現象的發生[24]。
ζ-電勢是反應乳化液滴粒子間靜電相互作用的一個重要物理指標。當乳狀液液滴間具有較高的ζ-電勢值就說明脂滴間具有較大的靜電排斥力,能夠使液滴彼此遠離,從而起到穩定乳狀液的目的[25]。如表3,以TBPH為乳化劑制備的乳狀液的ζ-電勢值為-16.58 mV,而以TBPH與3種還原糖形成共聚物制備的乳狀液帶有更多的負電荷,并且TBPH-葡聚糖共聚物為乳化劑制備的乳狀液ζ-電勢值最大,為-24.02 mV。可見,共聚物制備乳狀液的帶電量明顯提高(P<0.05)。但是以TBPH作為乳化劑分散的乳狀液帶電量顯著降低(P<0.05)。這就說明了相比TBPH,TBPH-葡聚糖共聚物不僅有較好的乳化活性,還具有更高的乳化穩定性。
2.5 乳狀液的氧化穩定性
TBPH-糖共聚物制備乳狀液,其穩定性用儲藏時間在10 d以內的TBARS值的變化來確定,如圖2。
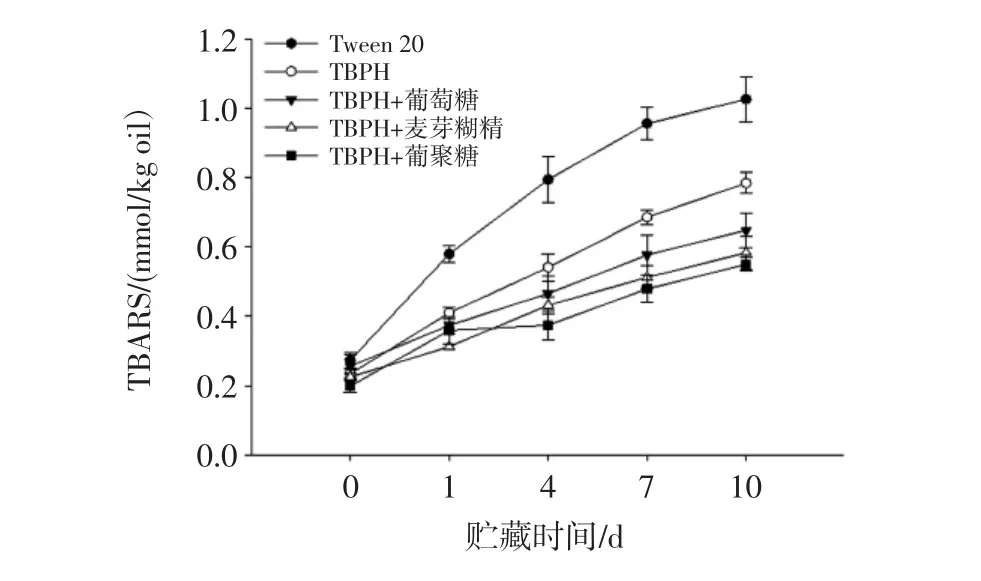
圖2 TBPH-糖共聚物制備乳狀液的TBARS值(5 mg/mL)Fig.2 TBARS of emulsions prepared with TBPH-saccharide conjugates(5 mg/mL)
從圖2能夠看出,TBPH與TBPH-葡聚糖共聚物制備的乳狀液均能夠起到提高體系氧化穩定性的效果。相比于TBPH,TBPH與還原糖反應生成的共聚物更夠更好的抑制脂質氧化。其中,TBPH與葡聚糖生成的共聚物抑制脂質氧化的最好。這是因為TBPH和葡聚糖發生美拉德反應生成的共聚物親水基團和疏水基團更為平衡,具有更強的自由基清除能力[26]。此外,TBPH與大分子糖能夠結合在一起形成更為致密的界面膜,能夠較好的防止油脂進一步氧化[27]。雖然,美拉德反應的過程中會消耗氨基,降低自由基的清除能力。但溫和的美拉德反應對自由基的清除能力影響不大,并能夠通過增加黏度來增加乳狀液的穩定性[28]。可見,TBPH-葡聚糖共聚物不僅具有較好的乳化活性和乳化穩定性,還保留了TBPH原有的抗氧化活性,并能通過乳化穩定性進一步提高乳化體系的穩定性。
3 結論
通過篩選最終確定美拉德反應條件為2%TBPH、10%糖、pH 7.0、反應時間為12 h。3種還原糖與TBPH形成的共聚物乳化性能都被顯著提高。但與葡萄糖和麥芽糊精相比,TBPH與葡聚糖發生的美拉德反應為最溫和,游離氨基含量最高,乳化活性和乳化穩定性最高并且形成乳狀液的粒徑、電勢和氧化穩定性最好,同時還能一定程度的提高TBPH原有的抗氧化能力。并且,糖分子鏈越長與TBPH形成共聚物的乳化性能就越好。

