吉林漢族人群維生素D受體基因多態性對糖尿病氧化應激的影響
王海英 孫亞東 金濤 武楊 謝立凱 張兵 李柯旻 馬彥 姜艷靜
(吉林省人民醫院內分泌科,吉林 長春 130000)
維生素D的非經典途徑研究表明〔1〕,維生素D在葡萄糖刺激胰島素分泌及維持正常血糖水平起到一定作用,血糖升高后,會增加機體的游離脂肪酸和慢性炎癥反應,導致氧化應激產物的增加及機體抗氧化能力的下降。研究表明〔2〕,早期維生素D缺乏可能會促進糖尿病氧化應激反應。人體的胰腺血管平滑肌、肝、腎、小腸、心肌細胞等全身各組織器官中存在維生素D受體(VDR),前期實驗已經證實,VDR基因 Bsml位點基因多態性與中國吉林地區漢族人群2型糖尿病(T2DM)密切相關,可能是該地區人群T2DM的一個易感基因〔3〕,目前關于VDR多態性與氧化應激的相關性還未完全闡明,本研究旨在探討吉林漢族人群VDR基因多態性對糖尿病氧化應激的影響。
1 研究對象與方法
1.1研究對象 選擇2017年1月至2017年6月在吉林省人民醫院內分泌科門診及住院的T2DM患者150例為T2DM組,按1999年世界衛生組織(WHO)糖尿病標準診斷:空腹血糖(FPG)≥7.0 mmol/L,餐后2 h血糖(2 h PG)≥11.1 mmol/L,除外腎功能損害及長期服用影響骨代謝藥物者;同期收集醫院體檢中心健康體檢者100例為正常對照組,記錄姓名、性別、年齡、體重、身高、血壓。研究對象均為吉林地區的漢族人群,無血緣關系,女性患者排除妊娠,對實驗目的知情同意。
1.2實驗室指標檢測:①受試者禁食8~10 h,晨起抽取空腹肘正中靜脈血,測定FPG、2 h PG、總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)、糖化血紅蛋白(HbA1c),生化指標由用奧林巴斯AU5400全自動生化分析儀測定,HBA1c使用高效液相色譜法測定。②在早晨7點排空尿液后開始取尿液到第2天早晨,使用8-羥基脫氧鳥苷酶(OHdG)酶聯免疫吸附試驗(ELISA)定量檢測尿液中的8-OHdG,嚴格按照試劑盒說明書步驟進行操作。收集每位入選者外周靜脈血4 ml,采用酚-氯仿法提取基因組DNA。通過聚合酶鏈反應-限制性片段長度多態性分析(PCR-RFLP)檢測T2DM患者VDR Bsml基因多態性。引物:正義鏈5'- CAACCAAGACTACAAGTACCGCGTCAGTGA-3',反義鏈5'-AACCAGCGGAAGAGGTCAAGGG-3'(上海生工合成)。應用PCR試劑盒,PCR體系為25 μl。反應條件:預變性94℃ 3 min,變性94℃ 30 s,退火62℃ 30 s,延伸72℃ 1 min,30個循環,總延伸72℃ 5 min。繼以限制性內切酶37℃水解過夜,置4℃保存。用1.5%瓊脂糖凝膠電泳,在凝膠成像分析系統中觀察,照相記錄結果。VDR Bsml 位點3種基因型:BB(800 bp)、Bb(800,650,175 bp)、bb(650,175 bp)。
1.3統計學方法 運用在線軟件檢測是否符合Hardy-weinberg平衡規律計算基因型和等位基因頻率。采用SPSS12.0統計軟件包進行t及χ2檢驗。
2 結 果
2.1一般資料 兩組年齡、性別比差異無統計學意義,T2DM組體重指數(BMI)、FPG、2 h PG、HbA1c、TC、TG、LDL-C均顯著升高,HDL-C水平顯著降低(P<0.05,P<0.01),見表1。
2.2VDR Bsml位點基因型及等位基因分布 兩組研究對象基因型分布均符合Hardy-weinberg平衡規律。T2DM中BB基因型出現頻數為2,所以將BB、Bb基因型合并分析。與正常對照組比較,T2DM組中BB+Bb基因型頻率明顯高于正常對照組(P<0.05),B等位基因頻率明顯高于正常對照組(P<0.05),基因型bb明顯低于正常對照組(P<0.05)。見表2。
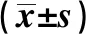
表1 兩組一般情況的比較
與正常對照組相比:1)P<0.05, 2)P<0.01;表2同

表2 兩組VDR Bsml各基因型和等位基因分布〔n(%)〕
2.3兩組Bsml各基因型與尿8-ObdG水平的比較 T2DM組中,與bb基因型〔(65.9±15.1)ng/mg Cr〕比較,BB+Bb基因型尿8-OHdG水平〔(93.5±32.6)ng/mg Cr〕顯著升高(P<0.01)。正常對照組中,BB+Bb基因型與bb基因型尿8-OHdG水平〔(76.6±20.3)、(63.9±14.6)ng/mg Cr〕無統計學差異(P>0.05)。兩組BB+Bb基因型8-OHdG水平差異顯著(P<0.05)。
3 討 論
T2DM的病因研究發現,遺傳和環境包括飲食因素發揮了很大作用,維生素缺乏會影響糖代謝,胰島素分泌受損,胰島素抵抗,最終導致糖尿病〔4〕。1,25二羥維生素D都必須通過與VDR結合才能發揮其生理效應,VDR廣泛存在于全身幾乎所有的有核細胞。胰腺組織中存在VDR,目前已發現VDR的基因多態性與糖耐量和胰島素分泌相關〔5,6〕。
高血糖等多種代謝紊亂會引起炎癥和氧化應激增強,增加表達超氧化物歧化酶(SOD)是細胞降低氧化應激產物過度表達的防御機制。但體內長期的高血糖、高血脂可以直接導致T2DM患者體內慢性氧化應激增強,又可損害線粒體能量代謝,進一步產生更多脂質過氧化物,導致細胞水平氧化與抗氧化過程失衡,形成惡性循環,引起不可逆的細胞和組織損傷。研究表明活性氧(ROS)可直接損傷線粒體,引起線粒體功能障礙,進而損傷胰島β細胞,影響葡萄糖刺激的胰島素分泌,引起胰島素抵抗〔7〕。機體血糖升高后,過量的ROS可以攻擊DNA產生的一種氧化性加合物——8-OHdG〔8〕。目前在評估體內DNA氧化損傷的指標中,8-OHdG因其在體內含量穩定,且影響因素少,被公認為機體氧化損傷程度評價的理想標志物,可以利用ELISA、高壓液相、毛細管區帶電泳等方法對其進行檢測。
動物試驗證實,維生素D能夠調節糖尿病SOD、谷胱甘肽(GSH)抗氧化酶的活性〔9〕。在2015年對愛爾蘭人群的研究發現,VDR Bsml位點Fokl基因的多肽性與氧化應激有關〔10〕。本研究結果表明中國吉林地區漢族人群T2DM VDR Bsml位點B等位基因者更易加重氧化應激的發生。
在T2DM及其慢性并發癥的發生及發展中已經明確了氧化應激機制的重要作用,關于T2DM慢性并發癥的很多研究進行了關于維生素D水平與氧化應激關系的探討。分別對T2DM視網膜病變患者和T2DM腎病患者進行的研究結果均提示糖尿病患者存在氧化應激損傷,且25羥維生素D3水平下降〔11,12〕。具有和膽固醇相似結構的維生素D,在基礎研究中已經證實具有與維生素E相等甚至更強的抗氧化作用,抗氧化的維生素具有激活免疫系統和抵抗基因遺傳改變的多種生物活性,可以阻止由ROS誘導的DNA損傷。維生素D的抗氧化能力由調節氧化應激中自由基的形成及上調GSH過氧化氫酶和SOD所激活〔13〕。研究表明,1,25二羥維生素D3可能通過VDR介導的途徑來調節高糖誘導的腎小管上皮細胞解耦聯蛋白2的表達,并抑制高糖誘導下的氧化應激反應〔14〕。目前關于如何調節T2DM VDR Bsml位點B等位基因的表達以減少氧化應激的發生,有待于進一步的研究。

