冷凍切片包埋儀在組織冷凍制片中的應用效果觀察
翁丹楓,駱慧穎,蔡偉棟,黎三艷,李國平
冷凍切片是在低溫條件下使組織迅速凍結到一定硬度后進行切片的一種方法,目前廣泛應用于術中病理診斷[1]。高質量且快速的冷凍制片病理學檢查能夠縮短術中等待時間,幫助臨床醫師在手術過程中盡快決定手術方案。本實驗通過比較3種不同冷凍方法下的冷凍制片速度和質量,探究一種新的速凍包埋法的冷凍制片質量效果,現介紹如下。
1 材料與方法
1.1 標本收集福建醫科大學實驗動物中心存檔的小白鼠肺、肝、腎、腦組織各25例,合計100例,以及福建醫科大學附屬第一醫院存檔的子宮肌瘤及甲狀腺標本各20例,合計40例。
1.2 儀器與試劑Chaser冷凍包埋儀(江蘇無錫啟盛實驗設備公司),冷凍錘,Thermo Fisher Linistat直線型自動染色機,Thermo切片機,OCT包埋劑,AAF混合固定液,HE染液,乙醇,二甲苯等。
1.3 方法小鼠采用頸椎脫臼法處死后,取小鼠肺、肝、腎、腦組織。小鼠及人標本組織平均分為3份,分別采用不同方法包埋:(1)速凍臺冷凍法:組織放入預冷的組織托上加適量的OCT膠后放入冷凍箱速凍臺上進行速凍;(2)冷凍錘速凍法:將組織放在預冷的組織托上后放至速凍點,加入適量OCT膠,待底部變白且表面未凝固時立即加蓋冷凍錘速凍,注意保持冷凍錘水平;(3)包埋儀速凍法:冷凍包埋儀凹槽里先加少許OCT膠后將組織放入槽內,然后繼續把膠填滿包埋槽,最后將組織托朝下進行包埋,速凍時間設置為30 s,之后取出放入冷凍機進行切片。
1.4 HE染色與結果判定組織經三種不同冷凍方式包埋切片后,經AAF固定液固定1 min,然后放入自動染色機進行HE染色、封固。冷凍切片質量評分等級標準:甲級片(優)90分以上、乙級片(良)80~89分、丙級片(合格)60~79分,丁級片(不合格)低于60分。甲級、乙級片定義為質量佳者,丙級、丁級片定義為質量不佳者。
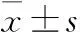
2 結果
2.1 不同冷凍方式制片時間的比較單因素方差分析結果表明,在小鼠肺、肝、腎、腦組織及人子宮肌瘤、甲狀腺組織中,包埋儀速凍法組織制片時間明顯短于冷凍錘速凍法(P<0.001)和速凍臺冷凍法,差異有顯著性(P<0.001);冷凍錘速凍法與速凍臺冷凍法之間的制片時間差異無顯著性(P=0.861,表1)。

表1 不同冷凍方法組織制片時間
#A組與B組比較;*B組與C組比較;△A組與C組比較
2.2 不同冷凍方式制片HE染色質量的比較在小鼠及人標本中,包埋儀速凍法制片質量明顯優于冷凍錘速凍法(P<0.001)和速凍臺冷凍法(P<0.001)(表2)。鏡下觀察三種方式包埋制片的HE冰晶情況(圖1、2),可見速凍臺冷凍法包埋的組織內形成大量冰晶,細胞間出現不規則空隙,細胞被擠壓收縮,結構變形;冷凍錘速凍法及包埋儀速凍法包埋的組織中冰晶較少,且結構完整、染色均勻。包埋儀速凍法小鼠及人的各組織冰晶形成量與冷凍錘速凍法相比差異無顯著性(P>0.05,表3、4),與冷凍臺速凍法相比差異有顯著性(P<0.001)。此外,切片質量方面,包埋儀速凍法在小鼠腦(P=0.044)、肝(P=0.037)、腎(P=0.031)及人子宮肌瘤(P=0.005)、甲狀腺(P=0.017)組織制片質量優于冷凍錘速凍法,差異有顯著性。在固定與染色、外觀方面,3種冷凍方法各組織HE染色質量差異無顯著性(P>0.05)。
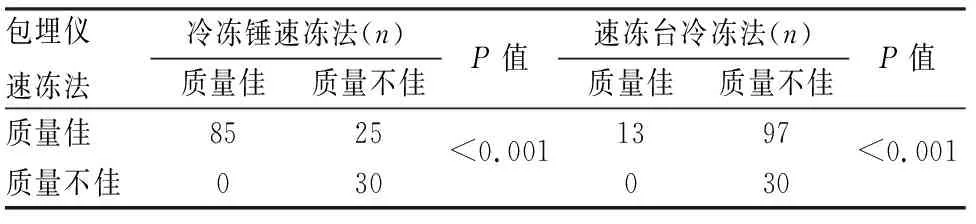
表2 不同冷凍方法組織制片質量
質量佳:≥80分;質量不佳:<80分
3 討論
冷凍制片技術因其制片時間短、組織結構保存完好而成為術中病理診斷的首選檢查方法,但冷凍制片易出現冰晶,導致組織裂隙、細胞形態變化,嚴重影響冷凍制片快速診斷準確性[2]。因此減少冰晶形成是術中冷凍制片的重要質量保證。本實驗通過比較發現,與速動臺冷凍法相比,冷凍包埋儀及冷凍錘速凍法可有效減少冰晶的產生,并且包埋儀速凍法明顯縮短制片時間且制片質量明顯好于冷凍錘速凍法及速凍臺冷凍法,大大提高了制片質量及工作效率。
冰晶是緩慢冷凍過程中細胞內的水分子向細胞間疏松區域游離、聚集,然后凝結成冰。組織細胞內冰晶形成的區域無細胞結構,呈結晶樣或不規則空隙,周圍組織或細胞間隙擴大,組織結構呈不同程度破壞[3]。在冷凍切片冷凍的過程中形成冰晶主要有兩個原因:(1)冷凍速率慢導致細胞內的水分子向細胞間疏松區域游離、聚集,然后凝結成冰;(2)樣本周圍水溶液的組成成分。使用高度專業化快速冷凍系統或者高滲溶液能夠減少冰晶大小和密度[4]。蔗糖是一種化學惰性和親水性溶質,可以干擾冰結晶過程中的氫鍵形成,控制冷凍樣品的脆性[5]。將組織樣本經20%~30%的梯度蔗糖溶液脫水至組織沉底可減少冰晶形成。但是,其應用于腦組織脫水時仍可形成較多、較大的冰晶,制片效果并不十分理想[6]。不同的組織可能需要不同的蔗糖濃度來獲得相似的冷凍切片質量。另一方面,20%~30%蔗糖脫水法消耗時間通常需要12~24 h,而蔗糖濃度越高,溶液黏度越高,這可能會減慢樣品的滲透率,無法滿足術中快速病理診斷的需要。速凍可以阻止水分子游離,保持基質的勻質。組織冷凍速度決定了組織內冰晶形成的方式與數量[3]。
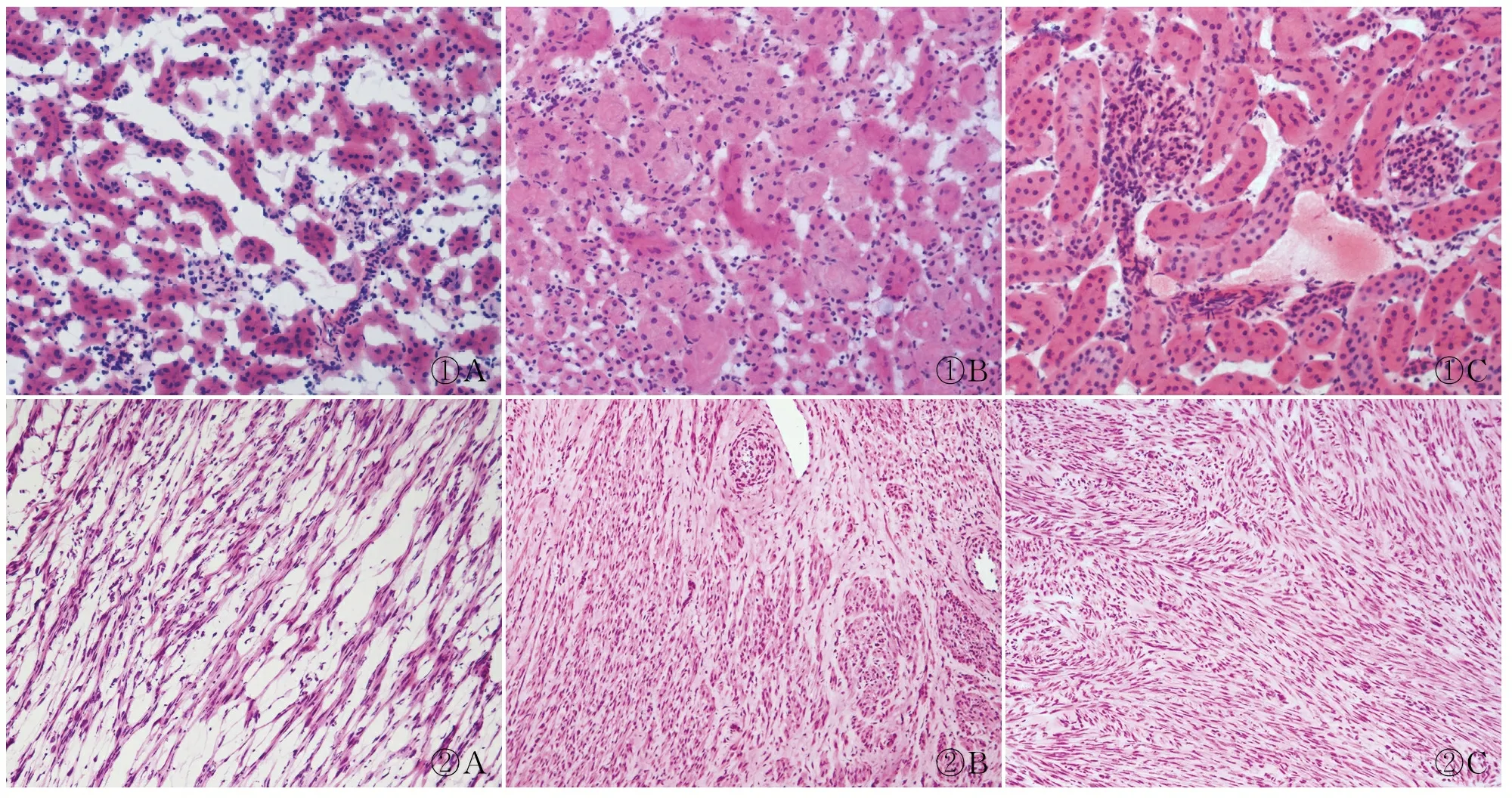
①A①B①C②A②B②C
圖1小鼠腎標本不同冷凍方式制片HE質量比較:A.速凍臺冷凍法;B.冷凍錘速凍法;C.包埋儀速凍法圖2人子宮肌瘤不同冷凍方式制片HE質量比較:A.速凍臺冷凍法;B.冷凍錘速凍法;C.包埋儀速凍法
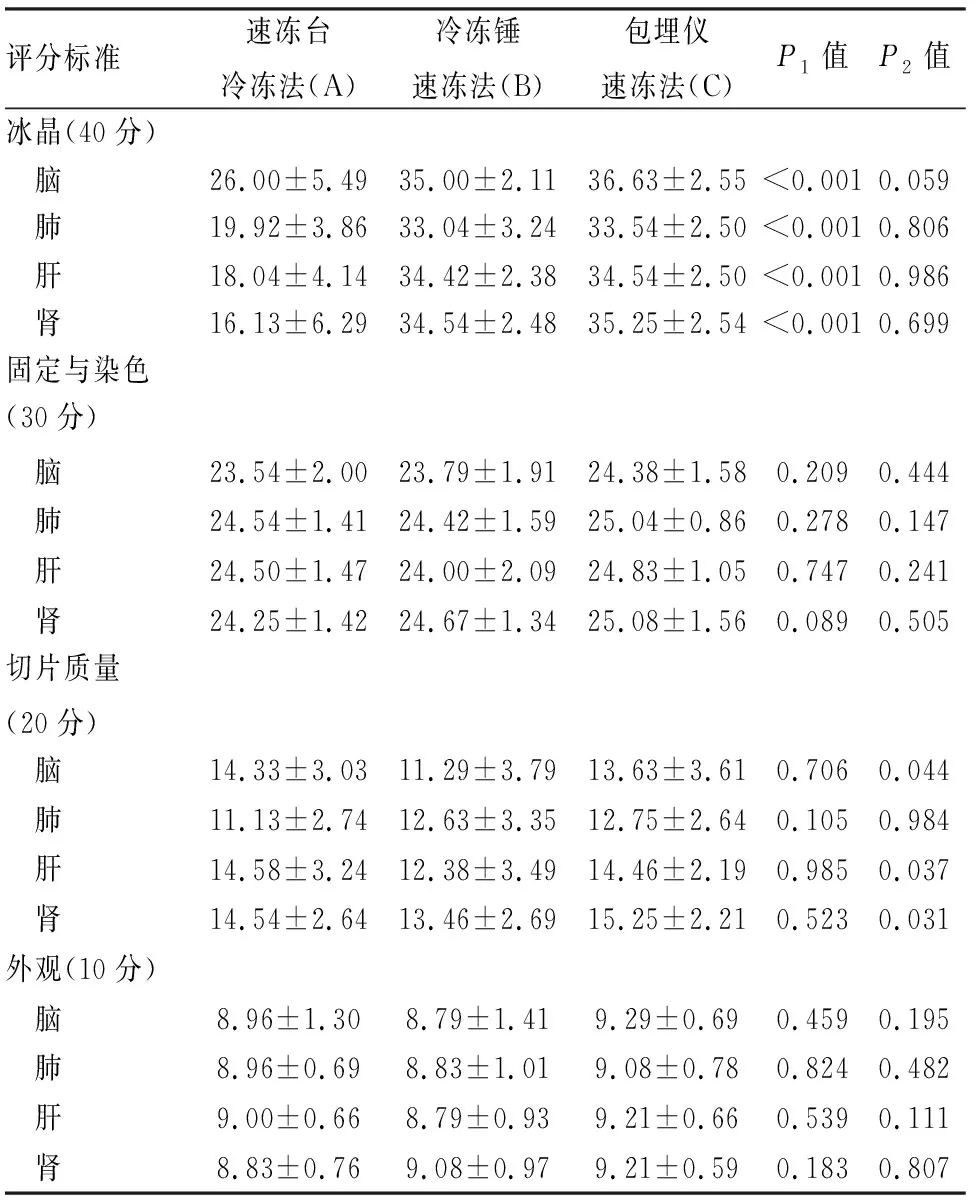
表3 不同冷凍方法下小鼠組織的制片評分(min±s)
P1:A組與C組比較;P2:B組與C組比較
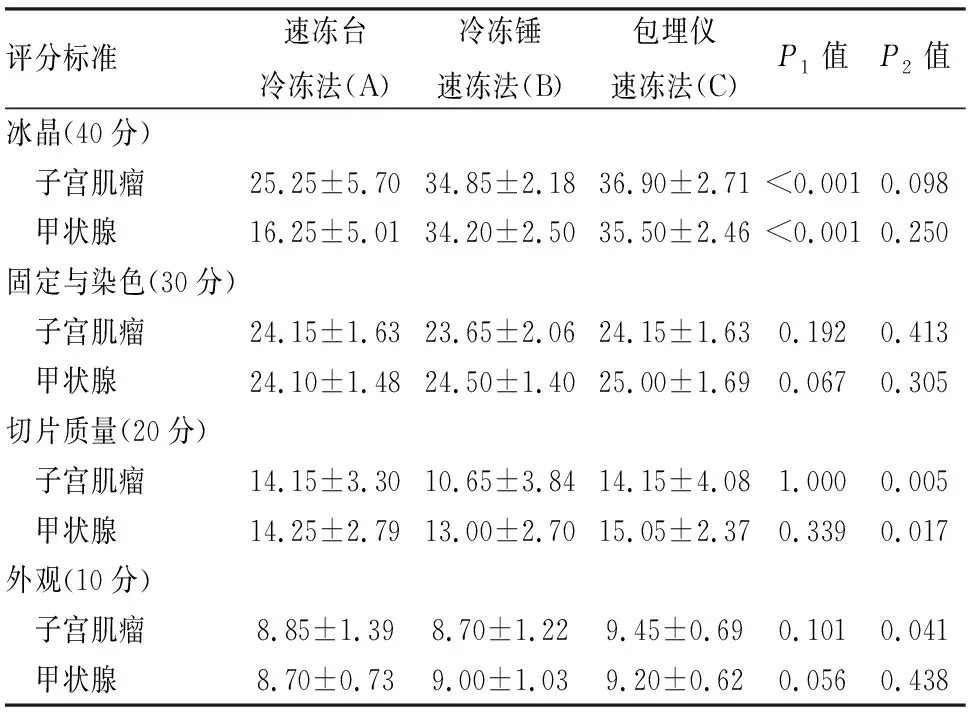
表4 不同冷凍方法下人組織的制片評分(min±s)
P1:A組與C組比較;P2:B組與C組比較
本科室使用的冷凍切片機箱內的溫度一般控制在-20 ℃~-25 ℃,組織在速凍臺冷凍的時間在5~8 min,冷凍速度緩慢,形成的冰晶較多;加上冷凍錘可使組織冷凍時間縮短至3~5 min,而Chaser冷凍包埋儀能在短時間內將箱室內的溫度降至-80 ℃,工作溫度一般設定為-40 ℃,可使組織在30 s內完成冷凍過程,快速越過冰晶形成期,極大地減少了冰晶的形成,其總制片時間比速凍臺冷凍法及冷凍錘速凍法縮短了近5 min。相對于使用超低溫的液氮冷凍法,冷凍包埋儀使用更安全,對操作人員沒有傷害。雖然冷凍錘速凍法與包埋儀速凍法在冰晶形成方面差異無顯著性,但是本實驗結果表明,包埋儀速凍法甲級片或者乙級片的數量明顯多于冷凍錘速凍法,主要表現在腦、肝、腎、子宮肌瘤及甲狀腺組織的切片質量優于冷凍錘速凍法,主要原因是冷凍錘的冷凍時間主要靠肉眼判別,存在一定主觀性差異,有可能在組織速凍的過程中過度冷凍,導致組織發脆,產生裂隙、皺褶及刀痕現象,影響了切片質量。而冷凍包埋儀具備定時功能,能夠統一控制速凍時間及膠量,當冷凍時間結束后會發出提示音提醒開始制片,避免導致冷凍過度產生脆裂現象。而肺組織結構疏松,切片難度較大,兩種速凍方法下的切片質量均較差,因此無明顯差異。
綜上所述,術中冷凍制片過程中,冷凍緩慢造成冰晶形成及組織裂隙產生對冷凍切片的質量及術中快速診斷的準確性有重要影響,而冷凍切片包埋儀能夠達到速凍要求,可以有效減少冰晶的含量,提高冷凍制片的質量及工作效率,能夠滿足術中快速診斷的需要,值得在冷凍制片過程中推廣使用。