經皮腔內支架植入術治療中心靜脈狹窄29例分析
郭輝 劉佳妮 張永裕 張慧濤 賀嘉男 甘海潤 趙逆 龐鵬飛
傳統意義上的中心靜脈,定義為鎖骨下靜脈、無名靜脈及上腔靜脈;近年來,下腔靜脈及髂靜脈亦被認為屬于中心靜脈的范疇[1]。中心靜脈狹窄(central venous stenosis,CVS)可由多種原因導致,例如臨近組織壓迫血管腔,腫瘤局部侵犯血管壁,以及長期留置透析管刺激血管內膜增生等。由于大多數CVS患者合并有其他基礎性疾病,臨床癥狀較為危重,而傳統開放式手術治療創傷較大,且易出現并發癥,因此,患者往往不適于行常規手術治療。近年來,隨著影像介入技術的發展,經皮血管腔內支架植入術(percutaneous transluminal stenting,PTS)為CVS的治療提供了新的選擇[1-2]。本研究回顧性分析2016年1月至2019年3月期間在我院行PTS治療的CVS患者29例臨床資料及其隨訪觀察資料,現總結如下。
資料與方法
一、臨床資料
本中心自2016年1月至2019年3月,共29例患者因CVS行PTS治療,其中男性16例,女性13例,年齡27~82歲(平均57.9±12.5歲)。所有患者均經CTA確診為中心靜脈狹窄或閉塞,包括:上腔靜脈及下腔靜脈病變各7例,鎖骨下靜脈病變5例,無名靜脈病變3例,髂靜脈病變7例。其中,合并惡性腫瘤患者12例、慢性腎功能衰竭(chronic renal failure,CRF)經自體動靜脈瘺行血液透析患者10例、Budd-Chiari綜合征2例、髂靜脈壓迫綜合征2例、髂靜脈血栓形成3例。患者均有不同程度的CVS相關癥狀,包括局部肢體及面頸部腫脹,伴有或不伴有頭昏頭痛、視物模糊以及呼吸困難等。CVS的診斷基于患者的臨床癥狀、體征及影像學檢查等。
二、治療方法
術 前 常 規 行 增 強CT( 德 國,Siemens,SOMATOM Definition Flash CT)檢查,以評估病變位置、范圍及狹窄程度,并測量病變段血管及其周圍正常血管直徑。
術中使用DSA儀器(荷蘭,Philips,UNIQ Clarity FD20C),全部患者均于局麻下經股靜脈或頸內靜脈入路,采用改良Seldinger技術于局麻下穿刺成功后植入超滑導絲及造影導管,將造影導管置于病變段管腔的遠心端或近心端,行血管造影檢查評估病變的程度及范圍,以指導術中支架的選擇。確定病變情況后,引入直徑8~14 mm球囊擴張導管對病變段管腔行腔內成形術(percutaneous transluminal angioplasty,PTA)逐級擴張;后植入直徑大于臨近正常靜脈約10%的血管內支架,包括E.Luminexx裸支架(美國,Bard)、Zilver裸支架(美國,COOK)、Fluency覆膜支架(美國,Bard)及Viabahn覆膜支架(美國,Gore)。依據病變位置、病變程度及其范圍決定支架的選擇,其中對于腔靜脈病變,一般采用直徑為14~20 mm裸支架;對于無名靜脈及髂靜脈,一般采用10~14 mm裸支架或覆膜支架;對于鎖骨下靜脈病變,一般采用直徑為8~10 mm裸支架或覆膜支架。
術后行血管造影觀察病變段管腔及其內血流通暢情況;若仍存在管腔狹窄,則再次行PTA治療,必要時再次植入血管內支架。
手術操作均在全身肝素化下進行。若患者無明確出血風險因素,術后住院期間采用低分子肝素鈉4 000單位Q12H規律抗凝治療;出院后建議術后3周采用利伐沙班 15 mg Bid規律抗凝,3周后采用20 mg Qd規律抗凝至少3個月;對于采用華法林規律抗凝患者,住院期間調整INR(國際標準化比值)于2.0~3.0,隨訪治療期間規律監測凝血功能并調整抗凝方案;另根據患者復查結果,以及有無合并出血風險及靜脈血栓風險因素,評估是否需要長期抗凝。
三、術后隨訪
術后觀察患者臨床癥狀有無緩解,并于術后第1個月、3個月、6個月行CTA檢查以評估病變段管腔狀況及支架內血流通暢情況。隨訪期間,如果再次出現CVS相關癥狀,并經影像學檢查證實后,行血管造影檢查以評估病變段血管情況,及進一步行PTA及PTS治療;如復查無異常,則每3個月行相關檢查以評估病變情況。
四、觀察指標
本研究的主要觀察指標為技術成功率和臨床有效率,次要觀察指標為手術相關并發癥發生率和術后狹窄率。技術成功定義為完成手術操作,并術后即刻復查造影示管腔狹窄率<30%(以臨近正常血管為參考);臨床有效定義為術后1周內,CVS相關臨床癥狀明顯緩解或消失;術后并發癥分為輕微并發癥及嚴重并發癥,其中靜脈破裂、支架移位至肺動脈或右心室、心包填塞均可導致災難性后果,被認為是嚴重并發癥[3-4];術后狹窄定義為隨訪期間再次出現CVS相關癥狀,并經影像學檢查證實的支架狹窄或閉塞。
五、統計方法
應用統計軟件SPSS 25.0對所得數據進行統計分析。PTS術后再狹窄及術后是否規律抗凝治療均為獨立二分類定性資料,因此,對于首次采用裸支架與首次采用覆膜支架行PTS治療術后一期通暢率的比較,采用Kaplan-Meier方法行統計分析,采用Log-rank檢驗進行比較;對于單例/次PTS術后再狹窄率的比較,以及術后是否規律抗凝治療的比較,采用χ2檢驗。P<0.05認為差異有統計學意義。
結 果
一、技術成功率及臨床有效率
29例患者均于局麻下成功實施PTS治療。其中,首次PTS治療采用裸支架23例,采用覆膜支架5例,采用裸支架聯合覆膜支架1例。術后隨訪3~38個月,中位隨訪時間14個月。隨訪期間,10例患者出現PTS術后支架再狹窄,并行再次手術干預,其中4例行PTA治療,4例患者行1次PTS治療,2例患者行2次PTS治療(見圖1)。
研究中,29例患者接受PTS治療共計36例/次,支架植入共計48枚,其中裸支架36枚,覆膜支架12枚。36例/次PTS治療中,包括裸支架植入25例/次,覆膜支架植入10例/次,裸支架聯合覆膜支架植入1例/次。PTS術后即刻復查血管造影顯示,除1例(惡性腫瘤合并上腔靜脈壓迫,予裸支架植入)術后管腔狹窄率仍大于30%,余患者均順利完成手術操作,技術成功率97.2%(35/36)。所有患者中,除2例患者于術后1周癥狀仍未見明顯改善(惡性腫瘤合并上腔靜脈壓迫1例、髂靜脈壓迫綜合征1例,均予裸支架植入),余患者均于術后1周內癥狀基本消失,臨床有效率約94.4%(34/36)。
所有患者術中及術后均未發生手術相關并發癥及死亡。
二、PTS術后再狹窄率
隨訪期間,1例患者(惡性腫瘤合并上腔靜脈壓迫,予裸支架植入)由于腫瘤進展過快導致多器官功能衰竭,于術后21 d死亡,因此不計入隨訪研究群體。首次PTS治療采用裸支架22例患者中,術后3個月、6個月、12個月的一期通暢率分別為72.73%、50%、45.45%;采用覆膜支架5例患者中,術后3個月、6個月、12個月的一期通暢率均為100%;Log-rank分析顯示兩組間PTS術后一期通暢率未見明顯差異(χ2=0.533,P=0.466) (見圖2)。
隨訪中,單例/次PTS術后總狹窄率約34.3%(12/35)。除外1例/次裸支架聯合覆膜支架PTS,裸支架PTS術后再狹窄率約45.8%(11/24),覆膜支架PTS術后再狹窄率約10.0%(1/10),其差異有統計學意義(χ2=3.852,P=0.046)。此外,合并CRF患者中,PTS術后再狹窄率約57.1%(8/14),而非CRF患者PTS術后再狹窄率為19.0%(4/21),其差異有統計學意義(χ2= 5.256,P=0.022)。
合并CRF患者中,單例/次裸支架PTS術后再狹窄率約77.8%(7/9),覆膜支架PTS術后再狹窄率約20.0%(1/5);雖然裸支架PTS術后再狹窄率較高,但其差異無統計學意義(χ2=4.069,P=0.060)。合并惡性腫瘤患者中,PTS術后再狹窄率約8.3%(1/12),其中裸支架PTS術后再狹窄率約11.1%(1/9),覆膜支架PTS術后再狹窄率約0%(0/3),其差異無統計學意義(χ2=0.333,P=0.750)。
三、術后抗凝治療與支架再狹窄
隨訪中,1例/次行裸支架聯合覆膜支架PTS患者,術后接受規律抗凝并未出現支架再狹窄。余34例/次行裸支架及覆膜支架PTS患者中,4例裸支架PTS術后患者未接受規律抗凝,余患者均接受規律抗凝,具體如下:
(1)裸支架PTS術后規律抗凝率為83.33%(20/24),覆膜支架PTS術后規律抗凝率為100%(10/10),二者未見明顯差異(χ2=1.889,P=0.169);
(2)未接受規律抗凝治療術后再狹窄率為100%(4/4),而接受規律抗凝治療患者PTS術后再狹窄率為26.67%(8/30),二者存在顯著差異(χ2=8.311,P=0.004);
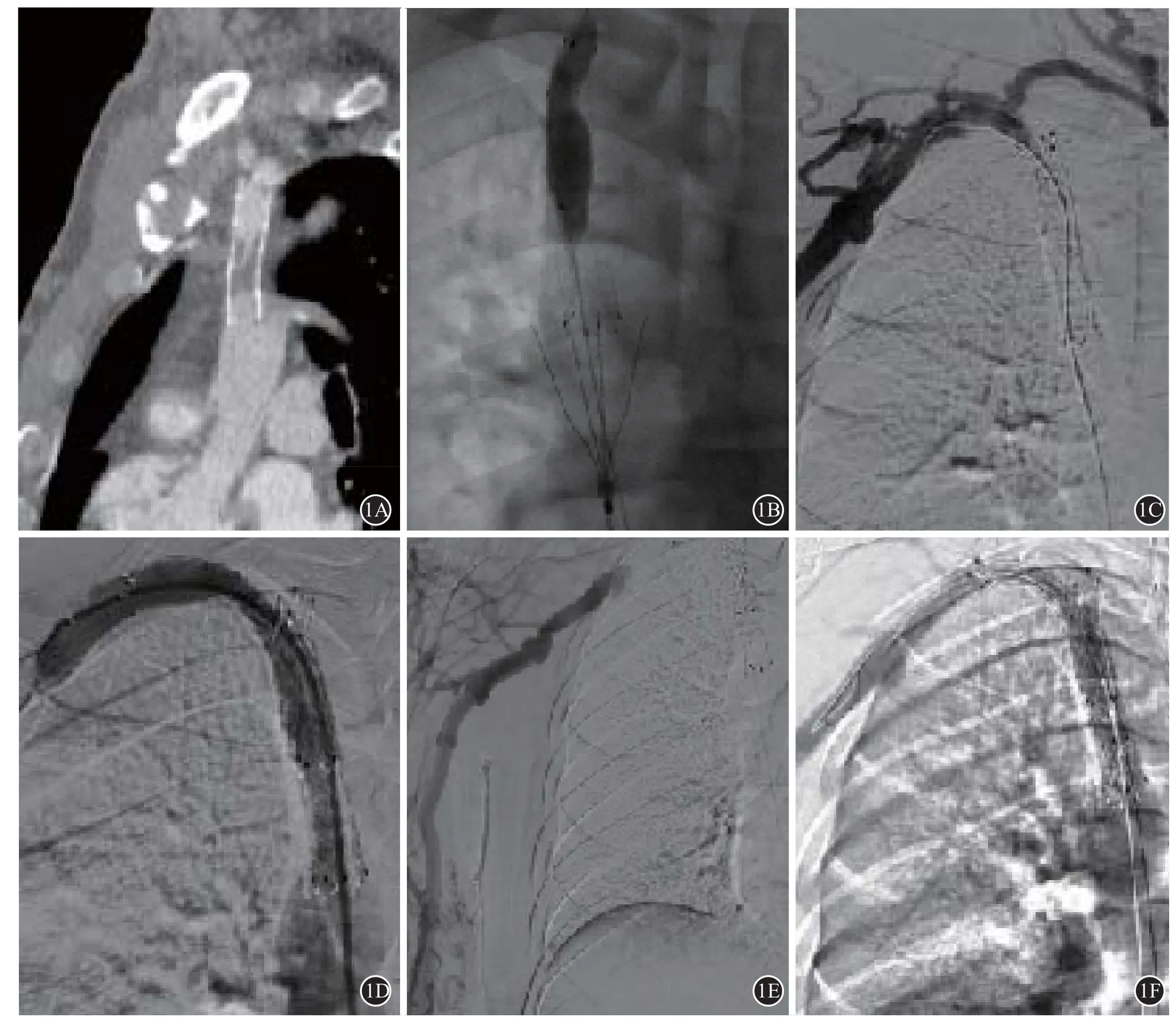
圖1 患者男性,53歲,因“上腔靜脈支架植入術后7月余,右上肢腫脹1周”入院;患者既往因慢性腎功能衰竭建立右上肢自體動靜脈瘺,行血液透析治療
(3)對于24例/次裸支架PTS術后患者中,接受規律抗凝治療患者PTS術后再狹窄率為35%(7/20),未接受規律抗凝治療術后再狹窄率為100%(4/4),二者存在顯著差異(χ2=5.673,P=0.017)。
討 論
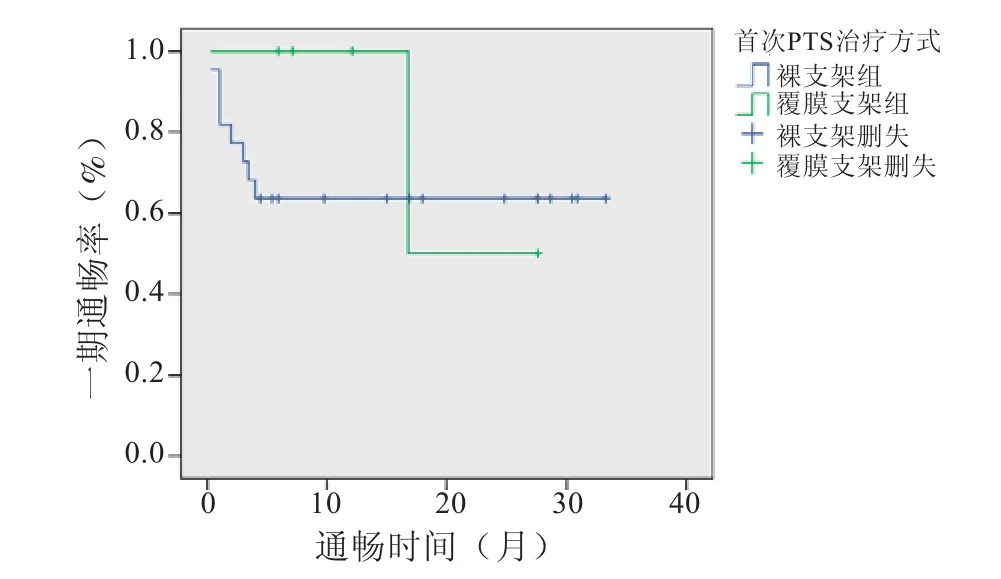
圖2 首次采用裸支架與覆膜支架行PTS治療CVS術后一期通暢率的比較
自1984年Charnsangavej C等[5]首次報道使用PTS治療上腔靜脈狹窄綜合癥,PTS治療方式日漸成為早期緩解CVS癥狀的一線治療方式,其創傷小及并發癥少的優勢,使該手段可廣泛應用于無手術指征的良惡性疾病所致CVS。文獻表明,對CVS患者行腔內支架植入術,其技術成功率為84.6%~100%,并發癥發病率為3%~37%,臨床有效率為78%~100%,支架術后狹窄率為0%~41%[6-8]。本研究中,支架植入技術成功率為97.2%,臨床有效率約為94.4%,并發癥發病率為0%,PTS術后狹窄率約為34.3%,這與既往研究結果相類似。
Haddad MM等[9]回顧分析56例CVS患者行腔內治療后的臨床隨訪,覆膜支架及裸支架植入術后狹窄率分別為17.9%和48.3%。Gwon DI等[8]研究后認為,對于合并腫瘤患者采用裸支架行PTS治療,術后隨訪雖然并未發現腫瘤組織侵入支架內,然而腫瘤壓迫導致支架狹窄的發生率約為70%;相比之下,采用覆膜支架行PTS治療的患者,支架狹窄率僅為5%,其術后遠期通暢率較高。在本研究中,相對于首次采用裸支架行PTS治療CVS,雖然采用覆膜支架行PTS術后一期通暢率未見明顯提高;然而對于單例/次PTS治療,采用覆膜支架行PTS治療,其術后狹窄率(10.0%)顯著低于裸支架PTS術后狹窄率(45.8%)。此外,對于惡性腫瘤患者而言,PTS僅僅是治療腫瘤壓迫所致 CVS的一種姑息性手段,術后進行有效的抗腫瘤治療是提高整體療效的重要手段。本研究中,1例上腔靜脈狹窄合并惡性腫瘤患者行PTS治療后,其臨床癥狀未能得到明顯緩解;同時,由于腫瘤進展過快導致多器官功能衰竭,于術后21 d死亡。
本組研究中,對于合并CRF接受血液透析的CVS患者,其PTS術后狹窄率約為57.1%,顯著高于非CRF患者(19.0%)。國內學者[10]提出,對于透析通路中心靜脈狹窄的治療首選單純PTA,當出現PTA抵抗或頻繁復發時,可以考慮PTS。然而,Chang CJ等[11]認為透析通路中心靜脈狹窄患者行PTA治療后,相對于未行腔內治療的病變段血管,接受腔內治療的病變段血管內膜細胞增殖更為活躍,其管腔再發狹窄也更為明顯;基于此,推薦采用覆膜支架對合并CRF的CVS患者行PTS治療。目前,對于合并CRF接受血液透析的CVS患者,如何在裸支架與覆膜支架之間進行選擇,尚存爭議[12]。本研究中,雖然對于合并CRF患者采用覆膜支架行PTS治療的術后狹窄率較低,但其差異并無統計學意義;考慮到本組研究病例數較少,其療效評定仍需進一步探究。
相比于裸支架,盡管覆膜支架具有一定的優勢,但其術后移位可導致嚴重甚至致命的并發癥[13-14];雖然覆膜支架兩端的裸區可以減少支架移位造成的影響,但是為了減少支架移位的發生,使用支架的尺寸一般建議大于病變段血管直徑的10%~20%[15]。
此外,術后規律抗凝治療亦很重要,尤其對于血栓性疾病患者。本研究中,4例PTS術后未接受規律抗凝治療患者均發生支架再狹窄,其中3例患者術后采用華法林抗凝,在隨訪期間未規律監測凝血功能及調整抗凝方案。作為傳統的口服抗凝治療藥物,華法林的應用十分廣泛,然而華法林治療效果的個體化差異比較明顯,需要規律監測凝血功能并據此調整抗凝方案。尤其需要注意的是,70%華法林抗凝治療患者在出院前INR的控制都不理想,如果在后期隨訪中未能規律監測凝血功能并及時調整抗凝方案,將會增加血栓及出血風險[16]。
本研究中存在下列不足之處:(1)本研究為回顧性而非前瞻性研究,研究結果有一定偏倚;(2)研究中病例樣本量較小;(3)本組病例中,術中未測量病變血管遠端的治療前及治療后靜脈壓力,亦未能對治療前后靜脈壓力變化進行觀察,然而治療前后局部壓力變化對PTS治療效果評估及術后通暢率有一定影響,期待日后進一步研究。
綜上所述,對于良惡性疾病所致CVS,PTS不失為一種微創有效的治療方法;相比之下,采用覆膜支架行PTS治療可以取得更好的治療效果。然而,對于不同疾病所引起的CVS及PTS術后支架狹窄,其疾病本身的復雜性需要多學科聯合制定治療方案。此外,PTS術后的規律隨訪監測及接受抗凝尤為重要。

