木芙蓉葉黃酮成分抗氧化及月周期規律研究
程 鵬,鄔 潔,何先元,*,李昕燃,楊 鴻,黃英如
1重慶醫科大學實驗管理中心;2重慶醫科大學中醫藥學院,重慶 401331;3云南中醫藥大學,昆明650504
木芙蓉葉是2015年版藥典新增收載的藥物,為錦葵科植物木芙蓉HibiscusmutabilisL.的干燥葉[1]。夏、秋二季采收,干燥,防蟲、低溫儲藏。味辛,性平;歸肺、肝經。具有涼血,解毒,消腫,止痛的功效。臨床用于治療癰疽焮腫,纏身蛇丹,燙傷,目赤腫痛,跌打損傷等病癥。含量照高效液相色譜法測定,按干燥品計算,含無水蘆丁(C27H30O16)不得少于0.070%。大多數黃酮類化合物均有較強的抗氧化自由基的作用,中藥的一些藥理活性也往往與其抗氧化自由基相關。木芙蓉葉中含有蘆丁等多種黃酮類化合物[2-5],本實驗以蘆丁為主要指標,測定一年內不同月份采收木芙蓉葉的總黃酮含量變化規律,并檢測木芙蓉葉總黃酮體外抗氧化活性,采用超高效液相色譜法測定一年內不同月份采收的木芙蓉葉4種黃酮成分含量變化規律,分析黃酮成分與抗氧化活性之間的相關性,以探討木芙蓉葉黃酮組分-成分-效應之間聯系,為評價木芙蓉葉藥材質量和進一步開發利用木芙蓉葉提供理論依據。
1 材料與試劑
1.1 儀器
紫外-可見分光光度計(UV-1200型,上海美普達儀器有限公司)、超聲清洗儀(批號:15C4649,寧波新芝生物科技股份有限公司)、電熱恒溫水浴鍋(批號:O803141,上海躍進器械醫療有限公司)、TD5A-WS臺式低速離心機(批號:5110080098,長沙湘離心機儀器有限公司)、PH計(編號17103029,成都世紀方舟科技有限公司)、電子天平(型號:FA2004,上海舜宇恒平儀器有限公司)、電熱恒溫鼓風干燥箱(型號:DGG-9240B,上海森信實驗儀器有限公司)、分子生物型超純水機(型號:STS18-0321-012,重慶市安特生環保設備有限公司)、UFLC超快速高效液相色譜儀(島津)、色譜柱C18色譜柱(批號:V3250001,上海安普公司)、移液槍(型號:YE4A178905)。
1.2 試劑
蘆丁(C27H30O16,HPLC≧98%,批號:R106912)、金絲桃苷(C21H20O12,HPLC≧98%,批號:18111901)、槲皮苷(C21H20O11,HPLC≧98%,批號:19031304)、PTIO(C13H17N2O2,HPLC≧98%,P838429)、DPPH(C18H12N5O6,HPLC≧98%,D141336)、抗壞血酸(C6H8O6,HPLC≧98%,A103537)、ABTS(C18H24N6O6S4,HPLC≧98%,批號:A109612),以上標準品均購自重慶奧怡生物技術有限公司。槲皮素(C15H10O7,HPLC≧98%,批號19032803),成都普菲德生物技術有限公司,硫酸、磷酸鈉、鉬酸銨、過硫酸鉀、無水乙醇、甲醇、乙腈、磷酸二氫鉀、磷酸氫二鉀均為分析純。
1.3 材料
木芙蓉葉每月15日采自重慶醫科大學植物園,陰干備用,經重慶醫科大學費曜副教授鑒定為錦葵科植物木芙蓉HibiscusmutabilisLinn的葉。
2 實驗方法
2.1 木芙蓉葉總黃酮測定
2.1.1 樣品總黃酮提取
參考以最佳提取工藝[2],稱取木芙蓉粗粉約3 g,置于250 mL的錐形瓶中,加入99 mL的46%乙醇溶液,在60 ℃,功率100 W條件下超聲提取2次每次34 min。濾過,合并濾液,低溫保存,備用。
2.1.2 蘆丁標準曲線標準曲線
精密稱取蘆丁5.40 mg,用50%的乙醇溶解后,定容于50 mL容量瓶中,配制為質量濃度為1.08 mg/mL的蘆丁標準品溶液。分別取該溶液0、1、2、3、4、5 mL,置于10 mL容量瓶。各組依次加入0.5% NaNO20.3 mL,混勻,放置6 min;再加入10% AlCl30.3 mL,搖勻,放置6 min;最后加入1 mol/L NaOH 4 mL,并以50%乙醇定容至刻度線,搖勻,放置15 min。用紫外-可見分光光度計測定吸光度(檢測波長510 nm)。y=0.086 1x+0.001 4。R2=0.999 8(x為吸光度,y為濃度單位mg/mL)。
不同月份采收木芙蓉葉的總黃酮提取液按上述方法,分別測定其總黃酮濃度,并記錄C,然后將總黃酮提取液配制為300 μg/mL的母液,備用。
2.2 抗氧化活性測定
2.2.1 維生素C的標準液配置
精密稱取Vc標準品16.4 mg,用50%的乙醇溶液溶解并定容于50 mL容量瓶中,作為母液備用。
2.2.2 抗氧化性活性實驗
依據酸性介質中,還原劑存在的條件下,正磷酸根離子與鉬酸銨形成藍色絡合物,在700 nm有較強的紫外吸收,且吸光度值大小與還原能力即抗氧化的能力成正比的原理。
分別精密移取各樣品母液和Vc標準品溶液1 mL于試管中,(依照設置的濃度梯度20、40、60、80、100、150、200、250 μg/mL加樣),以50%乙醇溶液作空白。依次加入0.6 mol/L硫酸溶液1mL,28 mmol/L磷酸鈉溶液1.5 mL,4 mmol/L鉬酸銨溶液1.5 mL,蒸餾水1 mL,搖勻后,于95 ℃水浴90 min,取出極速冷卻后,用紫外-可見分光光度計在波長695 nm處測定吸光度并記錄A。每組實驗重復3次,取平均值。采用同法制備相同濃度梯度的 Vc 做對比試驗,下同。
2.2.3 DPPH實驗
DPPH在有機溶劑中是一種穩定的自由基,在自由基清除劑存在的條件下DPPH中氮原子上的單電子被捕獲,溶液顏色變淺。在517 nm處測定吸光度,計算樣品自由基清除率。
分別精密移取各月份樣品母液和Vc標準品母液各2 mL后(依照設置的濃度梯度4、8、20、40、60、100、150 μg/mL加樣),再加入2 mL DPPH作為實驗組,每組重復實驗3次。避光放置30 min,在紫外517 nm波長條件下測吸光度A,用2.0 mL的50%乙醇溶液+2.0 mL DPPH作為空白對照A1;2.0 mL無水乙醇+2.0 mL樣品溶液作樣品對照A0。
DPPH自由基清除率=(1-(A-A0)/A1)× 100%
2.2.4 ABTS實驗
ABTS在氧化劑存在時被氧化成綠色,抗氧化物存在時則被抑制,在414或734 nm波長處測定吸光度,可計算總抗氧化能力。吸光度大小與還原能力即抗氧化的能力成反比。
ABTS粉末用蒸餾水溶解成濃度為7 mmol/L的試液,再與濃度為140 mmol/L的過硫酸鉀按比例混合,室溫,避光靜置過夜,使用時用無水乙醇稀釋成工作液(要求在734波長下吸光度在0.68~0.72范圍,實際稀釋了約100倍)。
參考文獻方法,分別精密移取各月份樣品母液和Vc標準品溶液0.4 mL后(依照設置的濃度梯度4、8、10、20、40、80、100、150 μg/mL加樣),再加入3.6 mL ABTS工作液作為實驗組,每組重復實驗三次。加入后振搖使混合均勻,靜置6 min,在波長734 nm處測吸光度,記為A。另外設置樣品對照組以0.4 mL樣品溶液+3.6 mL無水乙醇(2組),吸光度記為A0;空白對照3.6 mL ABTS工作液+0.4 mL 50%的乙醇溶液(3組)吸光度記為A1,其余操作與實驗組同。
ABTS自由基清除率=(1-(A-A0)/A1)× 100%
2.2.5 PTIO實驗
PTIO在甲醇和水溶液中是一種穩定的自由基,在自由基清除劑存在的條件下PTIO上的單電子被捕獲,溶液顏色變淺。在557 nm處測定吸光度,可以計算樣品自由基清除率。
分別精密移取各月份樣品母液和VC標準品溶液1 mL后(依照設置的濃度梯度10、40、60、100、200、250、300 μg/mL加樣),再加入2 mL PTIO作為實驗組,每組重復實驗3次。37 ℃水浴并避光反應3 h,在557 nm測吸光度A。用1.0 mL的50%乙醇溶液+2.0 mL DPPH作為空白對照A1;2.0 mL無水乙醇+1.0 mL樣品溶液作樣品對照A0。
PTIO自由基清除率=(1-(A-A0)/A1)×100%
2.3 UFLC法測定木芙蓉葉黃酮成分
2.3.1 混合標準品和樣品的配制
精密移取2.1.1項下各月份木芙蓉葉總黃酮母液300 μg/mL作為供試品溶液。
綜合前人研究結果,選取極性分布均勻的蘆丁、金絲桃苷、槲皮苷、槲皮素等4個成分作為標準品,分別精密稱取蘆丁8.18 mg、金絲桃苷7.26 mg、槲皮苷7.15 mg、槲皮素8.09 mg,50%乙醇為溶劑定容于50 mL容量瓶中,配制濃度為163.6、145.2、143、155.6 μg/mL。
2.3.2 標準曲線繪制
以50%乙醇溶液為空白對照,“2.3.1”項下的混合標準品溶液以0.1%的冰醋酸溶液-乙腈為流動相,C18柱為固定相,流速1 mL/min,柱溫25 ℃,檢測波長370 nm,按照優化的濃度梯度(表1)。進樣0、1、2、4、8、15、20 μL,每個體積重復進樣2次。記錄各標準品濃度對應的平均峰面積值,計算含量。

表1 LC時間程序
2.3.3 木芙蓉葉總黃酮樣品成分分析
不同月份采收的供試品溶液經微孔濾膜過濾后,進樣20 μL,參照2.3.2項下的分析方法進行成分分離,每個供試品溶液重復進樣一次。記錄不同月份采收供試品中標準品對應的峰面積值,通過標準曲線計算各成分的含量。
3 結果與分析
3.1 4~11月木芙蓉葉總黃酮含量測定結果
分光光度法測定4~11月木芙蓉葉總黃酮含量變化趨勢如圖1,8月份總黃酮含量最高,4月份次之,11月份最低。總體趨勢高-低-高-低-高-低。11月份葉片接近枯黃脫落,總黃酮含量下降速度最快。
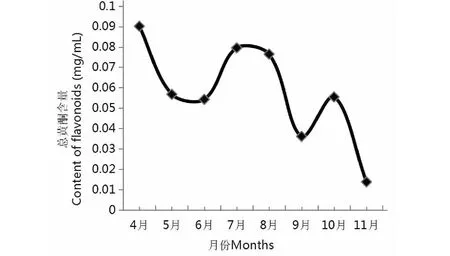
圖1 4~11月木芙蓉葉總黃酮含量變化趨勢
3.2 木芙蓉葉總黃酮抗氧化結果
3.2.1 木芙蓉葉總黃酮抗氧化性活性結果
根據抗氧化力測定的基本原理,從圖2可以看出,每個月木芙蓉葉總黃酮抗氧化性活性,隨著濃度的增加而增加,但與對照品Vc相比,提高幅度不大,特別是在高濃度條件下,更是明顯。

圖2 不同月份不同濃度木芙蓉葉總黃酮抗氧化性變化趨勢

圖3 4~11月木芙蓉葉總黃酮抗氧化性變化趨勢
從圖3來看,總黃酮抗氧化活性4月份最低,5和6月份上升,7、8月份下降,9月份升高,10、11月份下降,總體呈現出雙“S”曲線,與植物生長大周期基本一致,可以推測,木芙蓉葉總黃酮抗氧化活性物質與生長代謝物質變化相關。
3.2.2 木芙蓉葉總黃酮對DPPH自由基的清除能力
以8月份木芙蓉葉總黃酮與對照品Vc對比研究,木芙蓉葉總黃酮對DPPH自由基的清除能力,從圖4可以看出,其清除能力隨濃度增高而增強,濃度60 μg/mL以后增速減緩。以濃度100 μg/mL,測定4~11月木芙蓉葉總黃酮對DPPH自由基的清除能力,結果如圖5所示,4月份和10月份較強,7月份和11月份較弱,呈現出一個弱“S”曲線。

圖4 木芙蓉葉總黃酮對DPPH自由基的清除能力
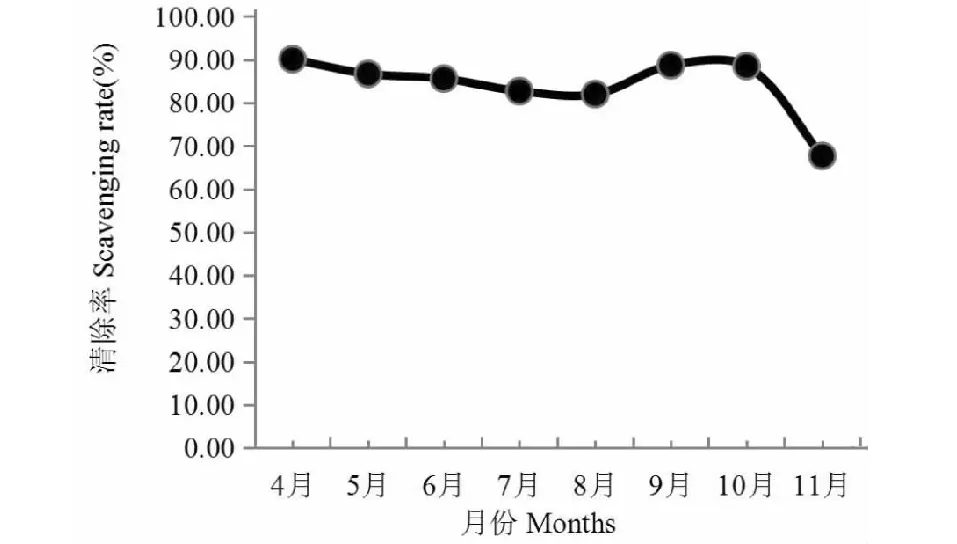
圖5 4~11月木芙蓉葉總黃酮對DPPH自由基的清除能力
3.2.3 木芙蓉葉總黃酮對ABTS自由基的清除能力
從圖6可以看出,木芙蓉葉總黃酮對ABTS自由基的清除能力隨濃度增大而增強,濃度在80 μg/mL以后增長緩慢,幾乎接近對照品Vc的強度了。選取濃度150 μg/mL,測定4~11月木芙蓉葉總黃酮對ABTS自由基的清除能力,結果如圖7,4月和9月較弱,6月和11月較強,也呈現出一個“S”曲線。

圖6 木芙蓉葉總黃酮對ABTS自由基的清除能力

圖7 4~11月木芙蓉葉總黃酮對ABTS自由基的清除能力
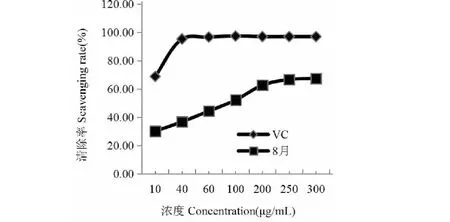
圖8 木芙蓉葉總黃酮對PTIO自由基的清除能力
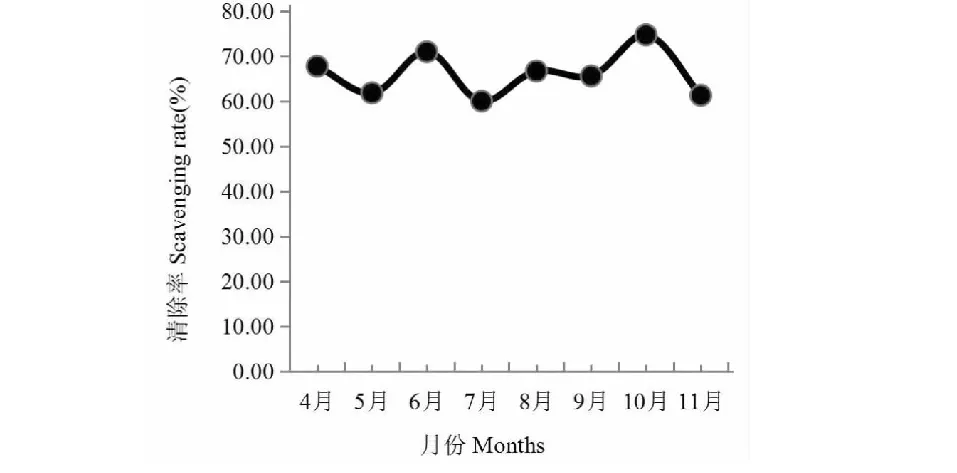
圖9 4~11月木芙蓉葉總黃酮對PTIO自由基的清除能力
3.2.4 木芙蓉葉總黃酮對PTIO自由基的清除能力
從圖8可以看出,木芙蓉葉總黃酮對ABTS自由基的清除能力隨濃度增大而緩慢增強。以濃度為300 μg/mL,測定4~11月對ABTS自由基的清除能力,結果如圖9,4、6、8、10月較強,5、7、9、11月較弱,基本呈現的是強-弱交替變化的趨勢。
3.3 UFLC法測定木芙蓉葉4種黃酮成分含量
3.3.1 標準曲線繪制
根據2.3.2項下記錄的各標準品濃度對應的平均峰面積值結果,以峰面積作為橫坐標x,標準品濃度作為縱坐標y,制作標準曲線并計算峰面積和標準品含量的相關性,結果如表2。

表2 4種黃酮成分對照品標準曲線
3.3.2 UFLC法測定4種黃酮類物質成分4~11月變化趨勢
UFLC法測定木芙蓉葉4種黃酮物質,從圖10可以看到,總體來看,金絲桃苷含量最高,金絲桃苷含量在木芙蓉葉生長周期內呈現出高-低-高-低變化趨勢,其中7月和11月含量急劇下降。蘆丁含量變化總體比較平緩,11月含量下降較快。槲皮苷含量5月最高,11月最低,總體呈現出“S”形變化趨勢。槲皮素含量4~5月增長平緩,以后下降,9月增高,11月最高,呈現出與其他3個組分物質不一致的變化趨勢。

圖10 4種黃酮成分含量4~11月變化趨勢
3.3.3 總黃酮及4種黃酮類物質與抗氧化性相關比較結果
將總黃酮及4種黃酮類物質4~11月含量變化趨勢與不同檢測方法的抗氧化性活性進行相關性分析,結果見表3。總黃酮、蘆丁和金絲桃苷含量與總抗氧化性呈負相關。總黃酮、蘆丁、金絲桃苷和槲皮苷含量與DPPH自由基清除率呈正相關,槲皮素與DPPH自由基清除率呈負相關。金絲桃苷、槲皮苷和槲皮素與ABTS自由基清除率呈正相關,蘆丁與ABTS自由基清除率呈負相關。蘆丁、金絲桃苷和槲皮苷與PTIO自由基清除率呈正相關,槲皮素與PTIO自由基清除率呈負相關。總體來看,總黃酮和蘆丁與4種檢測抗氧化活性趨勢基本一致,槲皮苷與4種檢測抗氧化活性均呈現正相關,說明木芙蓉葉中槲皮苷組分抗氧化作用明顯。因此,在研究黃酮類物質抗氧化性活性時,不能以一種檢測方法來確定其強弱,而是要綜合考慮。

表3 黃酮類物質與抗氧化性相關系數
4 討論與結論
木芙蓉葉總黃酮含量8月份最高,11月份最低,黃酮成分蘆丁含量10月份最高,11月份最低,金絲桃苷含量6月份最高,11月份最低、槲皮苷含量5月份最高,11月份最低、槲皮素含量4月份最高,8月份最低。總抗氧化活性9月份最強,DPPH自由基清除率10月份最強,ABTS自由基的清除能力6月份最強,PTIO自由基的清除能力10月份最強。蘆丁每個月含量變化起伏不大,結合抗氧化活性強弱,木芙蓉葉中蘆丁成分可以作為藥效評價和木芙蓉葉藥材質量的指標。同時本研究進一步說明現階段中藥藥效研究主要成分的合理性,中藥材采收期影響成分含量及其藥效,中藥的藥效是多組分綜合效應協同作用的結果,為中藥藥效研究需要提高成分分離技術,多成分檢測技術提供了理論依據。

