金花葵多糖的分離純化及抗氧化活性的研究
魏青 趙佳 殷秀萍
摘 要:為了比較金花葵的莖、葉、花不同部位的多糖含量及其抗氧化能力的強弱,采用熱水浸提法對金花葵莖、葉和花不同部位的粗多糖進行提取,采取Sevag法以及D101大孔吸附樹脂進行脫蛋白處理、脫色處理,過DEAE-52纖維素柱對金花葵多糖進行進一步的純化,通過苯酚-硫酸試驗比較金花葵莖、葉、花不同部位多糖的含量并通過對DPPH自由基的清除作用評價其抗氧化能力。結果顯示:金花葵多糖不同部位的提取率分別為花8.01%、莖2.89%、葉1.5%,對DPPH自由基清除率分別為花10.20%、葉8.10%、莖4.7%,發現金花葵中花的多糖含量最高,莖次之,葉最少。花多糖的抗氧化能力最強,莖多糖的抗氧化能力低于葉多糖抗氧化能力。研究表明,金花葵不同部位的多糖含量及抗氧化活性均差異明顯,其中花的多糖含量以及抗氧化活性最強,具有更高的價值,是一種具有開發潛力的天然資源。
關鍵詞:金花葵多糖;提取純化;抗氧化
中圖分類號:S-3 ? ? ? 文獻標識碼:A
DOI:10.19754/j.nyyjs.20200530005
前言
金花葵(Hibiscus manihot L.),錦葵科秋葵屬植物,為一年生草本植物。金花葵對生長條件要求不嚴,其適應性比較強,因此原料易得。目前,已經鑒別出金花葵種子中含有生物堿[1],金花葵花中含有2種黃酮類化合物[2],金花葵莖中含有可溶性多糖[3]。植物性多糖具有很多重要的生物活性,如抗氧化、抗輻射、抗腫瘤等[4]作用,其中最重要的生物活性是抗氧化,植物性多糖可以有效抵抗氧化應激導致細胞或組織損傷所引起的疾病。因此,借助各種技術手段從金花葵不同部位中提取多糖并比較其含量已然成為目前的研究熱點。
多糖是具有生物學活性的高分子化合物之一,在動物、植物體內以及微生物的細胞壁中都有分布,是維持生命活動正常運轉的基本物質之一。多糖在生物體內不僅是作為一種能源物質,還是一類重要的信息分子[13]。目前人們已成功地從近百種植物中提取出多糖,植物多糖相比于動物多糖或微生物多糖在自由基上更具有一定的抗氧化活性[7]。黃杰濤等[8]以金花葵的莖葉為原料,用水提法對其多糖成分進行提取,表明在最佳提取工藝條件多糖得率為4.30%。巫玲麗[5]等人在前人的基礎上通過單因素正交優化從金花葵花中提取的粗多糖得率為22.23%,提取的多糖具有較強的抗氧化活性,并表明該提取工藝可以在多糖的提取和開發利用中應用。程麗敏[6]等人從金花葵莖中提取可溶性糖,經過DEAE-52纖維素陰離子交換柱層析后分離出了酸性糖和中性糖組分,經SephadexG-100鑒定為較單一的組分(糖含量>70%),氣相結果顯示中性糖組分由4種單糖組成,酸性糖由5種單糖組成。紅外結果進一步驗證酸性糖中有較明顯的糖醛酸和硫酸根的吸收峰,可以作為潛在的抗氧化劑。
目前對金花葵多糖的研究只集中于一種材料,對其不同部位的多糖含量做進一步的比較少見報道。因此,本研究通過對金花葵莖、葉、花3個部位多糖的提純及抗氧化活性[9]進行對比,從而得出金花葵多糖最適合提取的部位。
1 材料與方法
1.1 試驗材料與儀器
金花葵材料于2016年8月采自棗莊學院生物園地,樣品于60℃恒溫烘干,放置于冰箱貯存備用。所使用儀器主要有LK-2000A搖擺式高速中藥粉碎機、電熱恒溫鼓風干燥箱、HH-S2型數顯恒溫水浴鍋、科生牌醫用超聲波清洗機、Anke TGL-16G型臺式離心機、RE52CS-2型旋轉蒸發儀、SHZ-D循環水式真空泵、UV-2000型紫外可見分光光度計、SZ-1快速混勻器、HL-2S恒流泵、Φ1.6cm×50cm層析柱、SBS-100型自動部分收集器、44-3500半透膜透析袋。使用的試劑主要有EDTA(AR)、DEAE-52纖維素、D101吸附樹脂、苯酚、硫酸(AR&GR)、鹽酸、葡萄糖、丙酮、甲醇、無水乙醇、正丁醇、氯仿、氫氧化鈉。
1.2 原料的預處理
1.2.1 金花葵不同部位材料的粉碎
1.2.1.1 莖
待金花葵成熟季節選取材料,用蒸餾水洗干凈后,45℃烘4h,機械粉碎后過40目篩,制成金花葵莖粗粉,保存備用。
1.2.1.2 葉
8月中旬采摘新鮮中部葉片,蒸餾水洗干凈后45℃烘干24h后,機械粉碎后過40目篩,制成金花葵葉粗粉,保存備用。
1.2.1.3 花
成品花,機械粉碎過40目篩,制成金花葵花粗粉,保存備用。
1.2.2 脫單糖
分別稱取稱取莖、葉、花各10.00g,并以3倍量的95%乙醇(v/m)為溶劑,回流脫單糖3次,每次2h,過濾,濾干揮發乙醇,稱重分別為莖8.72g、葉8.70g、花8.02g。
1.3 金花葵不同部位多糖的提純
按照固液比1∶35,添加脫單糖后的材料和去離子水,置于錐形瓶中,95℃水浴3h離心,取上清液進行濃縮。濃縮后莖50mL、葉100mL、花85mL。按照提取液與無水乙醇1∶4,置于500mL燒杯中進行過夜沉淀。然后置于干燥箱內60℃條件下干燥4h。稱重莖0.68g、葉1.75g、花1.39g。將干燥后的材料制成溶液,超聲波水浴2h后,置于冰箱中過夜,使其徹底溶解。
1.3.1 粗多糖中蛋白質的去除
將粗多糖溶液與Sevag試劑[12](氯仿∶正丁醇=4∶1)按照1∶1比例混合后,置于錐形瓶內低速搖床30min,置于分液漏斗中靜置20min后,取下層氯仿及中間的泡沫狀變性蛋白質,重復5次直至沒有變性蛋白質的出現為止。此時莖95mL、葉154mL、花104mL。然后用3倍體積的無水乙醇醇析沉淀,收集沉淀,干燥5h稱重,莖0.31g、葉1.51g、花0.66g。之后用蒸餾水進行過夜溶解,此時采用較大的多糖溶液稀釋倍數。
1.3.2 粗多糖中色素的去除
用2倍體積的95%乙醇將大孔吸附樹脂浸泡過夜,處理數次,取少量的處理液滴入蒸餾水中無混濁為止,將樹脂浸泡于蒸餾水中備用。將預處理后的大孔吸附樹脂,按照25mL多糖溶液加1.00g大孔吸附樹脂的比例進行操作,在磁力攪拌器下吸附1h,然后過濾,去樹脂,對濾液進行濃縮。此時莖145mL、葉168mL、花111mL。
1.3.3 粗多糖中小分子雜質的去除
透析袋剪成適當長度,放置于EDTA溶液中沸水煮10min,之后用蒸餾水沖洗透析袋多次。將多糖溶液轉入蒸餾水洗凈的透析袋中,磁力攪拌下透析24h,每8h換1次水。透析后體積分別為莖158mL、葉182mL、花121mL。
1.3.4 金花葵多糖的純化
本試驗選用DEAE-52型離子交換纖維素作為柱體填料[13],采用Φ1.6cm×50cm層析柱,有效柱長28cm,進樣體積為2mL。依次采用0.05M、0.1M、0.25M、0.5M、0.75M、1.0M的NaCl溶液梯度洗脫,用恒流泵保持流速為0.5mL/min,洗出液每10min收集1管,進行苯酚-硫酸檢測,以洗出液管數為橫坐標,吸光度為縱坐標,制作洗脫曲線。
1.4 金花葵不同部位多糖的含量比較
采用苯酚硫酸法進行金花葵中多糖含量的鑒定。多糖在濃硫酸的作用下先水解成單糖,并迅速脫水生成糖醛衍生物,然后與苯酚生成橙黃色化合物,在490nm處有穩定的最大吸收峰。準確量取1.0mL的金花葵多糖溶液,添加到10mL具塞試管中,依次加入0.5mL苯酚、2.0mL的硫酸溶液,混合均勻后,待反應30min后測其吸光度,將數據帶入標曲計算出濃度C(ug/mL)。
2 結果與分析
2.1 葡萄糖標準曲線
葡萄糖在濃度為16~72μg/mL范圍內呈直線關系,如圖1所示。以最小二乘法計算,其回歸方程為:y=0.006x-0.0288,相關系數R2=0.9957具有顯著相關性。
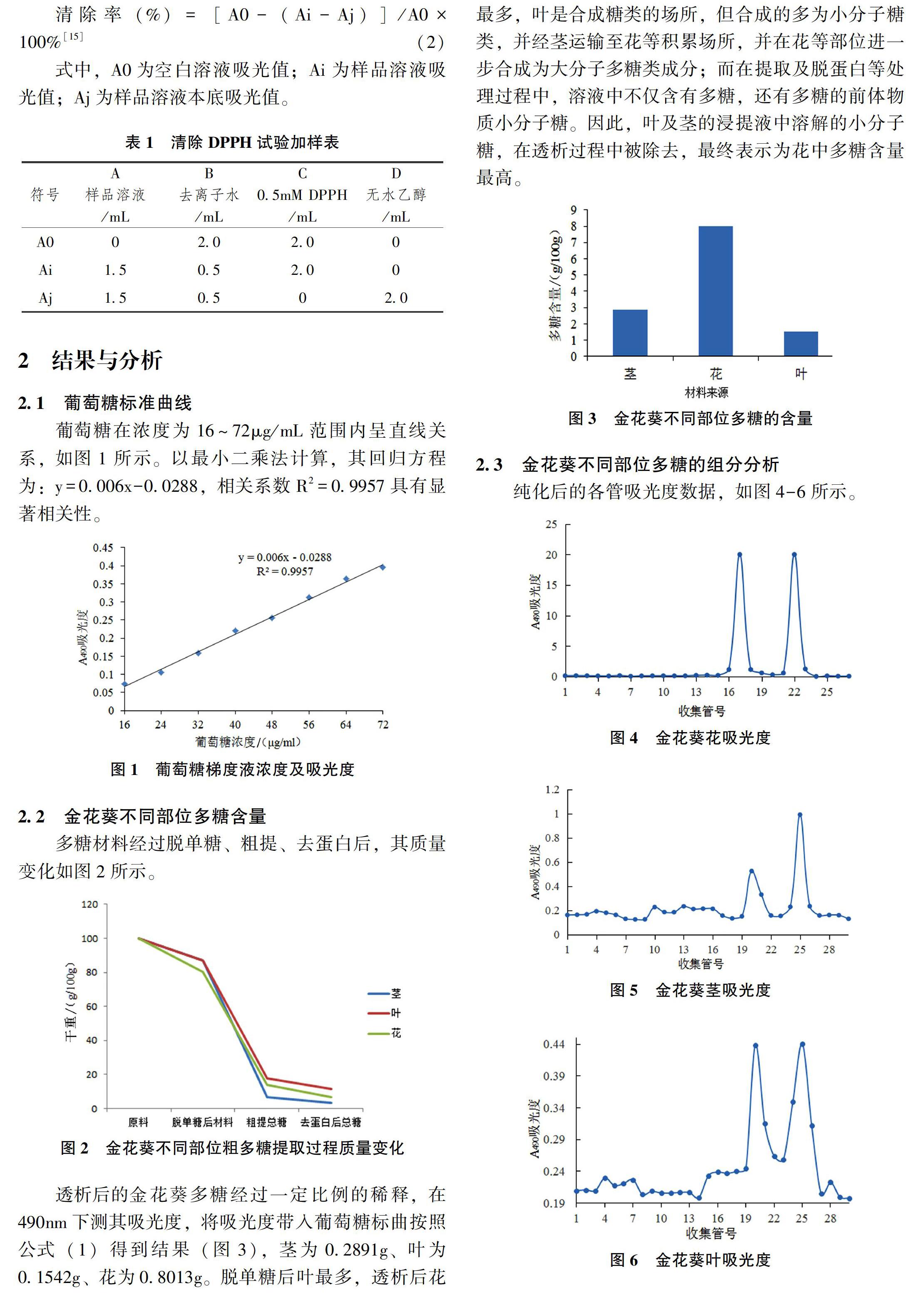
2.2 金花葵不同部位多糖含量
多糖材料經過脫單糖、粗提、去蛋白后,其質量變化如圖2所示。
透析后的金花葵多糖經過一定比例的稀釋,在490nm下測其吸光度,將吸光度帶入葡萄糖標曲按照公式(1)得到結果(圖3),莖為0.2891g、葉為0.1542g、花為0.8013g。脫單糖后葉最多,透析后花最多,葉是合成糖類的場所,但合成的多為小分子糖類,并經莖運輸至花等積累場所,并在花等部位進一步合成為大分子多糖類成分;而在提取及脫蛋白等處理過程中,溶液中不僅含有多糖,還有多糖的前體物質小分子糖。因此,葉及莖的浸提液中溶解的小分子糖,在透析過程中被除去,最終表示為花中多糖含量最高。
2.3 金花葵不同部位多糖的組分分析
純化后的各管吸光度數據,如圖4-6所示。
由圖4至圖6分析可知,3個材料在純化后都出現2個峰值,都集中于20號、25號管附近,已有研究[6]通過對金花葵莖進行氣相分析發現金花葵莖中含有2種多糖,分別為中性和酸性多糖,純化后的金花葵莖出現2個峰值,符合2種多糖的論證[16]。因此,根據葉和花出現的峰值情況,可以判斷金花葵葉和花中也含有2種不同的性質的多糖。
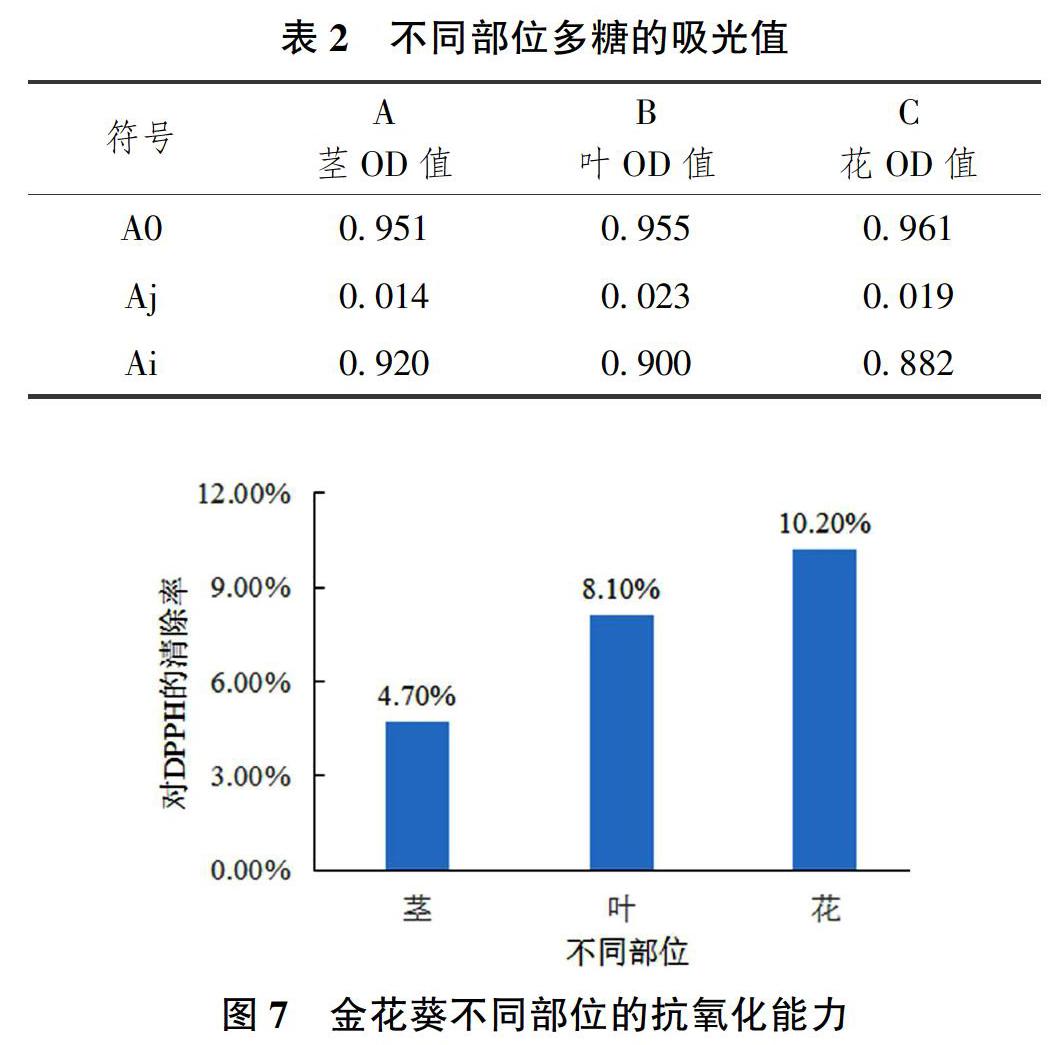
2.4 金花葵不同部位多糖的清除自由基能力
按照表1的方法進行加樣,在517nm下[17],分別測空白溶液的吸光值,樣品溶液吸光度以及樣品本底吸光度,將表2中A0、Ai、Aj 3個數據帶入公式(2)進行清除率的計算,可以得到金花葵不同部位多糖對DPPH的清除能力,莖為4.7%、葉為8.1%、花為10.20%,如圖7所示。
3 討論與結論
本研究采用熱水浸提法對金花葵不同部位的多糖進行提取純化及抗氧化能力的比較。通過純化后不同部位均出現2個峰值,可以得出金花葵的花和葉同莖一樣也含有2種不同性質的多糖。試驗重點對比金花葵不同部位多糖含量的多少,同時也對提取的多糖進行了抗氧化能力的比較。結果表明,金花葵中花的多糖含量最高,提取率為8.01%,莖次之,提取率為2.89%,葉最少,提取率為1.5%,多糖的抗氧化能力比較由DPPH自由基清除率體現,分別為花10.20%、葉8.10%、莖4.7%,金花葵花多糖的抗氧化能力最強,而莖多糖的抗氧化能力低于葉的多糖抗氧化能力。由于金花葵花的多糖含量高,實驗室提取效果顯著,且較金花葵植株其它部位的多糖來說,其抗氧化能力最強,較同屬植物黃秋葵[11]的多糖來說,其抗氧化能力更強。金花葵花多糖較高的提取率與抗氧化能力在工業提純與生產上具有較大的潛力和廣闊的前景[18]。
研究發現金花葵花中多糖含量以及抗氧化能力優于金花葵莖、葉,為今后深入研究其理化性質以及開發利用金花葵多糖提供理論依據。
參考文獻
[1] 彭志兵,吳正平,喻華娟.金花葵籽油中脂肪酸組成的GC-MS分析[J].安徽農業科學,2009,37(34):16753,16756.
[2]Liu Q, Xin X L, Lan R, et al. Study on Technology in Extracting Flavonoids from Hibiscus manihot L[J]. Food Research & Development, 2011,032(007):19-21.
[3]Azimova S S, Glushenkova A I. Hibiscus manihot, L[M]. London:Springer, 2012.
[4]Qiu S , Chen J , Chen X , et al. Optimization of selenylation conditions for lycium barbarum polysaccharide based on antioxidant activity[J]. Carbohydrate Polymers, 2014, 103(Complete):148-153.
[5]巫玲麗,穆禎強,張利.金花葵多糖提取的工藝優化及抗氧化活性研究[J].南方農業學報,2017,48(1):109-113.
[6]程麗敏,董爽,梁文明,等.金花葵莖可溶性糖的提取及抗氧化性研究[J].食品研究與開發,2016,37(22):59-63.
[7]張婭芳.麥冬多糖的結構分析及其體外抗氧化活性研究[D].西安:陜西師范大學,2007.
[8]黃杰濤,張蓮姬.響應面法優化金花葵多糖提取工藝[J].食品工業科技,2016,37(19):217-220,226.
[9]梅洪睿.金花葵中提取生物活性物質的研究[D].大連:大連工業大學,2009.
[10]Lin H, Zhang H D, Li G S, et al. Optimization of extraction technology and antioxidant activities of total phenol from betel nut seed.[J]. Transactions of the Chinese Society for Agricultural Machinery, 2010, 41(4):134-139.
[11]趙煥煥. 黃秋葵多糖提取純化及體外抗氧化活性的探討[D]. 鄭州:鄭州大學, 2012.
[12]李知敏,王伯初,周菁,等.植物多糖提取液的幾種脫蛋白方法的比較分析[J].重慶大學學報(自然科學版),2004,27(8):57-59.
[13]薛丹,黃豆豆,黃光輝,等.植物多糖提取分離純化的研究進展[J].中藥材,2014,37(1):157-161.
[14]邵佳,郁建平,胡美忠.草珊瑚水溶性粗多糖提取及抗氧化性能研究[J].食品科學,2007,28(11):283-286.
[15]Sharma OP, Bhat T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4):1202-1205.
[16]張勇.鐵皮石斛莖、葉、花多糖理化性質及抗氧化、免疫調節活性研究[D].杭州:浙江大學,2016.
[17]王銳,周云,何嵋,等.玫瑰茄粗多糖清除DPPH自由基活性研究[J].中國農學通報,2011,27(8):128-131.
[18]曹利華,苗明三.金花葵的現代研究與綜合利用分析[J].中醫學報,2016,31(12):1966-1968.
(責任編輯 周康)

