甲烷碳源的反硝化作用機理與工藝技術研究進展
萬志遠,陳 丹,吳慧芳,王俊萍
(南京工業大學市政工程系,江蘇南京 211800)
氨氮和硝酸鹽是造成水體富營養化的主要原因之一,生活污水以及食品、化肥等工業廢水都含有大量的氮鹽,其過度排放對全球環境造成了嚴重影響[1-2];同時,過量攝入氮元素后,人體內會把硝態氮轉化為亞硝態氮從而引起高鐵血紅蛋白癥且發生中毒,誘發人體細胞癌變[3]。因此,如何有效去除氨氮和硝酸鹽成為了當今世界必須面對的嚴峻問題之一。實踐證明,想要使用高效的脫氮工藝對含氮污水進行深度處理,必須需要大量的碳源[4]。但是我國的城市污水碳氮比通常偏低,某些地方的污水碳氮比僅為3~4[5],反硝化過程中的碳源不足,成為了限制我國污水處理中高效脫氮工藝的最大阻礙。
為了尋求一種經濟高效的碳源來實現脫氮的深度處理,甲烷或許可以成為一種新型的研究方向。目前已經證實,海洋沉積層產生的絕大部分甲烷被甲烷氧化菌和硫酸鹽還原細菌共同介導的以硫酸鹽為電子受體的甲烷氧化途徑所消耗[6-7]。由此,甲烷氧化耦合反硝化為解決碳源不足提供了新的思路。甲烷主要產生于垃圾填埋場、污水處理廠、石油燃燒等,是一種重要的溫室氣體,其溫室效應是二氧化碳的20倍[8],去除甲烷以減少對溫室效應的影響尤為關鍵。甲烷作為電子供體的一種,雖然不能被反硝化細菌直接利用,但是可以被甲烷氧化菌氧化為反硝化菌可利用的有機物,以此實現以甲烷作為碳源的反硝化作用[9]。早從1970年開始,就有很多學者進行了將甲烷作為外部碳源的反硝化過程的研究。例如1971年,Harremoes在純凈甲烷頂空的條件下,用富營養化的湖中沉積物當作接種物,在燒杯中加入含氮的污水,可以檢測出反硝化反應的發生。但是在相同的條件下,將頂空氣體換作氮氣,則并不能觀察到硝酸鹽的去除。這個結果表明,甲烷的反硝化作用是存在的。1974年,Martens等在厭氧海洋沉積物中發現了甲烷厭氧氧化耦合硫酸鹽的還原過程,改變了人類一直的觀念中對于甲烷只存在好氧氧化的認知。1976年,Sollo等對比了在填充柱和流化床里將甲醇和甲烷分別作為電子供體的反硝化過程。他們發現在重力填充柱中,將甲醇作為電子供體的反硝化效果是4.6 mg N/(L·h),遠比甲烷反硝化的0.7 mg N/(L·h)效果要好。在活性炭流化床中,觀察到了高速的甲烷反硝化速率為1.2 mg N/(L·h),但是這其中的一半速率(0.6 mg N/(L·h)都要歸功于內源有機物消耗而不是甲烷氧化[10]。Islas-Lima[11]在2004年調研了缺氧甲烷氧化與脫氮耦合的證據,試驗表明了在不同甲烷分壓下的反硝化速率的變化并以此證明了甲烷氧化可以協同脫氮反硝化。近年來,大量的研究已經證實了甲烷氧化耦合反硝化反應過程的可行性[12-14],好氧條件下的甲烷氧化耦合反硝化反應的機理性研究也較為透徹,對于厭氧條件下的甲烷氧化耦合反硝化反應雖然國內外已有大量研究,但是對于其反應機理并未達成統一的認識[15-16]。本文主要闡述了好氧甲烷氧化耦合反硝化過程的研究歷史與現狀,對甲烷氧化菌的機理、代謝反應過程及反應器做出了詳細探討,并對于未來的發展前景提出了建議與展望。
1 機理性分析
1.1 代謝過程
參與好氧甲烷氧化(AME)反應的主要菌種有兩類,第一類為甲烷氧化菌,第二類為反硝化細菌。在以甲烷作為碳源的反硝化過程中,首先甲烷氧化菌在好氧的條件下將甲烷氧化,且釋放出有機物質。這些有機物質被認為是甲醇[17],并且利用甲醇的反硝化菌也確實表明可以與甲烷營養菌共存[18-19]。然而,在這些有機物質中,也認為可能會存在乙酸鹽[18]和蛋白質[19]。甲烷營養菌在某些環境條件下釋放核酸和碳水化合物作為裂解產物或可溶性代謝物后,反硝化細菌利用甲烷營養菌產出有機混合物進行反硝化。其主要反應原理如圖1所示[10]。
理論上來說,好氧甲烷氧化耦合反硝化(AME-D)消耗甲烷作為有機代謝物的最佳方案的化學計量如式(1)~式(4)。因為甲烷單加氧酶需要還原等價物,所以將甲烷氧化成為甲醇的時候,每1 mol的甲烷需要2 mol的電子。將甲醇完全氧化為二氧化碳時,1 mol的甲醇產生6 mol的電子。因此,1 mol甲醇氧化為二氧化碳產生足夠的還原能力以氧化3 mol甲烷。考慮到這一點,式(4)中表明甲烷消耗和硝酸鹽還原的摩爾比率為1.25 mol CH4-CNO3-N/mol。然而,實際試驗中碳氮比要比這個高的多,達到了12 mol CH4-CNO3-N/mol。
(1)
CH3OH+H2O→CO2+6H++6e-
(2)
(3)
(4)
上述情況中并未考慮有氧甲烷營養菌對細胞維持能量的需求。在25 ℃時,好氧細菌最小的能量需求量估計為5.7 kJ/(mol·h)。假設細胞的組成是由經驗方程C5H7O2N組成的,那么一個細胞物質的基礎維持能量要求是0.25 kJ/(g·h)。在最大的甲烷氧化速率是31×10-3mol/(g·h)的條件下,每摩爾氧化甲烷的需求能量為8.1 kJ。由式(2)可知,每1 mol甲醇氧化為二氧化碳會釋放出6 mol電子,且在標準情況下的吉布斯自由能是-693 kJ/mol,平均為115.5 kJ/electron。因此,最小維持能量要求為0.070電子當量。基于該分析,每1 mol甲醇氧化獲得的6 mol到二氧化碳中,2 mol電子被甲烷單加氧酶(MMO)消耗,且至少0.070 mol被甲烷氧化物用于細胞維持,其余的理論上可用于反硝化。因此,對于此最樂觀的碳氮比可以漲至1.27,如式(5)。
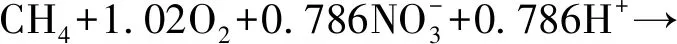
(5)
但是,式(1)~式(5)都沒有考慮到電子是如何轉移到MMO上的。盡管顆粒性甲烷單加氧酶(pMMO)可以使用從甲醇氧化成二氧化碳的任何步驟得到的還原能力,但是溶解性甲烷單加氧酶(sMMO)使用NADH,該NADH在后兩個氧化步驟中產生,即從甲醛氧化為二氧化碳。這進一步將最優的碳氮比增加為1.67。然而,因為污水出水中含有銅離子,所以大部分的AME-D反應器中甲烷營養菌還是會釋放pMMO。
1.2 微生物菌種
甲烷氧化菌在甲烷碳源反硝化反應中扮演了重要角色。這種菌是一類使用甲烷當作唯一的碳源和能量的嚴格的好氧細菌,在沼澤、土壤、河流、海洋、池塘、污水污泥等自然界中普遍存在。作為甲基營養菌的分支,甲烷營養菌可以利用比甲酸更加具有還原性的有機物作為碳源和能源且同化甲醛。直至現在,已經發現了100多種甲烷營養菌[20]。基于碳同化吸收的方式和其他的另外一些性能,甲烷營養菌被分成了3類:I型營養菌、II型營養菌和X型營養菌[10]。I型甲烷營養菌屬于γ-細菌,該類菌種通過核酮糖一磷酸(RuMP)途徑同化碳。II型甲烷營養菌屬于α-細菌,該類菌種通過絲氨酸途徑同化碳。X型甲烷營養菌和I型甲烷營養菌比較相似,但是它生在更高的溫度下且擁有可以和絲氨酸結合的酶[10]。在專性甲烷營養菌中,最常見的氧化途徑如下:第一步是利用MMO將甲烷催化氧化為甲醇。這種酶有兩種類型,分別叫作sMMO以及pMMO。sMMO是一種可以溶解在細胞質中的酶,另外一種是粘附在細胞膜分數上的酶叫做pMMO。在低銅離子濃度的條件下或者小于0.85~1.0 mmol/g的干細胞中存在sMMO,在高銅離子濃度的條件下存在pMMO。所有甲烷營養菌都可以釋放pMMO,但只有少數營養菌可以釋放sMMO。sMMO具有更廣泛的底物特異性,并且在鹵代脂肪族化合物(如三氯乙烯)的共代謝方面更有效。相比之下,pMMO擁有更高的生長速率和效率,對甲烷的親和力也更強。
在甲烷氧化反硝化過程中,Waki[23]證明當在甲烷營養菌中加入抑制劑氟化甲烷、在硝化菌中加入亞硝酸鹽的還原劑鎢酸鹽時,對照試驗的對比中都會顯示AME-D反應活動被抑制。Costa等[18]做了大量的研究來確認在氧氣受限的AME-D活性污泥反應器中的微生物群落。研究發現,反應器中的微生物種群由大量的甲烷營養菌和乙酸降解反硝化菌組成,另外還存在少量的甲醇降解反硝化菌。甲烷營養菌的代謝研究,是對其加入標記了13C的甲烷。在高氧氣壓力(20%氧氣和15%甲烷)條件下,NMR光譜顯示只有二氧化碳和碳酸氫根可以被還原。在低氧氣壓力(20%氧氣和15%甲烷)條件下,還觀察到可能對應于乙酸鹽的小峰。雖然NMR光譜試驗并沒有在上清液中測出了乙酸鹽,但是已經有試驗證明在無菌條件下甲烷營養菌可以在培養基中產生乙酸[18]。
Eisentraeger等[19]分析,適合進行AME-D反應的混合微生物種群可以從土壤中培養,由此可以富集大量的異養微生物。之后以甲醇、乙酸鹽或者蛋白質為碳源進行反硝化菌滴度分析且在這些物質中找出所有可以用于反硝化的細菌。然而,以乙酸鹽或者蛋白質為碳源的滴度體積小于以甲醇為碳源的滴度體積,這表示甲醇反硝化細菌的濃度比較低[19]。
2 試驗與反應器
在好氧甲烷氧化耦合反硝化(AME-D)反應系統里,甲烷氧化和反硝化是通過兩種不同的菌完成的。在好氧條件下,甲烷反硝化反應是由微生物聚集體進行的,該聚集體由好氧甲烷營養菌組成。在該過程中,好氧甲烷營養菌氧化甲烷,反硝化菌使用甲烷營養氧化菌所釋放的有機復合物作為電子供體。雖然某些微生物,例如Thiosphaerapantotropha,可以在好氧的條件下發生反硝化反應[26],但是該系統里的反硝化反應仍在厭氧的微生物環境反應器中進行。
Thalasso等[17]研究表明,在較低的氧分壓下,用于反硝化的總甲烷氧化部分通常較高。然而,在較高的氧氣濃度下,實際的反硝化速率可能會更高,因為甲烷營養菌能夠將更多的甲烷氧化成適合反硝化菌的底物。總的來說,氧氣會抑制反硝化,所以最優的情況應該是氧氣的供給盡可能地高,但是不要增加溶解氧的濃度從而抑制反硝化。
Schalk等[27]在論文中表明在以甲烷作為唯一碳源的條件下,甲烷氧化菌和反硝化細菌的聯合作用可以進行反硝化。他們從廢水處理廠中在甲醇上操作的反硝化流化床柱的樣品富集培養物中分離細菌且成功分離出了一種甲烷氧化菌(Methylomonas)和一種甲醇氧化菌(Vibrioextorquens),這兩種菌都需要氧氣來氧化甲烷和甲醇。他們同時也分離出了一種反硝化菌(Pseudomonasstutzeri),該菌可以利用琥珀酸鹽的存在產生氮氣,而不是利用甲醇或者甲烷。為了測試是否反硝化菌可以利用甲烷氧化菌或者甲基營養菌進行反硝化,微生物被分開來培養,然后將甲烷氧化菌或者甲基營養菌的濾液給反硝化菌喂食,兩個濾液中都產生了氮氣。通過對濾液的研究發現,檸檬酸鹽是其中最普遍的化合物,因此Schalk等得出結論,認為反硝化菌使用了其他細菌氧化甲烷或者甲醇所釋放的檸檬酸鹽來還原硝酸鹽。
Sun等[34]通過研究絲孢屬菌后,發現它是一個以甲醇為營養的反硝化菌屬。該菌屬中要么包含一種甲烷氧化菌(Methylococcuscapsulatus),要么包含另一種淡水中富集的甲烷營養型菌。絲孢屬菌與甲烷氧化菌的混合物在氧氣/甲烷/氦氣的頂空條件下消耗了甲烷、氧氣和硝酸鹽且產生了氮氣。研究發現,絲孢菌屬占了這些混合體總共微生物的5%。需要強調的是,該試驗只觀察到了很低的硝酸鹽消耗和氮氣的生成,且并沒有量化亞硝酸鹽和亞硝酸鹽氧化物,在試驗中也沒有使用對照試驗。
上述提到的這個案例是研究關于特殊菌種的相關性。Eisentraeger等[19]在混合培養基中也證明了好氧甲烷氧化協同反硝化反應可以消耗甲烷,去除硝酸鹽,生成亞硝酸鹽和氮氣。其他的幾個試驗也證明了硝酸鹽的消耗,但是試驗步驟中并沒有確定生成亞硝酸鹽和氮氣的數量,因此,并不能完全區分硝酸鹽的同化量和氮氣的生成量[17,24,28]。
在這些實驗室反應器中,通過噴射將甲烷和空氣的混合物供給微生物。為了避免混合氣體可能出現爆炸的現象,同時也為了回收甲烷進行發電,Waki等[24]發明了一種隔離的頂空裝置可以將甲烷和空氣分別噴射入隔離的活性污泥箱中。通過分隔反應器的頂空,可以將高純度的甲烷回收并用于發電。
其他的反應器以及反映效果及去除速率如表1所示。
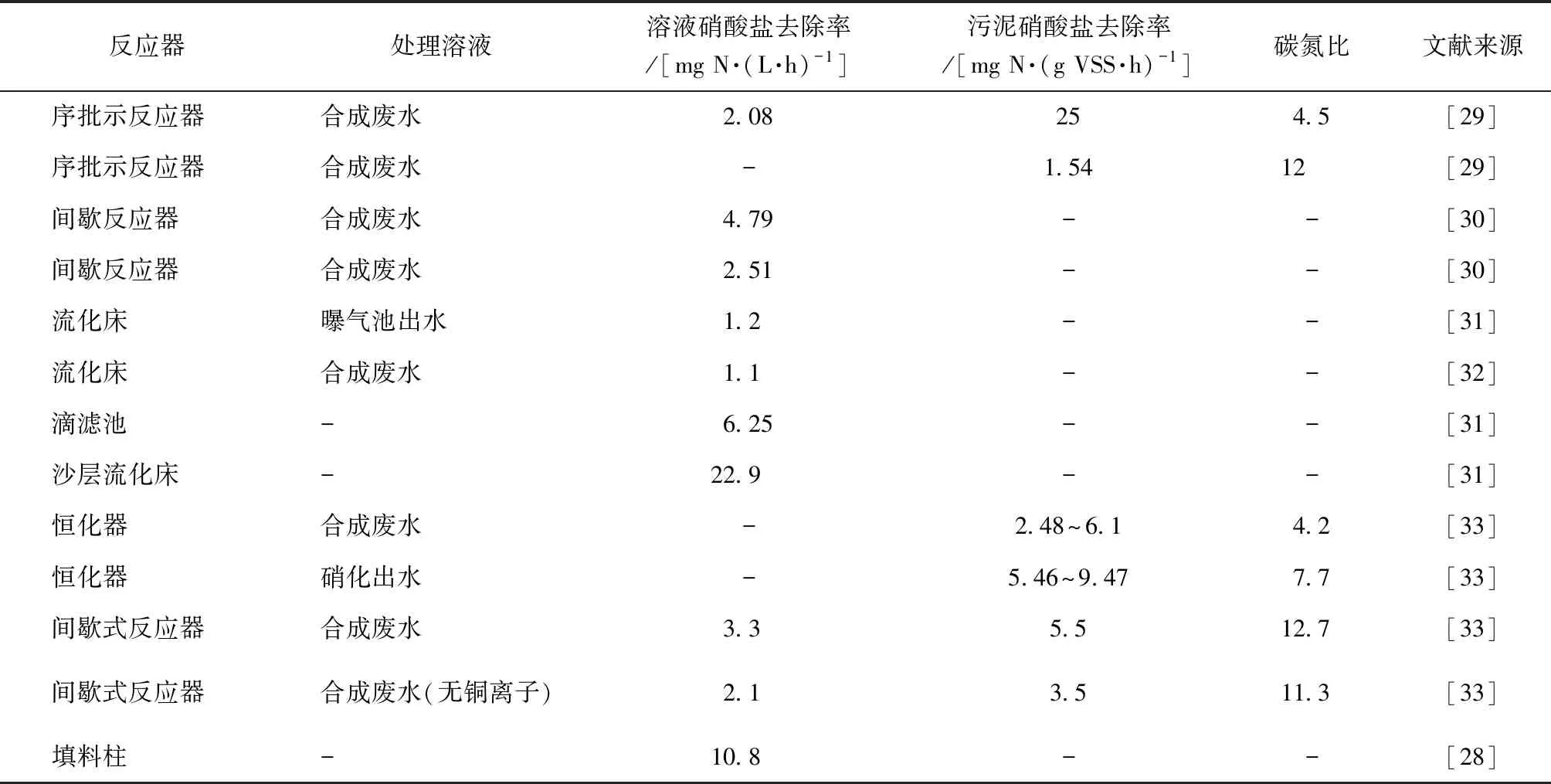
表1 甲烷氧化耦合反硝化速率研究成果Tab.1 Results of Rate of Methane Oxidation Coupled with Denitrification
3 可行性與經濟性分析
為了探究甲烷作為外部碳源進行反硝化反應的可行性,運用AME-D生物反應器對于污水反硝化案例進行分析。在此試驗中,案例分析的目的主要在于驗證現場產生的甲烷氣體是否具有反硝化效果。除此之外,試驗也對比了將甲烷換為甲醇的反硝化反應競爭性。最后討論了關于AME-D反應過程中出現的問題與解決辦法。
3.1 可行性分析
在本文中依據Islas-Lima等[11]的試驗數據,對污水廠運行參數進行如下總結(所有數據均出自于中等強度廢水的典型值),參數數值如表2所示。

表2 污水廠中等強度廢水典型值運行參數Tab.2 Typical Operation Parameters of Medium-Strength Wastewater in Sewage Treatment Plant
在此試驗分析中,進水流量與氣體產量均為人均數值,假設所有氨氮被硝化成硝酸鹽,則反硝化反應后的硝酸鹽的總量為0.57 mol/d。同時,甲烷氣體的生成量也可以被計算出來。在25 ℃的條件下,甲烷的生成量為0.84 mol/d。依據本文第1.1節的式(1),AME-D反應器中理論數值的碳氮比為1.27。依據本文表1甲烷氧化耦合反硝化速率研究成果,文獻中觀察到的碳氮比的平均值為8.33。通過計算可得,為了使甲烷生成量充足,所需的碳氮比必須要小于1.47。理論上來說AME-D反應器在最優條件下可以提供足夠低的碳氮比,然而試驗表明,實際操作過程中碳氮比不足以低至可以實現完全的反硝化,這也是從一方面證明了利用甲烷進行好氧氧化反硝化反應存在一定的不足,需要進一步開拓其好氧甲烷反硝化裝置以實現其足夠低的碳氮比。
3.2 經濟性分析
根據式(6),甲醇反硝化反應中消耗的甲烷中的碳和硝酸鹽中的氮的最優摩爾比是0.83。有研究表明在通常實驗操作下使用的比率通常為3 g CH3OHNO3-N/g,將此比率換算為碳氮比即為1.31。
(6)
依據趙志軍[9]文中的平均天然氣井口價格和甲醇無折扣基準價格作為本節的價格指數。天然氣的平均價格為2元/m3,而甲醇的平均價格為2.5元/kg。假設物質為100%純凈,那么就可以計算出每摩爾物質需要的價格,即每摩爾甲烷需要7.6×10-4元,每摩爾甲醇需要1.9×10-3元。計算表明,在理論最優的碳氮比下AME-D的確是比甲醇反硝化更優的選擇。
與其他外部碳源相比,現場制作甲烷氣體并將其作為反硝化的碳源是一個比較良好的選擇。其原因在于將甲醇運輸至污水處理廠會增加額外的經濟與環境運行的費用。除此之外,目前制作的甲烷氣體中因為含有硫化氫等雜質并沒有達到很高的純度,這些雜質可以通過一些方法去除,但是如果應用在污水反硝化反應中則并不需要很高純度的甲烷,換言之可以直接使用原位產生的沼氣氣體。并且無毒性的甲烷氣體在某些應用領域中的反硝化過程會更加具有競爭性,例如在飲用水處理中,出水中殘留的甲醇將會是一個值得注意的問題。
4 展望與建議
目前,已經通過試驗證實了在好氧情況下甲烷可以被生物反硝化用作外部碳源。在好氧條件下,甲烷氧化菌可以氧化甲烷且釋放有機復合物。該有機復合物可以作為碳源被反硝化菌利用從而進行脫氮反硝化作用。在以甲烷作為碳源的反硝化過程中,需要注意的問題是甲烷和氧氣必須要輸送至微生物體內從而避免氣體混合爆炸以及甲烷氣體的泄漏,以及保證足夠低的碳氮比來使效率增加。基于以上兩點問題,今后關于好氧甲烷氧化耦合反硝化(AME-D)反應的主要研究方向也有以下兩點。
(1)首先是探尋在AME-D工藝中的甲烷與氧氣的投加方式,減少氣體的逸出并且避免氣體混合產生的爆炸。對于此類問題可以考慮使用中空纖維膜作為曝氣裝置以控制甲烷與氧氣的投加[12]。
(2)其次是探尋如何進行甲烷高效利用的AME-D工藝。目前來說,所有AME-D過程的實測碳氮比都遠遠高于理論值,如何有效地降低碳氮比以減少成本是目前面臨的主要問題之一。現有研究表明附著在膜生物反應器(MBR)上的微生物群落可以表現出獨特的微觀結構,易創造出適合不同群落生長的生存環境且提高AME-D工藝中的甲烷利用率。因此,依托MBR的AME-D工藝優化或許是解決碳氮比過高的一個研究方向[13-14]。

