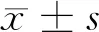
阿魏酸對脂多糖誘導的OA軟骨細胞Wnt/β-catenin信號通路的影響
劉新寧 曹濱濱 劉杰 畢建年 趙亮
骨關節炎(OA)是一種常見的關節軟骨病變,以繼發性骨質増生為主要的病理表現,致病原因由于過度勞損、衰老損傷、先天關節崎形等原因導致關節軟骨破環、關節間隙狹窄、滑膜增生等,是困擾中老年人的健康的重要疾病之一[1-3]。患者長期忍受OA帶來的困擾,極大影響生活質量,給家庭帶來負擔,給社會造成經濟損失[4]。因此尋找新的治療OA的方法成為醫學工作者不斷探尋的課題。軟骨細胞是關節內合成分泌的重要細胞,能夠調控關節內環境的穩定性[5],當關節內環境紊亂時,軟骨細胞識別異常作出應答,調整細胞外基質的合成[6],保持關節內環境的穩定。因此軟骨細胞OA是研究OA機制的好思路。Wnt/β-catenin是機體內重要的信號通路,廣泛參與多種細胞的生命活動,如組織分化、損傷再生、細胞內環境維持、抗應激損傷等[7]。研究表明Wnt/β-catenin通路的激活影響軟骨細胞的的增殖、分化、移行,在維持骨關節的正常結構、修復損傷過程中Wnt/β-catenin通路起重要的作用[8]。阿魏酸是從植物細胞壁提取的低毒、多酚類化合物[9]。研究表明阿魏酸具有抗氧化、抗血栓、抗炎癥、抗血脂等作用,具有強大的抗炎、修復、治療作用,廣泛應用于醫藥領域和食品領域[10]。本研究采用LPS誘導的OA軟骨細胞為模型,從Wnt/β-catenin信號通路入手探討阿魏酸對OA軟骨細胞的保護作用,為治療OA提供理論支撐。
1 材料與方法
1.1 試驗材料與主要試劑 清潔級新西蘭大白兔購自福建醫科大學實驗動物中心提供,合格證號:SCXK(閩)2004-000;阿魏酸、LPS、Ⅱ型膠原酶采購自Sigma公司;胰蛋白酶、DMEM培養基、Ⅱ型膠原抗體購自武漢博士生物工程有限公司;BCA蛋白濃度測定試劑盒化學發光試劑盒購自廣東銳博生物科技技術股份有限公司;兔抗MMP-13、兔抗COL2、兔抗大鼠wnt2、兔抗大鼠磷酸化GSK-3p (p-GSK-3p)(Ser9)抗體、兔抗β-catenin、兔抗GAPDH以及山羊抗兔IgG采購自美國abcam公司。
1.2 軟骨細胞分離培養 從健康的4月齡新西蘭大鼠膝蓋中取軟骨細胞,0.25%胰蛋白酶消化,37℃ 消化30 min,棄去胰蛋白酶,加入DMEM培養基過夜,1 200 r/min離心10 min,棄上清,加入DMEM培養基混勻,置于37℃ 恒溫箱中,37℃,5%CO2培養傳代。
1.3 分組處理 取對數期的軟骨細胞,將細胞分為4組,空白組、OA模型組、OA+FA低劑量組、OA+FA高劑量組,2 μg/ml的LPS加入培養基中培養軟骨細胞4 h,構建OA軟骨細胞模型,OA+FA低劑量組、OA+FA高劑量組分別加入5 μmol/ml、20 μmol/ml的阿魏酸進行共培養。
1.4 軟骨細胞的形態學觀察及鑒定 取進入對數期的軟骨細胞進行細胞爬片,PBS清洗,加入4%多聚甲醛覆蓋爬片,25℃固定30 min,PBS清洗,滴加1%甲苯胺藍染色30 min無菌水水浸洗30 min,95%的乙醇漂洗10 min;干燥后,中性樹膠封片,觀察、攝片。
1.5 CCK-8法檢測軟骨細胞的增殖率 取對數期的軟骨細胞,調整細胞濃度為1×105個/ml,取100 μl加入到96孔板中,加入DMEM培養基放置于37℃,5%CO2培養24 h,將阿魏酸分別稀釋到80、40、20、10、5 μg/ml、每孔加入10 mg/ml的CCK-8溶液,5%CO2培養4 h,棄去CCK-8溶液,加入200 μl DMSO溶液,震蕩10 min,使其完全溶解,全自動酶標儀波長490 nm處測量各孔的吸光值。按照上述方法檢測阿魏酸對經LPS處理過軟骨細胞增殖的影響。
1.6 實時定量PCR檢測COL2、MMP-13基因的表達 取4組細胞加入裂解液,混合作用10 min,12 000 r/min 4℃離心10 min,離心取上清,加入Trizol與氯仿震蕩混合均勻,12 000 r/min 離心20 min,加入異丙醇,12 000 r/min離心后,棄上層清液,取管底絮狀沉淀,加入Trizol與乙醇混合液,離心棄上清,沉淀則為細胞RNA。將RNA用DEPC水溶解,反轉錄試劑盒轉錄cDNA。按照SYBR方法進行實時定量PCR,并以U6為內參。反應條件為94℃,30 s,1 cycle;95℃,5 s,60℃,30 s,40 cycles;95℃,5 s,60℃,1 min,95℃,1 cycle。結果用2-ΔΔCT表示。檢測各組基因的表達量。引物COL2上游5’-GTGTGTAACCCACACG-3’下游5’-GGGAGTAACACTGTGGT-3’,MMP-13上游5’-AC
ACGTAACCCCAG-3’下游5’-GGTAGTAACACTGTAAC
A-3’。
1.7 蛋白免疫印跡檢測Wnt2、GSK-3β、β-catenin、COL2、MMP-13、Bcl-2、Bax蛋白的表達 加入細胞裂解液,冰上放置20~30 min,超聲裂解30 s,12 000 r/min,4℃離心10 min,收集上清,置于-20℃保存。BCA定量法檢測蛋白濃度,待測樣品和Loading buffer混合,100℃水域變性5 min,然后加入至制備好的SDS-PAGE凝膠(5%濃縮膠,10%分離膠)上樣孔中,每孔25 μl,濃縮膠時調整電壓為60 V,分離膠電壓為120 V,結束后取出凝膠,4℃轉膜1.5 h,采用5%脫脂奶粉封閉PVDF膜2 h,加入一抗,4℃過夜,TBST洗膜后加入辣根過氧化物標記的羊抗兔IgG,37℃孕育2 h。加入ECL顯影,采用自動凝膠成像系統采集圖像,以GAPDH作為內參,分析蛋白水平。
2 結果
2.1 軟骨細胞的鑒定 軟骨細胞甲苯胺藍染色結果顯示,軟骨細胞均分散分布,呈路石樣,細胞漿呈淺藍色,細胞核呈深藍色的圓球的藍染,高倍鏡下可見細胞,形態不規則、梭形透光度良好的多層細胞,細胞核呈顏色較深的圓球狀,證明培養的細胞為軟骨細胞。見圖1。


正常軟骨細胞(甲苯胺藍染色×40)正常軟骨細胞(甲苯胺藍染色×100)
圖1 新西蘭大白兔軟骨細胞的鑒定
2.2 不同濃度的阿魏酸對正常軟骨細胞增殖的影響 4組處理的OD值與空白組孔OD值比值,10、20、40 μg/ml軟骨細胞的增殖率的表達顯著高于5 μg/ml,差異有統計學意義(P<0.05),80 μg/ml軟骨細胞的增值率的表達顯著低于5 μg/ml,差異有統計學意義(P<0.05),選取5 μg/ml作為低劑量組,40 μg/ml作為高劑量組。見表1。


阿魏酸濃度(μg/ml)OD/空白組孔OD值51.02±0.06101.26±0.19*201.45±0.18*401.74±0.21*800.84±0.12*
注:與5 μg/ml組比較,*P<0.05
2.3 阿魏酸對LPS誘導的OA軟骨細胞增殖的影響 空白組的軟骨細胞的增值率的表達顯著低于模型組,差異有統計學意義(P<0.05),低劑量組、高劑量組軟骨細胞的增殖率的表達顯著高于模型組,差異有統計學意義(P<0.05),且高劑量組的軟骨細胞的增殖水平更高,差異有統計學意義(P<0.05)。見表2。
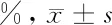

組別細胞增殖率空白組 98.78±1.11模型組 17.26±1.56*低劑量組54.32±4.12*#高劑量組72.32±2.21*#△
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05
2.4 阿魏酸對LPS誘導的OA軟骨細胞COL2、MMP-13表達的影響 模型組的COL2基因及蛋白表達顯著低于空白組,差異有統計學意義(P<0.05),低劑量組、高劑量組COL2基因及蛋白的表達量顯著高于模型組,差異有統計學意義(P<0.05),且高劑量組的COL2的表達水平更高,差異有統計學意義(P<0.05)MMP-13基因及蛋白的表達,模型組的MMP-13基因及蛋白的表達顯著高于空白組,差異有統計學意義(P<0.05),低劑量組、高劑量組MMP-13基因及蛋白的表達顯著低于模型組,差異有統計學意義(P<0.05),且低劑量組的MMP-13的表達水平更高,差異有統計學意義(P<0.05)。見表3,圖2。
2.5 阿魏酸對LPS誘導的OA軟骨細胞凋亡的影響 模型組的Bcl-2/Bax顯著低于空白組,差異有統計學意義(P<0.05),低劑量組、高劑量組Bcl-2/Bax顯著高于模型組,差異有統計學意義(P<0.05),且高劑量組的Bcl-2/Bax水平更高,差異有統計學意義(P<0.05)。見圖3,表4。
2.6 阿魏酸對軟骨細胞蛋白Wnt2、GSK-3β、β-catenin的影響 與空白組相比,模型組Wnt2、GSK-3β、β-catenin水平明顯升高,阿魏酸呈劑量依賴性抑制Wnt2、GSK-3β、β-catenin蛋白表達,差異有統計學意義(P<0.05)。見圖4,表5。


組別蛋白相對表達量COL2MMP-13mRNA相對表達量COL2MMP-13空白組 1.02±0.031.02±0.120.97±0.030.97±0.02模型組 0.45±0.04*2.54±0.16*0.18±0.07*2.12±0.17*低劑量組0.68±0.07*#1.85±0.15*#0.65±0.09*#1.88±0.24*#高劑量組0.82±0.04*#△1.43±0.11*#△0.72±0.04*#△1.46±0.13*#△
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05

圖2 阿魏酸LPS誘導的OA軟骨細胞COL2、MMP-13的表達(與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05)

圖3 阿魏酸對LPS誘導的OA軟骨細胞凋亡(與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05)


組別Bcl-2/Bax空白組 1.01±0.02模型組 0.15±0.05*低劑量組0.61±0.07*#高劑量組0.72±0.05*#△
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05

圖4 阿魏酸LPS誘導的OA軟骨細胞蛋白Wnt2、GSK-3β、β-catenin的影響(與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05)


組別Wnt2GSK-3ββ-catenin空白組 0.98±0.031.01±0.031.01±0.02模型組 4.11±0.15*4.26±0.08*4.33±0.12*低劑量組3.21±0.11*#3.32±0.05*#3.41±0.14*#高劑量組1.32±0.13*#△1.53±0.11*#△2.12±0.11*#△
注:與空白組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05
3 討論
阿魏酸具有降血脂、抗血拴、抗氧化等生物活性,能夠減少機體合 IL-1β,提高機體超氧化歧化酶的活性,減少丙二醛的含量緩解OA患者的臨床癥狀,對OA引發并發癥具有良好的改善作用[11]。本研究采用LPS構建OA軟骨細胞模型,然后觀察阿魏酸對OA軟骨細胞的作用,結果顯示阿魏酸能夠明顯改善COL2蛋白的表達。孔長旺等[12]研究表明白阿魏酸能夠顯著提高COL2蛋白的表達,減少骨細胞的損害,對軟骨細胞起到保護作用。與本文研究結果一致。
OA是軟骨細胞和基質的退行性改變的一種骨關節疾病,主要以關節疼痛、積液滲出、活動受限為主要的臨床特點。文獻報道稱OA最先出現骨細胞增殖障礙,細胞活性降低[13],隨著病情的發展會出現關節細胞壞死,最終引起骨關節代謝性增生[14],本研究中的結果顯示模型組的軟骨細胞增殖活性顯著低于空白組,差異有統計學意義(P<0.05),提示軟骨細胞的功能狀態受到了嚴重的損害,而低劑量組和高劑量組的細胞增殖率顯著高于模型組,差異有統計學意義(P<0.05),說明阿魏酸具有保護OA軟骨細胞的功能。
OA發生機制是由于蛋白酶降解細胞胞外基質及基底膜成分導致軟骨細胞內環境失衡,導致細胞間質合成紊亂,大量軟骨組織被溶解,抑制骨細胞分泌型溶解蛋白對維持軟骨細胞的內環境,維持骨關節正常的生命活動起重要的作用[15]。MMP-13是由軟骨細胞合成分泌的一種膠原酶,主要溶解Ⅱ型膠原蛋白,發生OA時,細胞碎片上調MMP-13的表達,阻礙Ⅱ型膠原蛋白的表達,加速骨蛋白的多糖的流失,使軟骨細胞遭受損害[16]。本研究免疫細胞化學染色結果顯示軟骨基質蛋白MMP-13在OA軟骨細胞的表達增高,提示骨關節基質遭到大量破壞,低劑量組和高劑量組的MMP-13表達量顯著低于模型組,隨濃度的增加抑制作用更強。說明阿魏酸具有保護骨關節軟骨基質的作用。細胞Bax作為促凋亡基因,主要通過與線粒體結合,促進其釋放促凋亡蛋白誘導凋亡,而Bcl-2則會阻止Bax與線粒體結合,從而抑制細胞凋亡[17],本研究中結果顯示模型組的Bcl-2/Bax顯著低于空白組,低劑量組、高劑量組Bcl-2/Bax顯著高于模型組,提示白阿魏酸能夠抑制軟骨細胞的凋亡。
文獻報道稱Wnt/β-catenin信號通路與骨細胞的移行、粘附、分化、骨關節正常生長、損傷修復過程有關,該信號通路激活會加重OA的發展,經典的β-catenin信號通路活化表現為β-catenin在細胞質中積累并移向細胞核,與T細胞核因子和淋巴增強因子共同作用,啟動Wnt下游轉錄[18]。研究表明GSK-3β能夠促進β-catenin的降解,在多種腫瘤模型中已經證實抑制GSK-3β能夠促進β-catenin信號通路激活[19]。研究人員將新型沒食子酸作用于軟骨細胞,發現該沒食子酸能激活Wnt/p-catenin通路,促進軟骨細胞增殖。研究結果顯示采用LPS誘導OA模型后,Wnt2、β-catenin水平明顯升高,且促進了GSK-3β的磷酸化,從而提示Wnt/β-catenin信號通路參與了OA的發生發展,采用阿魏酸處理后,Wnt2、β-catenin以及p-GSK-3p水平明顯降低,說明白阿魏酸可能是通過抑制Wnt/β-catenin信號通路來保護DCM的心臟功能[20]。
綜上所述,阿魏酸可以降低溶解蛋白的表達,提高OA軟骨細胞的增殖,抑制OA軟骨細胞的凋亡,其作用機制可能與Wntβ-catenin通路有關。

