SENEX基因通過活化Rb/E2F通路促進彌漫大B細胞淋巴瘤增殖與復發
完顏智翔,王極宇,潘 瑩,朱鳳鳳,易瀏穎,翟志敏
彌漫大B 細胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是成人淋巴瘤最常見的一種類型,是一組在臨床表現和預后等方面具有高度異質性的淋巴造血系統惡性腫瘤[1]。自由環磷酰胺、阿霉素、長春新堿和強的松組成的標準化療方案被用于治療DLBCL 以來,完全緩解率達60%~70%[2]。聯合利妥昔單抗進一步提高了療效,但仍有30%~40%左右的患者復發并最終死亡[3]。SENEX 最早在2004 年被認定克隆成功,是一個與細胞衰老密切相關的新型基因[4],主要控制細胞的生長周期、衰老和凋亡[5-6]。最早在2010年,有學者[4]首次報道了關于SENEX基因通過調控內皮細胞中p16INK4a 途徑誘導細胞應力性早衰形成的研究。但其在DLBCL中的表達及作用目前尚未見相關報道。該研究擬探討SENEX基因在DLBCL中的表達及其對DLBCL復發的影響及其可能的作用機制。
1 材料與方法
1.1 材料人DLBCL細胞株(LY8)購自上海細胞所;RPMI-1640培養基購自美國Hyclone公司;胎牛血清購自美國Gibco公司;SENEX-SiRNA及其陰性對照(negative control,NC)購自上海生工公司;人外周血淋巴細胞分離液購自天津灝洋華科生物科技公司;細胞裂解液購自上海碧云天公司;PVDF膜購自美國millipore公司;High-sig ECL Western Blotting Substrate試劑盒購自上海天能公司;人與腺病毒E2啟動子結合的轉錄因子(transcription factor binding to the adenovirus E2 promoter,E2F)1轉錄因子ELISA試劑盒購自美國OmnimAbs公司;Cell Counting Kit-8購自日本Dojindo公司;TRIzol購自美國Invitrogen公司;逆轉錄試劑盒購自美國Thermofisher公司;TB Green PCR試劑盒購自日本Takara公司。Western blot抗體購自美國Cell Signaling technology公司,見表1。PCR 引物均由上海生工生物有限公司合成,見表2。
1.2 方法
1.2.1病例資料 選擇2019年2~7月在安徽醫科大學第二附屬醫院血液科經細胞形態學、分子生物學、免疫學、細胞遺傳學確診的DLBCL患者,其中DLBCL初診患者3例,男1例,女2例,年齡分別為:51、67、68歲;獲得細胞形態學緩解的DLBCL患者3例,男2例,女1例,年齡分別為:52、56、70歲;緩解后復發的DLBCL患者3例,男2例,女1例,年齡分別為:47、50、65歲。所有緩解及復發的DLBCL患者均為骨髓緩解及復發。
1.2.2外周血單個核細胞分離 收集患者外周血5 ml,經等體積生理鹽水稀釋后緩慢加入淋巴細胞分離液中,離心,收集中間白膜狀細胞層,經生理鹽水洗滌后,離心去除上清液,留取細胞沉淀,待用。

表2 用于qRT-PCR引物和SiRNA轉染的序列
1.2.3Western blot檢測 使用人外周血淋巴細胞分離液提取患者外周血中的單個核細胞,使用細胞裂解液分別提取外周血單個核細胞和轉染后LY8細胞中的總蛋白。通過凝膠電泳分離蛋白,后將蛋白轉移至PVDF膜上。轉膜結束后將PVDF膜放入溶于TBST的5%脫脂牛奶中封閉,4 ℃條件下相應一抗孵育過夜,二抗(1 ∶ 5 000)室溫孵育1 h后顯影。
1.2.4qRT-PCR檢測 使用適量TRIzol分別提取外周血單個核細胞和轉染后LY8細胞中的總RNA,使用逆轉錄試劑盒逆轉錄生成cDNA。通過使用TB Green PCR試劑盒在熒光定量PCR儀上進行qPCR實驗。所有引物均由上海生工合成。磷酸甘油醛脫氫酶用作內參基因。使用2-△△Ct法計算目的基因的相對表達量。
1.2.5SiRNA轉染實驗 將LY8細胞接種至6孔板中,并更換為無血清培養基。分別將opti-MEM與SENEX-SiRNA/NC和Lipofectamine?2000轉染試劑混勻后孵育5 min,再分別將兩者混合室溫孵育20 min后加入6孔板中,37 ℃培養。4 h后更換為完全培養基。轉染后48 h,驗證其轉染效率。
1.2.6細胞增殖實驗 將已成功轉染SENEX-SiRNA/NC的LY8細胞,按105個細胞/孔的密度接種在96孔板中,每孔加入10 μl CCK-8溶液,37 ℃孵育2 h后上機檢測450 nm各孔的吸光度(optical density,OD)值。同時設置空白孔、對照孔,且每組設立5個復孔。
1.2.7ELISA檢測 將已成功轉染SENEX-SiRNA/NC的LY8細胞,通過離心除去沉淀留取上清液,將樣品儲存在-20 ℃避免反復凍融。使用ELISA試劑盒測量轉錄因子E2F的濃度。使用原溶液(8 000 pg/ml)配置2倍稀釋梯度(包括4 000、2 000、1 000、500、250 pg/ml)。根據標準曲線將所有標準品和樣品一式兩份加入包被板中,并將空白孔作為零,在添加終止溶液后15 min內測量450 nm處的OD值。
1.3 統計學處理采用SPSS 16.0軟件進行統計學分析。符合正態分布的兩組間數據比較均采用t檢驗方法。以P<0.05為差異有統計學意義。
2 結果
2.1 SENEX基因在初診、復發與緩解DLBCL患者中的表達情況為研究DLBCL患者中SENEX的表達水平,課題組分別提取了初診、復發和完全緩解DLBCL患者外周血中的單個核細胞,并檢測了細胞中SENEX基因及其編碼蛋白ARHGAP18的表達水平,結果如圖1所示。與初診組和完全緩解組相比,復發組ARHGAP18蛋白表達水平增高(F=148.0,P<0.01)(圖1C),與此結果一致的是,SENEX基因水平也升高(F=10.60,P<0.01)(圖1A)。此外,外周血磷酸化視網膜母細胞瘤蛋白(phosphorylation retinoblastoma, pRb)水平在復發患者中升高,完全緩解患者中降低,差異有統計學意義(F=31.21,P<0.01),視網膜母細胞瘤蛋白(retinoblastoma, Rb)表達水平則顯示出相反的趨勢(F=10.69,P<0.05)(圖1B、C)。這些結果表明復發DLBCL患者的SENEX水平增加并伴隨著Rb途徑的激活。
2.2 LY8細胞中SENEX-SiRNA的轉染與驗證為了研究SENEX基因在人DLBCL細胞株LY8中的功能,將靶向SENEX基因的SiRNA(SENEX-SiRNA)及其陰性對照(negative control, NC)轉染至LY8細胞中,并從基因水平和蛋白水平驗證其轉染效率。結果如圖2所示,與對照組(未經任何處理的LY8細胞)和NC組(圖2A)相比,SENEX-SiRNA組中SENEX mRNA的表達降低(F=104.3,P<0.01),并且SENEX-SiRNA組中ARHGAP18的水平也低于對照組和NC組(F=19.06,P<0.01)(圖2B)。這些結果表明,轉染SENEX-SiRNA成功沉默了DLBCL細胞中的SENEX基因表達。在此基礎上,課題組繼續研究了干預SENEX表達對DLBCL細胞功能和相關通路的影響。
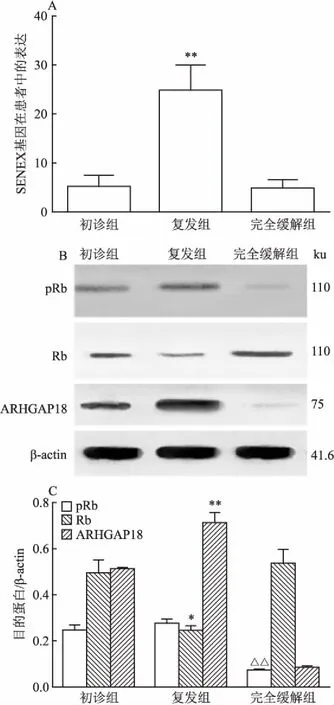
圖1 SENEX基因在初診、復發與緩解DLBCL患者中的表達情況
A:qRT-PCR方法檢測SENEX基因表達結果;B:Western blot檢測蛋白表達結果;C:pRb、Rb和ARHGAP18的相對表達量;與初診組和完全緩解組比較:**P<0.01,*P<0.05;與初診組和復發組比較:△△P<0.01
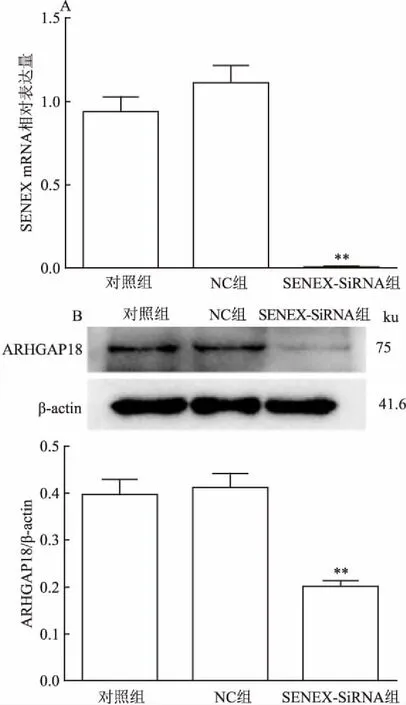
圖2 3組細胞中SENEX基因mRNA和ARHGAP18表達情況
A:SENEX基因mRNA在3組細胞中的表達;B:ARHGAP18在3組細胞中的表達;與對照組和NC組比較:**P<0.01
2.3 干預SENEX基因表達對細胞增殖能力的影響在轉染后12 h比較各組細胞增殖能力的差異,結果如圖3所示。與對照組和轉染NC組相比,轉染SENEX-SiRNA組細胞增殖能力減低(F=16.38,P<0.01)(圖3A),在轉染后24 h,SENEX-SiRNA組細胞增殖能力繼續降低,與對照組和NC組相比,差異均有統計學意義(t=8.575,P<0.01;t=2.705,P<0.05)(圖3B)。結果表明,沉默DLBCL細胞中的SENEX基因表達將抑制細胞增殖。
2.4 干預SENEX基因表達對Rb/E2F通路的影響為了進一步探究SENEX基因促進DLBCL細胞增殖的分子機制,課題組分析了細胞中周期相關蛋白和細胞因子,顯示與對照組和NC組相比,SENEX-SiRNA組中pRb水平降低(F=53.54,P<0.01)(圖4A);與NC組相比,SENEX-SiRNA組中游離的E2F1濃度出現降低(t=4.526,P<0.05)(圖4B)。這些結果表明SENEX基因能夠促進Rb蛋白和E2F1活化,提示了SENEX基因具有活化細胞周期開關—Rb/E2F轉錄調控通路的能力。
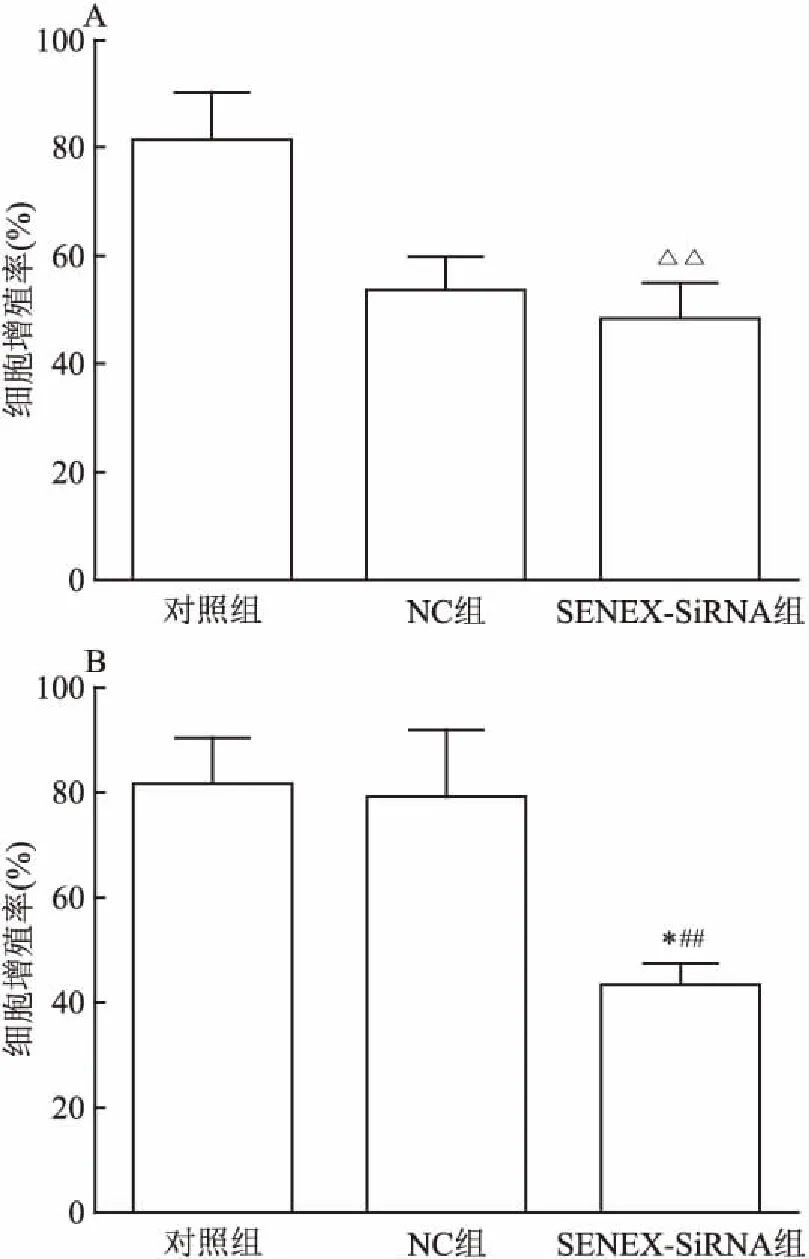
圖3 轉染后3組細胞的細胞增殖率
A:轉染12 h細胞增殖率;B:轉染24 h細胞增殖率;與對照組和NC組比較:△△P<0.01;與NC組比較:*P<0.05;與對照組比較:##P<0.01
3 討論
近年來,細胞免疫治療的興起特別是CAR-T技術的應用為血液系統惡性腫瘤的治療帶來了重要突破,尤其是CAR-T-CD19治療復發難治急性B淋巴細胞白血病獲得了高達80%~90%的完全緩解率,但是在DLBCL 等B細胞淋巴瘤中CAR-T治療并未獲得類似滿意療效,反應率僅在50%左右,有研究[7]認為這與淋巴瘤復雜的免疫逃逸機制有關。SENEX基因是一種與細胞衰老相關的新型基因,已被證明在心臟、肺、骨骼肌、腎、胰腺、脾臟、腦、睪丸組織和外周血白細胞中都有不同程度表達,主要控制細胞的生長周期、衰老和凋亡,也有研究[4-6,8]稱其參與腫瘤的生長和轉移。課題組之前的研究[9]表明,SENEX增加會引起促凋亡基因表達減少,細胞因子合成受到干擾,導致調節性T細胞增殖,從而促進膀胱癌的發生和轉移;后又在急性髓細胞白血病患者中發現SENEX 基因異常表達且與與骨髓原始細胞的負荷密切相關[10]。但是在DLBCL中SENEX基因的表達及作用目前尚未見相關報道。本研究顯示SENEX基因(及其編碼蛋白ARHGAP18)在復發DLBCL患者外周血中表達較初診組升高,且當患者達到完全緩解時,SENEX基因和蛋白表達水平均降低。這個結果提示SENEX基因水平與DLBCL復發密切相關。因此,需要在細胞水平進一步探索SENEX的功能。當在人DLBCL細胞株LY8中沉默SENEX基因表達后,12、24 h的細胞增殖活性也出現降低。結果提示沉默SENEX基因會抑制DLBCL細胞增殖。
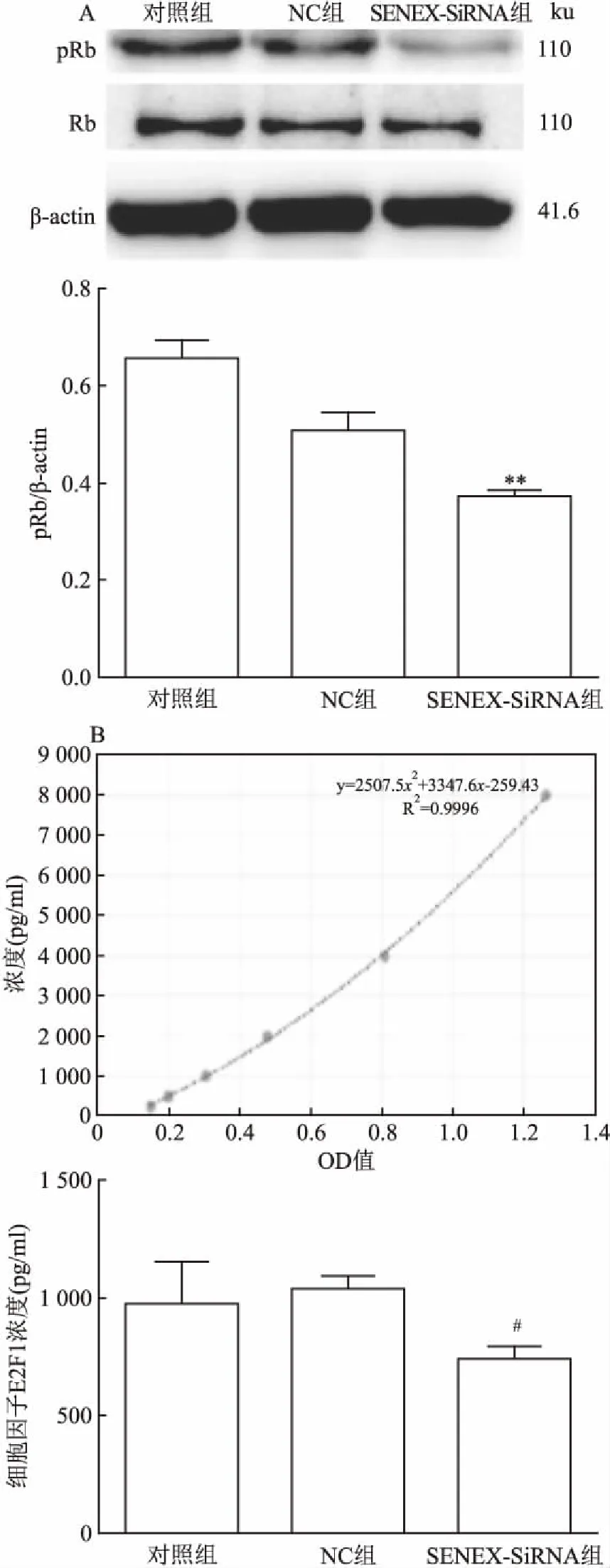
圖4 3組細胞中Rb的表達和細胞因子E2F1的濃度
A:Rb在3組細胞中的表達;B:細胞因子E2F1在3組細胞中的濃度;與對照組和NC組比較:**P<0.01;與NC組比較:#P<0.05
Rb基因是最早發現的抑癌基因,被發現于兒童的視網膜母細胞瘤。研究[11-13]認為Rb在細胞周期調控、細胞衰老、細胞凋亡和生長抑制等方面均具有重要作用。Rb以其磷酸化和去磷酸化的形式決定著轉錄因子E2F的活性,在細胞周期調控中處于中心環節,控制著細胞的生長和分化,Rb蛋白磷酸化(失活)將導致轉錄因子E2F的釋放激活細胞周期進入S期。磷酸化的Rb解離E2F1,游離的E2F1激活細胞周期蛋白,并啟動DNA復制和增殖;而去磷酸化的Rb可以通過募集共抑制因子來抑制E2F的轉錄激活結構域等方式導致細胞生長停滯。有研究[14-15]顯示,通過介導Rb/E2F轉錄調控通路可能調節腫瘤的發生和轉移。在課題組的研究中,復發DLBCL患者的pRb水平顯著高于初診組和完全緩解組,但是Rb表達則呈現相反的趨勢。之后研究了SENEX基因對DLBCL細胞中pRb/Rb表達的影響,顯示SENEX沉默引起pRb水平降低和游離E2F1的顯著減少。這些結果表明,SENEX基因誘導的pRb/E2F轉錄調控通路活化可能在DLBCL的增殖和復發中起重要作用。
綜上所述,本研究探討了SENEX基因在DLBCL中的表達及其對DLBCL復發的影響及其可能的作用機制。結果提示SENEX基因通過活化Rb/E2F1通路促進DLBCL增殖與復發。患者外周血中高水平的SENEX表達可能提示DLBCL復發可能,對于臨床預后判斷有一定的指導意義。SENEX基因在DLBCL發生發展中的機制研究仍有待深入,未來有望成為治療DLBCL患者尤其是復發患者的新靶點。

