Ac-SDKP 抑制SiO2 介導的肺泡Ⅱ型上皮MLE-12 細胞向間質轉化的作用及機制
張桂珍,張 乙,張詩匯,李 丹,楊 方,徐 洪
(華北理工大學基礎醫學院,河北唐山 063000)
課題組前期研究發現,二氧化硅(SiO2) 能夠在體外激活內質網應激信號,從而促進肺泡上皮細胞的凋亡[1],并誘導肺泡II 型上皮細胞向間質細胞轉化,即上皮-間質轉化(epithelial-mesenchymal transition,EMT)[2]。目前多認為,EMT 可以導致肺泡II 型上皮細胞獲得間質細胞表型,能夠引起促炎信號、膠原合成信號的活化與釋放,參與肺纖維化進程[3]。最近研究顯示,刺猬信號(hedgehog,HH) 信號與矽肺纖維化進程關系密切,課題組前期研究也發現N-乙酰基-絲氨酰-天冬氨酰-賴氨酰-脯氨酸(N-acetyl seryl aspartyl lysyl proline,Ac-SDKP) 能夠通過對腎素血管緊張素系統和HH 信號的調節,進而抑制染塵大鼠肺纖維化病變程度,并能夠在體外抑制血管緊張素II介導的HH 信號的活化和肌成纖維細胞分化[4]。因此,擬通過體外SiO2誘導的肺泡II 型上皮MLE-12 細胞的EMT 模型,并給予Ac-SDKP 預處理,探討Ac-SDKP 能否通過調控HH 信號從而拮抗SiO2介導的肺泡II 型上皮細胞EMT 進程。
1 材料與方法
1.1 主要試劑與材料
小鼠MLE-12 肺泡II 型上皮細胞(中科院上海細胞庫);達爾伯克(氏) 改良伊格爾(氏) 培養基(dulbecco modified eagle medium,DMEM)(10099141,美 國GIBCO 公 司);胎牛血清(BI-SH0019,以色列BI 公司);SiO2(S5631,美國 sigma 公 司);Ac-SDKP(H-1164,瑞典Bachem 公司);GDC-0449(S1082,中國Selleck公司);GANT61(S8075,中國Selleck 公司);I 型膠原(ab34710,英國Abcam 公司);α-SMA(ab32575);I 型膠原(北京博奧森);E-鈣粘蛋白(E-cadherin,E-cad,北京博奧森);音刺猬因子(sonic hedgehog,SHH)、Smoothened(SMO)、膠質瘤相關癌基因同源蛋白(glioma-associated oncogene homolog,GLI) 1(A7726,A3274,A14675,武漢愛博泰克生物科技有限公司);GLI 2、α 微管蛋白(Tublin,Tub) (DF7541,AF7010,美國Affinity 生物科技有限公司)。
1.2 細胞培養
MLE-12 細胞使用含體積分數為10 %胎牛血清的DMEM/F12 培養基,在37 ℃、5%CO2孵育箱中培養,取3~5 代進行實驗。細胞密度為70%左右時進行實驗,無血清同步化過夜。實驗分組為:(1) ①對照組:無血清DMEM/F12;②SiO2誘導組:無血清DMEM/F12 條件下給予終濃度50 μg/mL 的SiO2誘導;③Ac-SDKP 組:無血清DMEM/F12 條件下給予終濃度為 10-8mol/L Ac-SDKP[5-8];④SiO2+Ac-SDKP 組: 無血清DMEM/F12 條件下先給予Ac-SDKP 預處理1 h 后再給予SiO2共誘導;(2) ①溶劑對照組:無血清含0.1%DMSO 的DMEM/F12;②SiO2誘導組:無血清含0.1%DMSO 的DMEM/F12 條件下給予終濃度50 μg/mL 的SiO2誘導;③GDC-0449 組:無血清DMEM/F12 條件下給予終濃度為2×10-5mol/L的 GDC-449(含終濃度 為 0.1% DMSO)[7];SiO2+GDC-0449 組:④無血清DMEM/F12 條件下先給予GDC-0449(含終濃度為0.1%DMSO) 預處理1 h 后再給予SiO2共誘導;(3) ①溶劑對照組:無血清含0.1%乙醇的DMEM/F12;②SiO2誘導組:無血清含0.1%乙醇的DMEM/F12 條件下給予終濃度50 μg/mL 的SiO2誘導;③GANT61 組:無血清DMEM/F12 條件下給予5×10-6mol/L 的GANT61(含終濃度為0.1%的乙醇)[7];④SiO2+GANT61 組:無血清DMEM/F12 條件下先給予GANT61(含終濃度為0.1%的乙醇) 預處理1 h 后再給予SiO2共誘導。
1.3 免疫印跡
每25 cm2細胞培養瓶加入RIPA 裂解液100 μL,刮取細胞冰上孵育15 min,12 000×g 離心15 min,收集上清。經考馬斯亮藍法測定蛋白濃度后上樣(20 μg/泳道),常規電泳及電轉。一抗(1:1 000 稀釋) 4℃過夜;二抗(1:5 000) 37℃孵育30 min,ECL 發光試劑顯色。采用Image-Pro-plus 6.0 圖像處理軟件對條帶進行分析,以目的蛋白光密度值與內參蛋白光密度值的比值作為該蛋白的相對表達量。
1.4 統計學處理
采用SPSS 統計分析軟件進行統計分析。計量資料服從正態分布用描述,多組間比較用完全隨機設計的單因素方差分析,有差異時兩兩比較方差齊采用LSD 檢驗,方差不齊采用Tamhane’s 檢驗。P<0.05 為差異有統計學意義。
2 結果
免疫印跡結果顯示(圖1~2,表1~2),予以SMO 抑制劑GDC-0449 或Gli1 抑制劑GANT61,均能夠有效抑制SiO2介導的E-cadherin 蛋白表達的下調,并抑制Col I 和α-SMA 蛋白表達水平的上調。
免疫細胞化學染色結果顯示(圖3),與對照組相比,SiO2誘導組中SMO 及Gli 1 強陽性表達,給予Ac-SDKP 處理后,陽性表達減弱。免疫印跡結果顯示(圖4、表3),與對照組相比,SiO2誘導組中Col I、α-SMA、SHH、SMO、Gli1 及Gli2 蛋白表達上調,E-cadherin 表達下調。與SiO2誘導組相比,Ac-SDKP 預處理組Col I、α-SMA、SHH、SMO、Gli1 及Gli 2 蛋白表達下調,E-cadherin 的表達上調,以上結果經方差分析,差異具有統計學意義(P<0.05)。
3 討論
塵肺(包括矽肺) 病是我國最嚴重的職業病,以矽結節的形成和彌漫性間質肺纖維化作為主要特征。課題組前期研究也發現,EMT 在矽肺發生、發展中起到了重要的調節作用[2],部分間質纖維化區域存在肺泡上皮細胞向間質細胞轉化的過程,上皮細胞失去原有的緊密連接,變得易于遷移,并釋放促炎因子從而加速的纖維化進程[3,5]。因此,抑制肺泡II 型上皮發生EMT 可能是潛在的抗肺纖維化治療的策略之一[6]。在本研究中也發現,50 μg/mL SiO2誘導MLE-12 細胞24 h 時E-cadherin 表達水平顯著降低,而間充質細胞標記物α-SMA,以及HH 信號關鍵調節因子SMO、SHH、GLI1 和GLI2表達上調,表明SiO2誘導MLE-12 細胞上皮間質轉化的過程伴隨著HH 信號的激活。
表1 GDC-0449 對SiO2 介導的MLE-12 細胞EMT 的調節作用()Tab.1 Effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells()
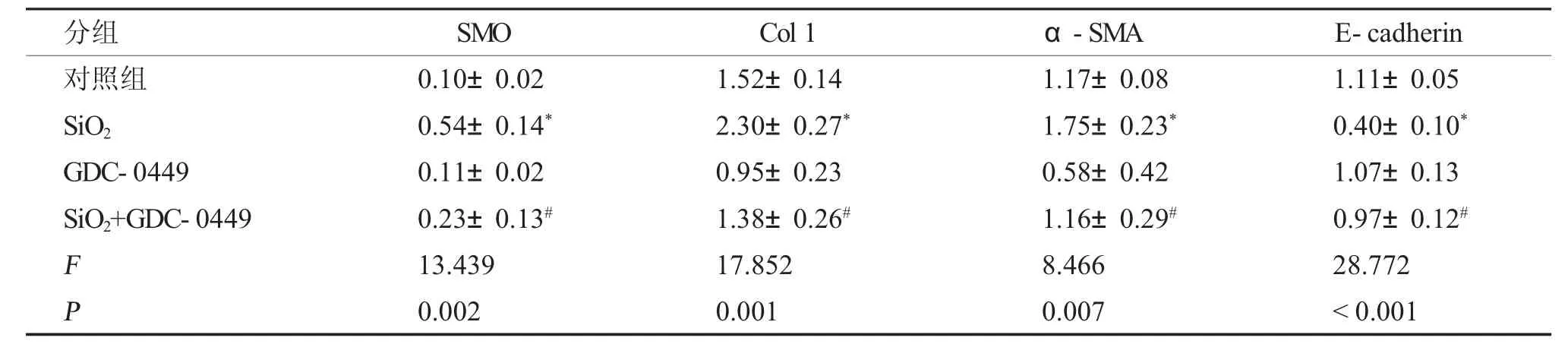
表1 GDC-0449 對SiO2 介導的MLE-12 細胞EMT 的調節作用()Tab.1 Effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells()
與對照組比較,*P <0.05;與SiO2 誘導組比較,#P <0.05。
表2 GANT61 對SiO2 介導的MLE-12 細胞EMT 的調節作用()Tab.2 Effect of GANT61 on SiO2 induced EMT of MLE-12 cells()
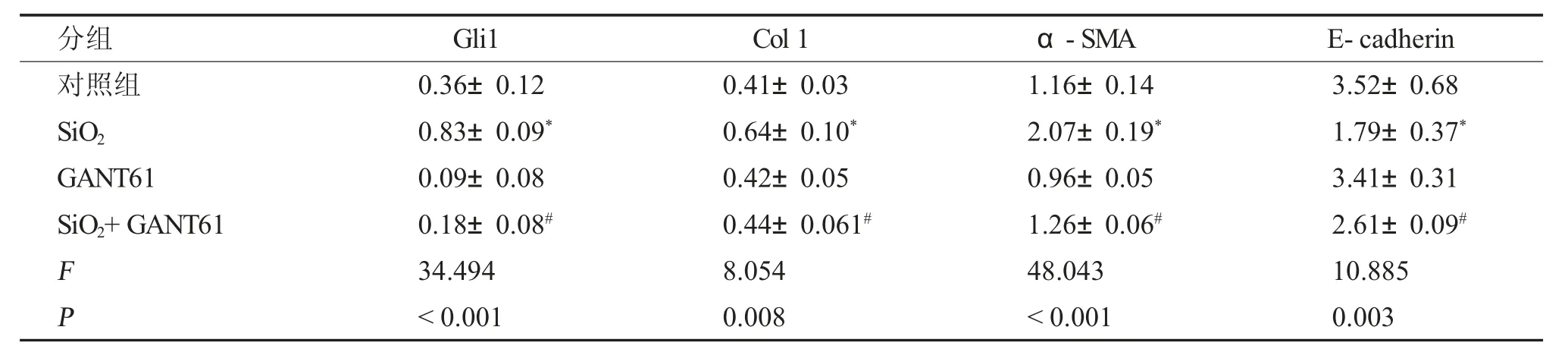
表2 GANT61 對SiO2 介導的MLE-12 細胞EMT 的調節作用()Tab.2 Effect of GANT61 on SiO2 induced EMT of MLE-12 cells()
與對照組比較,*P <0.05;與SiO2 誘導組比較,#P <0.05。
表3 Ac-SDKP 對SiO2 誘導的MLE-12 細胞Col I、α-SMA、E-cadherin 及HH 信號分子的影響()Tab.3 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2()
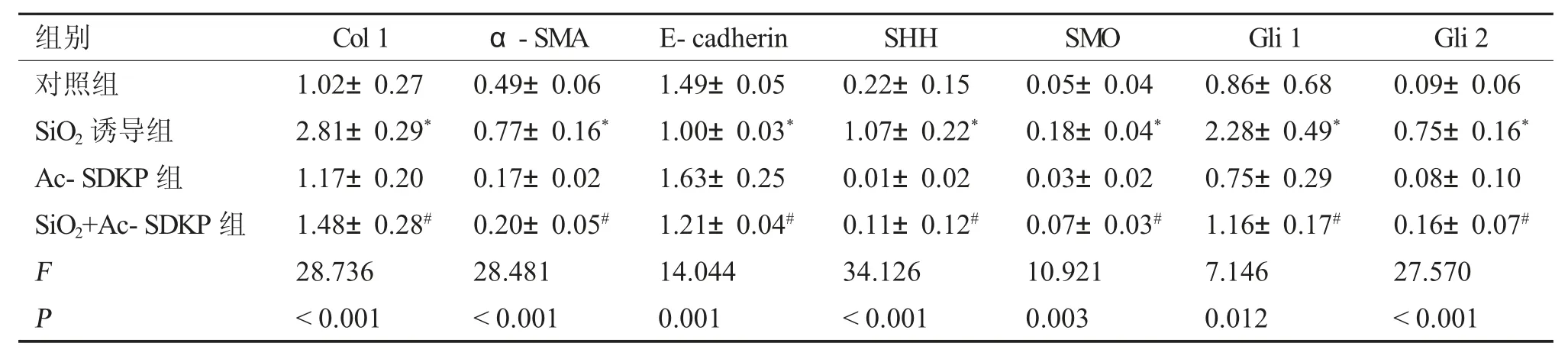
表3 Ac-SDKP 對SiO2 誘導的MLE-12 細胞Col I、α-SMA、E-cadherin 及HH 信號分子的影響()Tab.3 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2()
與對照組比較,*P <0.05;與SiO2 誘導組比較,#P <0.05。

圖1 GDC-0449 對SiO2 介導的MLE-12 細胞EMT 的調節作用Fig.1 The effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells
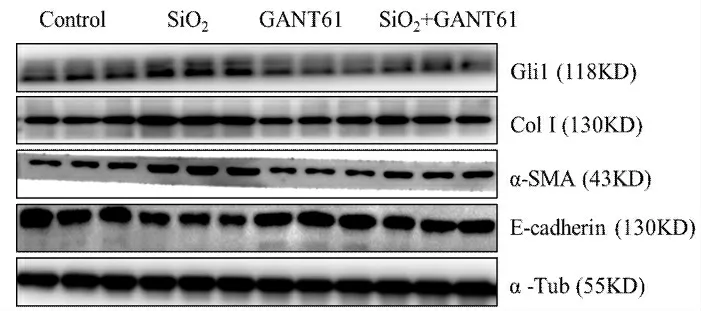
圖2 GANT61 對SiO2 介導的MLE-12 細胞EMT 的調節作用Fig.2 The effect of GANT61 on SiO2 induced EMT of MLE-12 cells
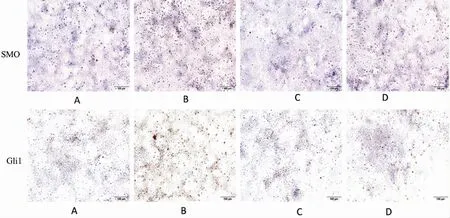
圖3 免疫組織化學檢測MLE-12 細胞中SMO 和Gli1 蛋白表達(×200)Fig.3 Expressions of SMO and Gli1 in MLE-12 cells were detected by immunohistochemistry (×200)
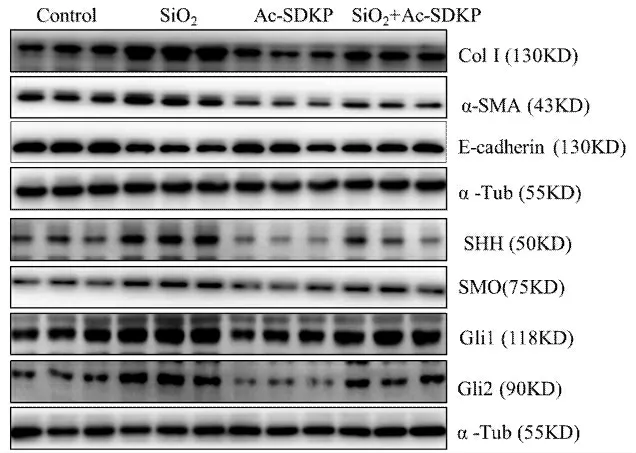
圖4 Ac-SDKP 對SiO2 誘導的MLE-12 細胞Col I、α-SMA、E-cadherin 及HH 信號分子的影響Fig.4 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2
近來研究也顯示,HH 信號在肺再生和維持中起到重要的調節作用[7],對HH 信號的阻斷也被發現具有拮抗肺纖維化形成的作用[8-9]。在本研究中,利用HH 信號SMO 受體抑制劑GDC-0449 和GLI轉錄因子抑制劑GANT61 來觀察對SiO2誘導的上皮間質轉化的影響,發現阻斷HH 信號能夠顯著抑制SiO2介導的MLE-12 的EMT 進程。有研究表明,GANT61 可以通過靶向性抑制Gli1 的表達上調E-cadherin,下調Vimentin,進而調控肺癌細胞的EMT 進程[10],在非小細胞肺癌中,采用針對Hedgehog 信號通路SMO 的特異性抑制劑能夠有效地逆轉肺癌細胞的EMT 現象[11]。落新婦苷被發現能夠通過對HH 信號的調節,抑制TGF-β1 誘導的肺泡II 型上皮細胞和L929 細胞的EMT 進程,上調E-cadherin、肺泡表面活性物質C 的表達,同時抑制α-SMA 和Snail 蛋白的表達,體內研究也發現能夠拮抗博來霉素小鼠的肺間質纖維化病變程度[8]。HH 信號的激活,能夠誘導肺常駐間質干細胞向肌成纖維細胞分化,從而加速的肺纖維化進程[9]。在本研究中,也發現SiO2能夠激活HH 信號,從而促進了MLE-12 細胞發生EMT,結合課題組前期研究結果[4],提示HH 信號的激活在矽肺纖維化進展中可能起到了重要的調控作用。
課題組多年來,圍繞Ac-SDKP 的抗矽肺纖維化作用進行了系列研究[1,2,4],前期已經證明矽肺進展伴發EMT 過程,而Ac-SDKP 能夠保護肺泡II型上皮細胞,同時抑制其向間質細胞轉化。本研究結果顯示,予以Ac-SDKP 預處理,能夠顯著抑制HH 信號相關蛋白的活化,進而抑制了EMT 的形成。提示Ac-SDKP 能夠通過對HH 信號的調節,拮抗SiO2介導的肺泡II 型上皮MLE-12 細胞的EMT 進程。

