激活肝內天然免疫治愈乙型肝炎的進展和新策略
黃葵源, 劉子英, 張小勇
南方醫(yī)科大學南方醫(yī)院 感染內科肝病中心, 廣州 510515
目前全球約有2.37億慢性HBV感染者,通過垂直感染的嬰兒中有80%以上發(fā)展為慢性乙型肝炎(CHB)[1]。目前CHB的治療藥物主要有IFNα和核苷(酸)類似物(NAs)兩類。雖然兩者均可在部分患者中獲得持續(xù)病毒學應答和肝臟組織學改善,延緩疾病進展,但只有極少部分患者達到CHB功能性治愈,并且大多數(shù)CHB患者在停藥后出現(xiàn)病毒反彈[2]。宿主免疫系統(tǒng)功能狀態(tài)是決定病毒清除與否的關鍵因素。隨著對CHB免疫致病機制的研究不斷深入,發(fā)現(xiàn)機體對HBV出現(xiàn)免疫耐受及免疫功能失調是導致HBV感染慢性化的主要原因之一。因此,基于激活CHB患者體內免疫系統(tǒng)從而清除HBV的免疫治療策略具有廣闊的應用前景。在HBV感染中,天然免疫系統(tǒng)不僅可以識別并抑制病毒復制,在調節(jié)HBV適應性免疫應答中也發(fā)揮著關鍵作用,因此激活宿主天然免疫應答可能是將來實現(xiàn)CHB功能性治愈的重要手段之一。
1 宿主肝內天然免疫系統(tǒng)在控制HBV感染過程中的作用
1.1 參與HBV天然免疫應答的天然免疫受體
天然免疫系統(tǒng)是宿主抵御病原微生物入侵的第一道防線。病原體相關分子模式(pathogen associated molecular patterns,PAMP)被病原體識別受體(pathogens recognition receptors, PRR)識別并啟動天然免疫應答[3]。PAMP主要為病原體特殊形式的核酸或細胞壁成分,在病原體進入細胞后或復制過程中被細胞的 PRR識別。PRR是細胞內特異識別結合各種PAMP的受體,主要包括Toll樣受體(TLR)和視黃酸誘導基因Ⅰ(retinoic acid induced gene Ⅰ,RIG-Ⅰ)樣受體(RLR)。這兩大類受體主要位于專職抗原提呈細胞,如巨噬細胞和樹突狀細胞的表面或內部,也廣泛表達于肝細胞和肝非實質細胞。
1.1.1 Toll樣受體(TLR) TLR在機體識別PAMP并激活天然免疫反應中發(fā)揮重要作用,TLR主要識別來自于病原體的脂類、蛋白質和核酸等,通過 MYD88 依賴性或非依賴性途徑啟動下游信號通路,促進免疫細胞分泌Ⅰ型IFN等細胞因子,發(fā)揮抗病毒作用[4]。研究[5]表明,與健康對照相比,急性HBV感染者血清中未檢測出較高的Ⅰ型IFN水平。對CHB患者外周血單個核細胞和肝細胞的研究[6]發(fā)現(xiàn)TLR3介導的先天免疫反應功能受損。Visvanathan等[7]也發(fā)現(xiàn)HBeAg陽性CHB患者的肝細胞、Kupffer細胞和外周血單個核細胞上TLR2的表達量低于HBeAg陰性患者,并且患者外周血中的漿細胞樣樹突狀細胞的TLR7/9表達量降低[8]。這些研究均表明HBV可削弱由TLR介導的天然免疫系統(tǒng)的抗病毒作用。
1.1.2 RIG-Ⅰ樣受體(RLR) 最近的研究[9]表明,受感染肝細胞內的胞質DNA/RNA感受器可以識別HBV核酸。RIG-Ⅰ與HBV前基因組RNA的ε莖環(huán)結合,誘導肝細胞表達大量Ⅲ型IFN,但是未檢測出其他與HBV先天免疫識別相關的炎性細胞因子,如IL-1β、IL-6和TNFα等。亦有研究[10]發(fā)現(xiàn),HBV DNA暴露于細胞質中時,胞質DNA感受器環(huán)鳥苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)可以識別dsDNA,進而催化合成環(huán)二核苷酸(cGAMP),cGAMP激活干擾素刺激因子(stimulator of interferon genes,STING),促進Ⅰ型IFN的表達。研究[11]發(fā)現(xiàn),破壞病毒的衣殼或影響HBV反轉錄酶的活性可以產生RNA-DNA雜化雙鏈,使HBV暴露于DNA傳感器并激活天然免疫。
1.2 參與HBV天然免疫應答的細胞類型及抗病毒效應
肝臟作為人體重要的免疫器官,其豐富的自然殺傷細胞(NK細胞)和巨噬細胞(如Kupffer細胞)是肝內天然免疫的主要防線。此外,肝細胞PRR介導的天然免疫應答在HBV感染初期以及慢性化過程中亦發(fā)揮著重要的作用。
1.2.1 NK細胞 NK細胞是抗HBV的重要天然免疫細胞,主要集中在肝竇內皮層,其表型和生物學功能均不同于外周血中的NK細胞。肝臟中的NK細胞主要分為CD56dimCD16+和CD56brightCD16+兩個亞群。CD56dimCD16+NK細胞主要通過穿孔素/顆粒酶介導的細胞毒性作用直接破壞HBV感染的肝細胞發(fā)揮抗病毒作用,其數(shù)量減少可能會導致HBV持續(xù)存在。而CD56brightCD16+NK細胞主要通過分泌IFNγ、TNFα、IL-10等細胞因子,參與調節(jié)樹突狀細胞、Kupffer細胞、T淋巴細胞、B淋巴細胞和內皮細胞的免疫應答[12]。在土撥鼠肝炎病毒(woodchuck hepatitis virus,WHV)急性感染模型中已證明NK細胞具有抗HBV活性[13],所以NK細胞介導的免疫應答可能是早期清除HBV的關鍵因素。但慢性HBV感染后NK細胞表型和功能都發(fā)生改變,研究[14]已證明,CHB患者的NK細胞在產生IFNγ等細胞因子及其介導的細胞毒作用方面存在功能缺陷。此外,NK細胞通過細胞毒作用或Fas/Fas配體相互作用清除感染HBV的肝細胞從而加重與HBV相關的肝損傷[15-16]。
1.2.2 單核(巨噬)細胞 單核細胞是重要的天然免疫細胞,可分化成樹突狀細胞和巨噬細胞。在免疫活躍的HBV感染者中,CD14+CD16+單核細胞數(shù)量有所增加,且增高幅度與ALT水平呈正相關,提示這類細胞可能參與肝臟炎癥和纖維化的形成[17-18]。 Kupffer細胞是一類定居于肝內的巨噬細胞,多聚集在肝竇,與肝竇內皮細胞一起構成肝臟抵御入侵病原體的第一道防線。Kupffer細胞表面表達多種TLRs和清道夫受體。在靜息狀態(tài)下,Kupffer細胞清除血液中的細菌產物,產生IL-10和TGFβ,促進調節(jié)性T淋巴細胞的擴增。當肝內出現(xiàn)炎癥時,可誘導單核細胞來源的炎性巨噬細胞在肝內聚集,從而打破肝臟免疫耐受環(huán)境,加劇肝內炎癥狀態(tài)。在高壓水動力法建立HBV轉染小鼠模型中,HBcAg可誘導Kupffer細胞TLR2表達上調和IL-10分泌增加,從而抑制HBV特異性T淋巴細胞應答[19]。Kupffer細胞也可通過清除抗病毒免疫反應中凋亡的肝細胞從而減輕肝內炎癥[20]。
1.2.3 樹突狀細胞 樹突狀細胞是機體最重要的抗原提呈細胞,分為前體期、未成熟期、遷移期和成熟期四個階段。前體期樹突狀細胞參與抗原的攝取、加工和提呈,進而激活機體的適應性免疫系統(tǒng)[21]。HBV可以抑制樹突狀細胞與NK細胞相互作用,從而抑制漿細胞樣樹突狀細胞誘導的NK細胞分泌IFNγ的功能[22]。同時,研究[23]發(fā)現(xiàn)CHB患者的樹突狀細胞抗原遞呈能力減弱,不能有效的將HBV抗原提呈至T淋巴細胞,導致T淋巴細胞活化障礙,從而機體出現(xiàn)針對HBV的免疫耐受狀態(tài)。
1.2.4 肝細胞 肝細胞是HBV入侵的主要宿主細胞,其通過表達多種PRRs介導天然免疫應答。此前研究[24]已證明,TLR2配體激活NF-κB、PI3K/Akt和MAPK信號通路的不同分支,誘導肝細胞產生炎癥因子。TLR2介導的先天免疫應答可分別降低HBV和WHV在HepG2.2.15細胞和土撥鼠原代肝細胞中的復制和基因表達。另一項研究[25]表明小鼠原代肝細胞高表達TLR3/4,在特異性配體刺激下,TLR信號通路活化并刺激肝細胞分泌炎癥因子,抑制HBV的復制。此外,RIG-1 可能是肝細胞識別HBV最重要的先天免疫傳感器[26],通過拮抗HBV聚合酶(P蛋白)與ε莖環(huán)的相互作用,從而抑制HBV復制。
1.3 參與HBV天然免疫的重要細胞因子
1.3.1 IL家族 IL-8能夠上調TNF相關的凋亡誘導配體(TNF related apotosis inducing ligand,TRAIL)的表達,在IL-8、IFNα存在的條件下,NK細胞可以通過TRAIL途徑誘導受感染肝細胞凋亡以減少病毒載量,但同時也導致肝損傷。在Fisicaro等[27]的研究中,發(fā)現(xiàn)在自限性感染者體內,早期IL-2的產生有助于宿主控制病毒和抗原清除,而IL-10的高表達可以抑制NK細胞的激活,從而增加HBV免疫逃逸的概率。
1.3.2 IFN家族 根據(jù)IFN氨基酸排列順序和特異性識別的受體不同將其分為Ⅰ型、Ⅱ型和Ⅲ型IFN。Ⅰ型IFN分為IFNα和IFNβ,參與機體的抗病毒反應與免疫調節(jié),它可以促進多種免疫細胞的抗病毒作用,同時也可直接抑制HBV的復制[28]。Ⅱ型IFN主要是IFNγ,是機體內主要的巨噬細胞刺激因子,能夠提高NK細胞和巨噬細胞的免疫活性。Ⅲ型IFN(IFNλ)與I型IFN的抗病毒機制相一致,但由于Ⅲ型IFN其受體分布的組織特異性及較少的副反應,使其在HBV的治療研究中也備受關注。
1.3.3 腫瘤壞死因子(TNF)α TNFα可以通過使含有病毒RNA和DNA的核衣殼及空的核衣殼去穩(wěn)態(tài)而迅速阻斷HBV的復制[29-30],也可以通過誘導HBV cccDNA脫氨基作用和降解來減少肝細胞內cccDNA的水平[31]。在小鼠HBV模型中,敲除TNFR1或者阻斷TNFα信號通路可使得HBV持續(xù)存在并引起T淋巴細胞功能耗竭,其中細胞凋亡抑制蛋白在TNFα促使細胞存活或死亡中起到關鍵作用,當小鼠使用cIAP分子拮抗劑后,TNFα可促進HBV感染的肝細胞凋亡,從而清除HBV[32]。
2 基于激活肝內天然免疫應答抑制HBV感染的策略
隨著對HBV相關天然免疫研究的不斷深入,激活肝內天然免疫應答已成為實現(xiàn)CHB功能性治愈的策略之一(圖1)。
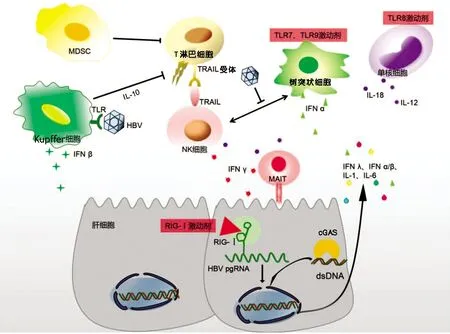
圖1 HBV相關的天然免疫以及激活天然免疫治療HBV的策略
2.1 靶向天然免疫細胞的治療策略 NK細胞在HBV感染相關的肝臟免疫微環(huán)境中發(fā)揮著多重作用。急性HBV感染時, CD56dimNK細胞在感染早期促進病毒清除[33],肝內NK細胞的募集和增殖在PEG-IFNα聯(lián)合NAs治療CHB中發(fā)揮重要作用[34],但TRAIL+NK細胞可導致HBV特異性T淋巴細胞死亡,有研究[35]表明TRAIL+NK細胞比例降低與HBV特異性T淋巴細胞比例增加相關。因此,阻斷TRAIL介導的信號通路而不影響NK細胞發(fā)揮抗病毒作用為CHB免疫治療提供了新思路。另外,骨髓來源的抑制性細胞(myeloid-derived suppressor cells,MDSC)是骨髓來源的一群異質性細胞,具有顯著抑制免疫細胞應答的能力。在腫瘤免疫治療中,已有大量研究聚焦于阻斷MDSC免疫抑制來增強T淋巴細胞功能。在CHB患者中,血清HBeAg可誘導MDSC的擴增,削弱T淋巴細胞細胞因子分泌以及增殖功能[36],靶向MDSC有可能成為CHB的治療方式之一,但由于MDSC在維持肝臟免疫微環(huán)境的穩(wěn)定中發(fā)揮著重要作用,需要更加深入的研究來評估靶向MDSC治療CHB的可行性。
2.2 細胞因子治療策略 目前IFNα治療僅能使部分CHB患者獲益,且體外試驗以及動物實驗表明HBV可以抑制IFNα介導的抗病毒作用[37],考慮到IFNα對機體其他器官的效應引起的副作用,靶向肝臟的IFNα治療值得進一步研究探索。近期研究[38]表明,通過設計融合IFNα的HBV特異性T淋巴細胞受體樣抗體,靶向HBV感染的肝細胞,從而使得IFNα高效特異的作用于感染的肝細胞,體外試驗結果顯示可顯著降低上清中HBsAg含量并可促進CXCL-10等趨化因子的分泌。PEG-IFNλ是一種長效Ⅲ型IFN,對天然免疫系統(tǒng)和適應性免疫系統(tǒng)均有調節(jié)作用,由于PEG-IFNλ受體表達局限于上皮來源的細胞如肝細胞并且較IFNα耐受性更好,患者有望從中獲益[39]。
2.3 PRR激動劑 大量研究表明,通過TLR激動劑激活機體天然免疫可以抑制HBV復制。HBV轉基因小鼠分別注射TLR3、TLR7/8或TLR9的配體可通過刺激Ⅰ型IFN分泌抑制HBV復制[40]。激活土撥鼠TLR7和TLR9可促進WHV清除[41]。激活單核細胞TLR所分泌的TNFα可以促進肝內淋巴細胞聚集并且發(fā)揮抗病毒作用[42]。當前,多種PRRs激動劑被證實在多種細胞模型和動物模型中發(fā)揮顯著的抗HBV效應,部分已經進入到臨床試驗(表1)。
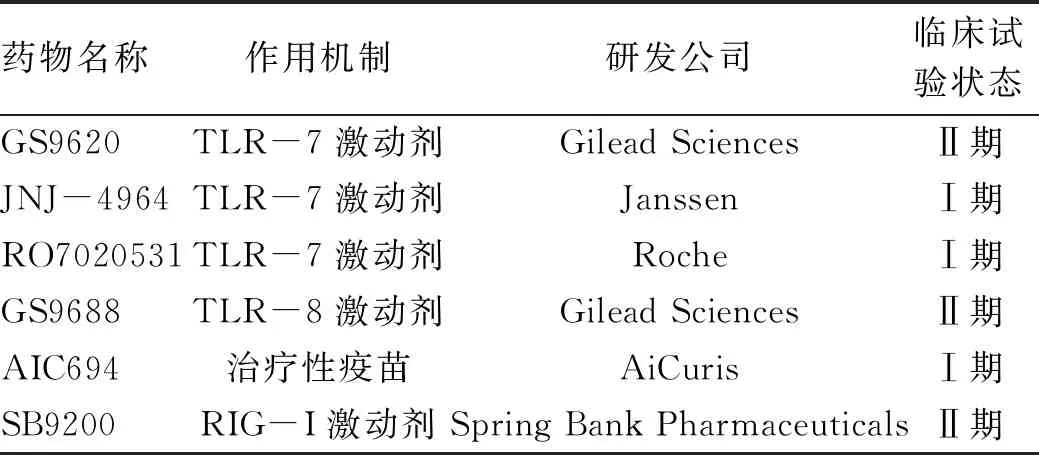
表1 激活天然免疫相關臨床試驗
在體外HBV感染細胞模型中,Gilead公司研發(fā)的TLR7激動劑GS-9620無直接的抗病毒作用,但可通過促進天然免疫細胞(以樹突狀細胞為主)分泌Ⅰ型IFN、增強肝細胞對HBV抗原肽的抗原提呈功能、促進針對HBV的適應性免疫應答,從而抑制HBV復制[43]。在黑猩猩HBV感染模型中,口服GS-9620可以促進肝臟和外周血IFN刺激基因的表達,增加外周血中IFNα的含量,降低血清HBV DNA和HBsAg[44]。在一項多中心、雙盲、隨機、安慰劑對照的Ⅱ期臨床試驗中,共納入192例CHB患者進行GS-9620聯(lián)合替諾福韋酯治療,研究結果表明GS-9620具有良好的安全性,對IFN刺激基因15和IL-12的誘導呈現(xiàn)劑量依賴性,但是未觀察到其對HBsAg和HBV DNA的影響[45]。Janssen公司研發(fā)的TLR7激動劑JNJ-4964在CHB小鼠模型中實驗發(fā)現(xiàn),所有小鼠在連續(xù)治療14 d后HBV DNA和HBsAg均低于檢測下限,連續(xù)治療21 d后可檢測到抗-HBs,在觀察終點前未出現(xiàn)HBV DNA和HBsAg的反彈,JNJ-4964還可促進HBsAg特異性的T淋巴細胞和B淋巴細胞反應[46],目前JNJ-4964正在開展Ⅰ期臨床試驗。在腺相關病毒-HBV小鼠模型中,Roche公司研發(fā)的TLR7激動劑RO7020531聯(lián)合HBV核衣殼抑制劑可顯著降低血清中HBV DNA和HBsAg水平,至隨訪終點前可見HBV DNA和HBsAg的輕微反彈,RO7020531主要是刺激小鼠脾和淋巴結中的Ⅰ型IFN的免疫應答,其抗病毒作用呈現(xiàn)出劑量依賴性[47]。
TLR8主要表達于髓系細胞中,激活TLR8可促進肝內單核細胞/巨噬細胞分泌IL-12和IL-18,這些細胞因子可以促進肝內駐留的黏膜相關恒定的T淋巴細胞和NK細胞分泌大量的IFNγ[48]。由Gilead公司研發(fā)的TLR8激動劑GS9688在土撥鼠HBV模型中表現(xiàn)出較好的抗病毒作用,3 mg/kg,口服給藥,1次/周,連續(xù)8周給藥后,可觀察到WHV cccDNA、DNA和RNA均出現(xiàn)下降,部分試驗動物出現(xiàn)抗WHsAg抗體[49]。GS9688體外刺激CHB患者外周血單個核細胞后,可促進其分泌細胞因子如TNFα、IL-12p70等,激活CD56+NK細胞,下調經典的Treg細胞頻數(shù),但是對于HBV特異性的T淋巴細胞的頻數(shù)沒有影響,目前GS9688正在進行 Ⅱ 期臨床試驗[50]。
TLR9激動劑CpG主要通過誘導漿細胞樣樹突狀細胞分泌IFNα。在土撥鼠乙型肝炎模型中,CpG聯(lián)合恩替卡韋顯著降低WHV DNA,WHsAg低于檢測下限[51]。AIC694是一種靶向抗原遞呈細胞的TLR9激動劑,在土撥鼠乙型肝炎模型中,AIC694聯(lián)合恩替卡韋后WHV DNA和WHsAg平均下降水平分別達到7.6 log和4.1 log,部分動物體內WHsAg低于檢測下限,AIC649還可促進WHV特異性T淋巴細胞的功能以及表面抗體的產生[52]。在目前公布的Ⅰ期臨床試驗的結果中,AIC649顯示出良好的安全性,可激活天然免疫系統(tǒng)產生IL-1β、IL-6、IL-8、IFNγ并且下調IL-10,促進CD4+細胞中效應性和記憶性T淋巴細胞的分化,大部分受試對象出現(xiàn)HBeAg血清學轉換,少數(shù)患者HBsAg水平持續(xù)降低并出現(xiàn)短暫的抗-HBs[53]。
TLR3激動劑Riboxxol,是一種50 bp大小的雙鏈RNA。在人肝臟原代細胞感染HBV體系中,Riboxxol可持續(xù)的抑制HBV復制,顯著降低cccDNA載量[54],目前仍需要大量的臨床前研究來評估其藥效。
RIG-Ⅰ主要通過識別5′端帶有三磷酸化的短鏈dsRNA或ssRNA促進Ⅰ型IFN產生,Spring Bank公司研發(fā)的RIG-Ⅰ激動劑SB9200可激活病毒識別RIG-Ⅰ和核苷酸結合寡聚化結構域樣蛋白2,從而使得在病毒感染的細胞中產生IFN介導的抗病毒反應,SB9200還可阻斷HBV聚合酶的功能,直接抑制病毒復制[55]。在WHV模型中,口服SB9200可以降低WHV DNA及表面抗原水平并且呈劑量依賴性,使得肝臟以及血液中Ⅰ型IFN和IFN刺激基因的表達量長時間維持在較高水平,并且口服SB9200后肝內的RIG-Ⅰ蛋白表達水平也增高[56]。在Ⅱ期臨床試驗中,與安慰劑組相比,SB9200可以降低CHB患者體內HBV DNA載量并且呈劑量依賴性,在治療12周后,SB9200治療組22%的受試者血清HBsAg下降>0.5 log,其中血清HBsAg下降最大達到1.4 log[57],但由于該藥在Ⅱb期臨床試驗出現(xiàn)重度不良反應事件,目前Spring Bank公司決定停止SB9200用于CHB治療的研發(fā)。
STING可通過cGAS來識別細胞質中DNA[58]。研究[59]表明肝細胞中不表達STING,STING主要表達于肝臟非實質細胞如巨噬細胞等,在人源化肝嵌合體小鼠中,HBV感染可抑制cGAS表達,減弱cGAS-STING通路抗病毒作用,而在HepG2-NTCP中過表達cGAS激活cGAS-STING通路可抑制HBV復制及降低cccDNA載量[60]。在高壓水動力法建立HBV轉染小鼠模型中,腹腔注射STING激動劑DMXAA可誘導巨噬細胞分泌Ⅰ型IFN,促進IFN刺激基因表達,抑制HBV復制[61]。
3 小結與展望
激活天然免疫不僅可以抵抗HBV感染,對于啟動HBV特異的適應性免疫應答也是至關重要的,HBV感染引起的天然免疫應答低下可能是病毒持續(xù)感染的重要原因。目前關于天然免疫激動劑的臨床試驗中,雖然在臨床前動物實驗中可以觀察到HBV DNA以及抗原水平顯著降低,但是在臨床試驗中表現(xiàn)出的抗病毒作用有限,可能由于大部分天然免疫激動劑為口服給藥,腸道、肝臟和腸道菌群之間相互作用可能會影響它們的療效。此外,天然免疫系統(tǒng)激活可能導致細胞因子大量釋放,引起不良反應,因此,免疫治療的安全性問題應引起重視。目前有大量的研究聚焦于肝臟免疫微環(huán)境,這對闡明肝臟免疫微環(huán)境作用機制及探索天然免疫治療新策略有極大的幫助。在現(xiàn)有抗病毒治療的基礎上,針對宿主的個體化的免疫調節(jié)治療是實現(xiàn)CHB功能性治愈的重要策略。

