肝細胞移植治療肝硬化合并小肝綜合征大鼠模型的效果觀察
賈 磊, 溫欣慰, 李海洋,2
1 貴州醫科大學, 貴陽 550004; 2 貴州醫科大學附屬醫院 肝膽外科, 貴陽 550004
Effect of hepatocyte transplantation in treatment of rats with liver cirrhosis and small-for-size syndrome
JIALei,WENXinwei,LIHaiyang.
(GuizhouMedicalUniversity,Guiyang550004,China)
Keywords:cell transplantation; liver cirrhosis; small-for-size syndrome
小肝綜合征是指接受擴大肝切除或減體積肝移植術后,部分患者可能發生肝移植物或殘余肝臟不能滿足受者的功能需要,導致繼發肝功能障礙,甚至合并肺、腎衰竭,其實質上屬于急性肝衰竭[1]。雖然評估肝臟儲備功能及預防術后肝衰竭發生風險的方法很多,但均存在臨床應用缺陷[2],目前尚無有效的手段對該并發癥進行預防和治療。因此目前臨床迫切需要一種合理、有效的方法來治療小肝綜合征。
肝細胞移植作為一種新的方法和手段,在治療嚴重肝臟疾病和急性肝功能損害方面越來越受到人們的關注。目前對于該治療的焦點主要集中在肝臟先天性代謝疾病、各種藥物、毒物、病毒引起的急(慢)性肝功能衰竭上,對于肝臟切除后引起小肝綜合征造成的急性肝衰竭鮮有報道。本研究使用合并肝硬化的大鼠進行大部分肝臟切除,使得動物模型更接近臨床病例,觀察肝細胞移植對肝硬化合并小肝綜合征的治療效果。
1 材料和方法
1.1 實驗動物 雄性SD大鼠,體質量200~250 g,SPF級,購自遼寧長生生物技術股份有限公司,許可證號:SCXK(遼)2015-0001。實驗場地:貴州醫科大學附屬醫院臨床研究中心,許可證號:SYXK(黔)2015-005。所有動物飼養在恒溫21 ℃、70%濕度環境中,消毒飼料喂養,飲用5%~10%乙醇,晝夜照明時間為12 h。本研究方案經由貴州醫科大學實驗動物倫理委員會審批(批號:1901079),符合實驗室動物管理與使用準則。
1.2 試劑和儀器 四氯化碳(分析純,天津市風船化學試劑科技有限公司),紅星二鍋頭(乙醇濃度56%,市售)。Ⅳ型膠原酶(中國Solarbio公司,貨號:C8160),DMEM高糖培養基(美國Gibco公司,貨號:8119081),無鈣鎂D-Hanks液(中國Solarbio公司,批號:H1045-500),Hanks液(中國Solarbio公司,貨號:H1015-500)。臺盼藍溶液(中國Solarbio公司,貨號:c0040),EDTA(中國Solarbio公司,超純級,批號:524J051)。ALT測試盒( 南京建成科技有限公司,貨號:C009-2)、AST測試盒(南京建成科技有限公司,貨號:C010-2)、Alb測試盒(南京建成科技有限公司,貨號:A028-1)。蠕動泵(上海滬西分析儀器廠有限公司,型號:BT-100),倒置顯微鏡(德國Leica公司)。
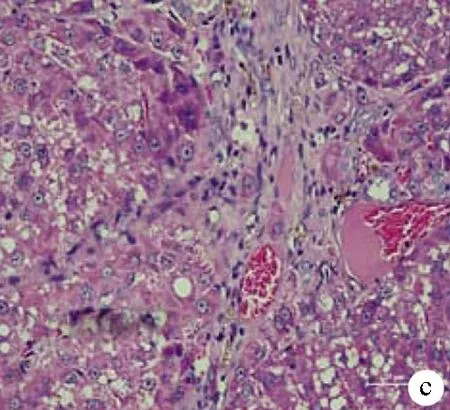
1.3 肝硬化大鼠模型的建立 雄性SD大鼠40只,按0.2 ml/100 g背部多點皮下注射分析純四氯化碳,每周2次,開始予5%乙醇(二鍋頭+滅菌蒸餾水)為唯一飲水源,2周內逐漸增加濃度至10%,持續時間14周,建模過程中死亡4只大鼠。14周后隨機解剖2只大鼠,觀察成模情況。肝臟肉眼觀:體積縮小,質地變硬,表面凹凸不平,可見大小不等結節(圖1a)。肝臟組織HE染色病理切片:纖維組織增生,正常肝小葉結構消失,被增生的纖維結締組織分割成大小不等的假小葉,中央靜脈偏曲、消失,肝細胞片狀壞死(圖1b、c)。認為整批大鼠建模成功,停藥1周后開始手術。
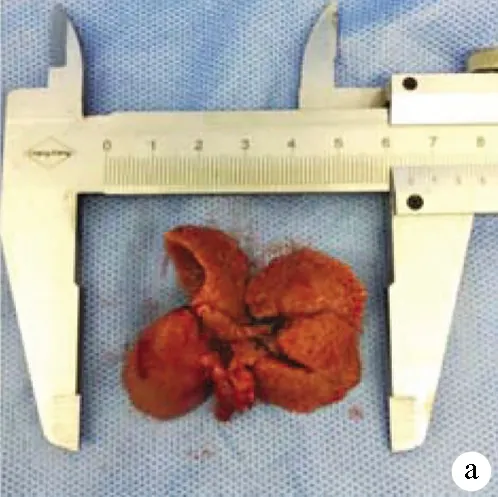

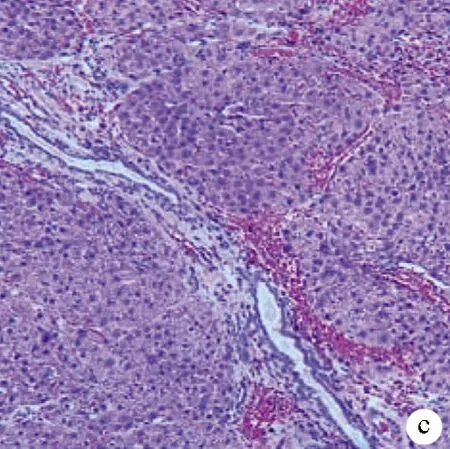
注:a,肝臟大體標本;b、c,肝組織病理檢查(HE染色,×100)。
圖1肝硬化大鼠肝臟大體和病理標本
1.4 原代肝細胞的分離
1.4.1 分離前準備 配制含0.01%EDTA的D-Hanks溶液及含0.05%Ⅳ型膠原酶的Hanks液預溫37 ℃。蠕動泵接7.5號輸液器,用預溫的D-Hanks液排出管內空氣待用。
雙氣泡圖的對比運用到更高層次的思維技能。在課堂上,教師可通過雙氣泡圖設計練習題,讓學生上臺訓練,學生也可通過雙氣泡圖來整理復習相關事物的異同點,如分子與原子的異同點。
1.4.2 肝臟灌注 參照SEGLEN兩步灌注法并略有改動,取正常SD大鼠1只,10%水合氯醛按0.2 ml/100 g腹腔注射麻醉,將大鼠仰臥位固定于超凈工作臺上,消毒術區,“十”字切口入腹,門靜脈下方置線備用,以準備好的輸液器穿刺入門靜脈,并用預置好的線固定,打開蠕動泵以20 ml/min速度灌注D-Hanks液,可見肝臟逐漸膨脹,剪斷下腔靜脈,繼續灌注,待下腔靜脈流出清涼液體后改換含0.05%Ⅳ型膠原酶的Hanks液繼續以20 ml/min速度灌注,待肝臟表面有滲液,彈性明顯降低時提示灌注完畢(圖2a)。
1.4.3 肝細胞的分離及純化 完整取下已灌注好的肝臟,放入盛有20 ml含膠原酶的Hanks液的無菌培養皿中,撕開肝臟包膜,用平鑷輕輕刮下肝臟細胞,200目的濾網濾去殘余結締組織,肝細胞濾液以500 r/min、4 ℃低速離心2 min,去上清液,加入適量DMEM培養液再次予500 r/min速度離心2 min,此過程重復3次得到純凈的肝實質細胞(圖2b)。
1.4.4 肝細胞活率測定 反復吹打混勻純凈的肝細胞,取80 μl細胞懸液+20 μl臺盼藍溶液混合,靜置1 min后,用血細胞計數盤顯微鏡下計數,細胞藍染的為死亡的肝細胞,得到活率>95%的肝實質細胞(圖2c、d)。
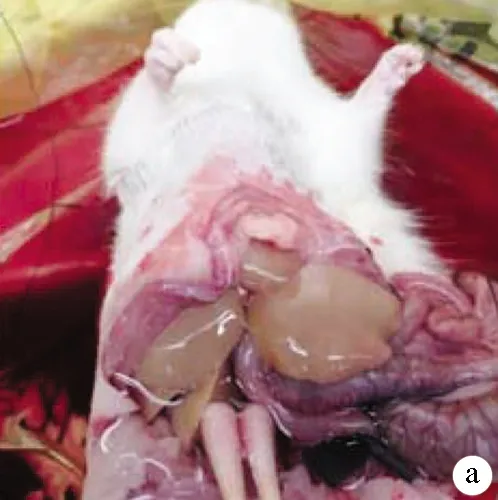
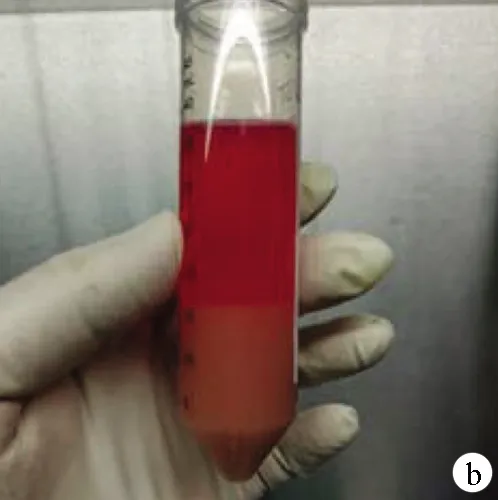
注:a,灌注好的肝臟;b,新鮮肝細胞懸液;c,鏡下肝細胞;d,臺盼藍染色的肝細胞。
圖2肝臟的灌注及肝細胞的分離
1.5 肝硬化大鼠肝細胞移植
1.5.1 大鼠分組 從肝硬化大鼠中隨機抽取30只,隨機分為A、B、C 3組,每組10只。A組:手術前3 d腹腔注入新鮮肝細胞1×108個細胞。B組:手術時腹腔注入新鮮肝細胞1×108個。C組:不進行肝細胞移植處理。
1.5.2 小肝綜合征的建立 70%肝臟切除:10%水合氯醛按0.2 ml/100 g行腹腔麻醉,待麻醉生效后,大鼠仰臥位置于超凈工作臺中的手術臺上,碘伏酒精消毒術區,正中切口入腹,切除肝左外葉、左內葉及右葉,術畢腹腔注射青霉素20萬單位。術后3 d飲用10%葡萄糖水,自由飲食。
1.5.3 血清學檢查及HE染色 分別于術后12、24、72、120、168、240 h斷尾取血,根據試劑盒說明書分別檢測ALT、AST、Alb水平。用多聚甲醛固定肝組織,石蠟包埋,切片,HE染色。
2 結果
2.1 3組大鼠生存率比較 A組大鼠術后死亡1只,生存率為90%,死亡時間節點為術后8 h。B組大鼠術后死亡5只,生存率為50%,死亡節點為術后6、7、13、20、40 h。C組死亡7只,生存率為30%,死亡時間節點為術后3、7、11、20、22、25、35 h。死亡大鼠均行尸體解剖排除出血、腸漏等引起的死亡。3組生存率差異有統計學意義(χ2=6.440,P=0.04)。
2.2 3組大鼠肝生化比較 分別于術后12、24、72、120、168、240 h斷尾取血查ALT、AST、Alb水平。3組大鼠術前即存在輕度的肝損傷,表現為ALT、AST輕度上升、Alb輕度下降,但各指標3組之間差異均無統計學意義(P值均>0.05),結合肝組織病理學檢查提示各組大鼠肝硬化水平一致。術后24 h ALT、AST逐漸升至頂峰,Alb下降至最低值,其后各組指標逐漸好轉。術后各時間節點各指標3組之間比較,差異均有統計學意義(P值均<0.05),A組的恢復情況均有好于B、C兩組的趨勢,但進一步兩組之間比較,部分時點存在無統計學差異的情況,考慮與術后肝功能恢復的個體差異性有關(表1,圖3)。
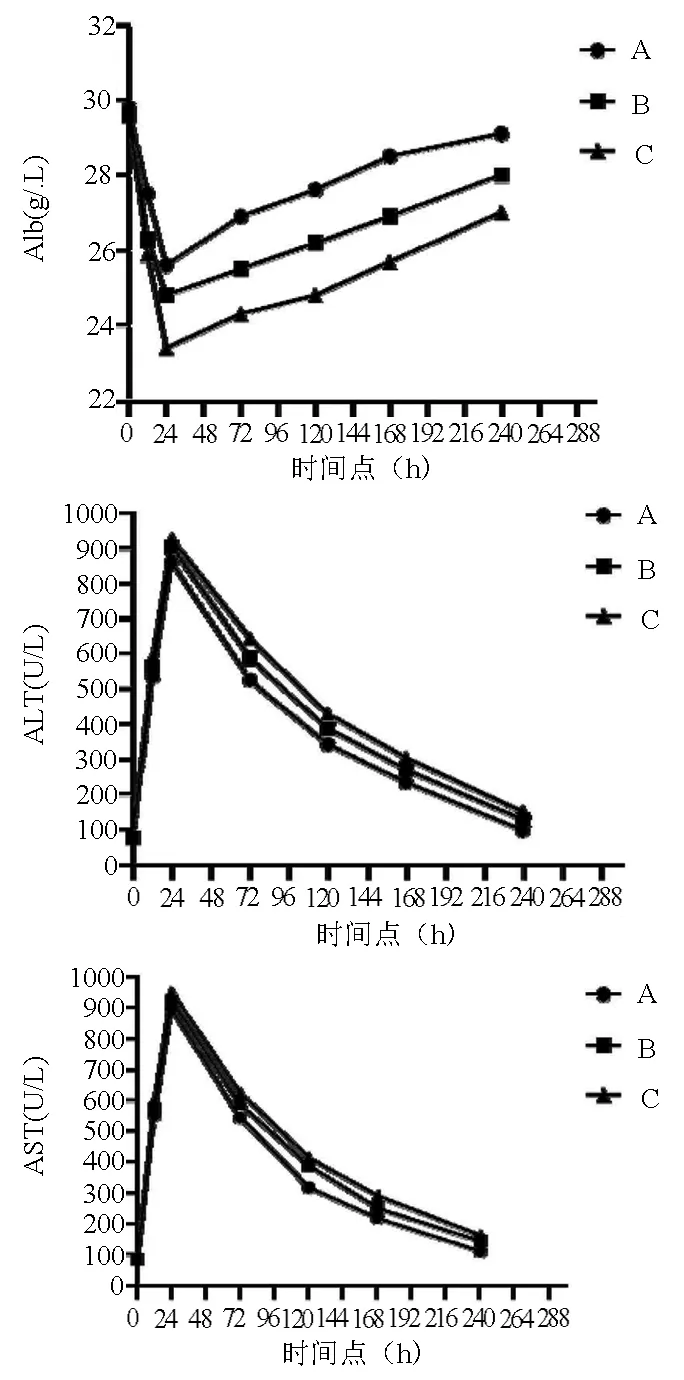
圖3 3組之間ALT、AST、Alb水平在不同時間點的比較

表1 3組大鼠各時間點ALT、AST、Alb水平比較
2.3 3組大鼠肝組織學情況 術后72 h每組隨機抽取1只大鼠處死行肝臟組織學檢查。A組大鼠可見肝細胞水腫,少許氣球樣變及炎細胞浸潤(圖4a)。B組見肝細胞排列紊亂,嚴重水腫,肝臟點狀壞死(圖4b)。C組見肝索消失,大片肝細胞嚴重水腫,變性壞死,呈空泡狀改變,大量炎細胞浸潤(圖4c)。


注:a,A組;b,B組;c,C組。
圖43組大鼠術后72h肝臟病理組織學檢查(HE染色,×200)
3 討論
肝細胞移植是將正常的肝細胞體外進行分離、處理,然后植入受體體內,重建肝臟組織結構,恢復肝功能的一種技術。它被認為是原位肝移植有希望的替代治療,用于包括急性肝衰竭和代謝性肝病在內的多種疾病。與原位肝移植相比,它有較小的侵入性、并發癥和死亡風險,并且可以重復進行[3]。該技術目前的治療焦點主要集中于肝臟先天性代謝性疾病,如Crigler-Najjar綜合征、家族性高膽固醇血癥、尿素代謝障礙等[4],對于此類疾病,目前認為該治療方法可在短期內改善肝臟代謝,改善臨床癥狀,但無法達到長期治療效果,故對于代謝性疾病,目前肝細胞移植多作為在等待原位肝移植過程中的過渡性治療[5]。對于急性肝衰竭的治療目前的共識是可以通過細胞治療,特別是肝細胞移植中受益[6]。有動物實驗[7]結果表明,少量肝細胞移植即可對肝功能的改善產生深遠影響,并顯著增加急性肝衰竭動物的存活率。移植途徑的選擇優先選擇門靜脈,但對于肝臟結構改變的疾病如肝硬化,推薦脾臟途徑,腹腔因為其容量大、易于操作而成為異位肝細胞移植的優選場所之一[8]。
小肝綜合征的臨床癥狀并無特異性,需要結合臨床、實驗室和組織病理學評估來診斷[9-11],主要的特征為術后肝功能障礙,伴有膽汁淤積和凝血功能障礙、門靜脈高壓癥和腹水,生化特征包括轉氨酶和膽紅素水平升高[12]。殘肝體積較小是術后肝衰竭的獨立危險因素,當術后標準殘肝體積<250 ml/m2時患者發生肝衰竭的概率為38%。因此應針對不同患者具體病情采取個體化治療方案,選擇合適手術方式,對預防肝切除術后肝衰竭發生至關重要[13]。在行擴大肝切除的患者,目前的共識是肝功能良好的情況下至少保留正常肝組織的30%,合并有肝硬化的患者,至少保留原肝組織的50%,而對于肝功能受損的患者,則需保留更多甚至不適宜行肝切除[14-15]。目前對于擴大肝切除引起的小肝綜合征,多采取護肝藥物、人工肝、血液超濾等治療,但效果欠佳,而對于肝移植造成的小肝綜合征通常需再次進行移植。
原發性肝癌是目前我國第4位的常見惡性腫瘤及第3位的致死性腫瘤,嚴重威脅我國人民的生命和健康,手術切除是肝癌治療的首選[16],相較于歐美,我國肝癌患者多合并有肝硬化,且以大肝癌為主,進一步造成了術后小肝綜合征肝衰竭的發生。筆者前期先制作了肝硬化的大鼠模型,在此基礎上進行大部分肝臟切除(70%),造成小肝綜合征急性肝衰竭,使動物模型更接近于我國患者的臨床特點。本研究顯示,術前行肝細胞移植的大鼠生存率明顯高于其他兩組,且肝功能的恢復情況也好于其余兩組,但進行兩組間比較時部分時間節點的組別并無明顯統計學差異,僅有好轉趨勢,考慮與樣本量較小有關及個體恢復差異有關。由此認為:肝細胞移植可有效促進肝硬化術后小肝綜合征的肝功能恢復及提高生存率;細胞移植的時間也影響了肝細胞移植的治療效果。
綜上所述,肝細胞移植治療肝硬化合并小肝綜合征療效確切,該實驗不僅在適應證上增加了肝細胞移植的范圍,也為臨床上治療肝切除術后小肝綜合征提供了一種新的方法。

