基于TCGA數據庫分析CCDC34基因在肝細胞癌中的表達及意義
向曉輝, 毛 駿, 李 海
1 天津市西青醫院 消化內科, 天津 300380; 2 天津市肝臟胰腺纖維化與分子診療重點實驗室, 天津 300162;3.武警后勤學院, 天津 300309
肝細胞癌作為常見的消化系統惡性腫瘤之一,多數患者早期可無任何癥狀,少數可出現腹痛、發燒、嗜睡等癥狀,臨床表現集中發生在疾病的晚期[1-2]。全球僅2018年統計新發病例達84.1萬例,死亡78.2萬例,且易患人群呈年輕化趨勢[3]。目前臨床上肝細胞癌患者的遠期生存率不甚理想,其高病死率很大程度上與腫瘤確診時間晚、轉移發生早相關[4-5]。卷曲螺旋結構域(coiled-coil domain-containing protein,CCDC)蛋白家族是一種由兩個或兩個以上的卷曲螺旋結構域組成的同寡聚體或寡聚體序列蛋白,可通過基因轉錄、介導細胞凋亡、調控細胞周期等多種途徑參與腫瘤的發生發展過程[6]。近年來越來越多研究[7-10]發現,CCDC蛋白在甲狀腺癌、肺癌、胰腺癌、結腸癌等多種惡性腫瘤的發生發展過程中發揮著重要作用。蛋白家族成員CCDC34又稱為腎臟癌抗原NY-REN-41,由373個氨基酸組成,位于11p14.1染色體[11]。目前,CCDC34基因與肝細胞癌的相關性研究尚不深入,本研究擬基于癌癥基因組圖集(the cancer genome atlas,TCGA)數據庫探討CCDC34基因在肝細胞癌組織中的表達情況及其臨床意義,以期為肝細胞癌提供新的診斷標志物和治療靶點。
1 資料與方法
1.1 數據來源 自 TCGA數據庫(https://cancergenome.nih.gov/)下載了374例肝細胞癌組織樣本和50例癌旁組織樣本的mRNA表達譜及臨床數據,其中370例患者具有匹配的mRNA表達譜和生存數據。
1.2 數據處理與患者分組 下載edge R軟件包(http://www.bioconductor.org/packages/release/bioc/html/e
dgeR.html),對mRNA原始數據進行基于加權截尾均值化M值標準化處理,并經log2轉換后用于后續分析[12-13]。基于肝細胞癌患者CCDC34基因表達譜和隨訪數據,根據X-tile 3.6.1軟件 (Yale University School of Medicine,New Haven,CT,USA)確立最佳分組截斷值。取最佳截斷值9.30將其分為高表達組(90例)和低表達組(280例)。
1.3 基因集富集分析 使用基因集富集分析(gene set enrichment analysis,GSEA)軟件研究CCDC34基因表達水平與京都基因和基因組百科全書通路基因集的相關性[14-16]。根據CCDC34基因的表達水平建立連續表型,按默認加權富集統計(default weighted enrichment statistic)的方法計算CCDC34基因與參照基因集的Pearson相關系數,并按照相關系數大小進行基因排序。設置隨機組合次數為1000次,計算富集系數(enrichment score,ES)和標準化后的富集系數(normallized enrichment score,NES),以標準化P<0.01且錯誤發現率(false discovery rates,FDR)<0.05為顯著性富集。
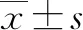
2 結果
2.1 CCDC34基因在癌組織和癌旁組織中的差異表達 在TCGA庫中,CCDC34基因在患者癌組織和癌旁組織的表達水平分別為8.732±0.987和7.236±0.647,差異有統計學意義(t=-14.261,P<0.001);在同一患者的癌組織和癌旁組織的表達水平分別為8.853±1.008和7.236±0.647,差異亦有統計學意義(t=-11.194,P<0.001)(圖1)。

注:a,TCGA庫肝細胞癌患者癌組織和癌旁組織中CCDC34基因的差異表達;b,同一患者癌組織和癌旁組織中CCDC34基因的差異表達。
圖1CCDC34基因在患者癌組織和癌旁組織中的表達水平
2.2 腫瘤組織中CCDC34基因表達水平與臨床病理指標的關系 對TCGA庫中數據統計列表分析,CCDC34基因的表達水平在TNM分期和腫瘤分級之間差異均有統計學意義(P值均<0.05),而在患者年齡、性別、有無肝纖維化和有無血管浸潤等指標之間差異均無統計學意義(P值均>0.05)(表1)。
2.3 CCDC34基因與肝細胞癌患者預后的相關性 CCDC34基因高表達患者總生存期顯著低于低表達患者(χ2=21.716,P<0.001),提示CCDC34基因高表達在肝細胞癌中是一項預后不良的因素(圖2)。單因素Cox回歸分析提示,CCDC34基因表達水平和TNM分期與肝細胞癌患者總生存期有關(P值均<0.001)。多因素Cox回歸分析進一步提示,上述兩項指標是影響肝細胞癌患者總生存期的獨立危險因素(P值均<0.05)(表2)。
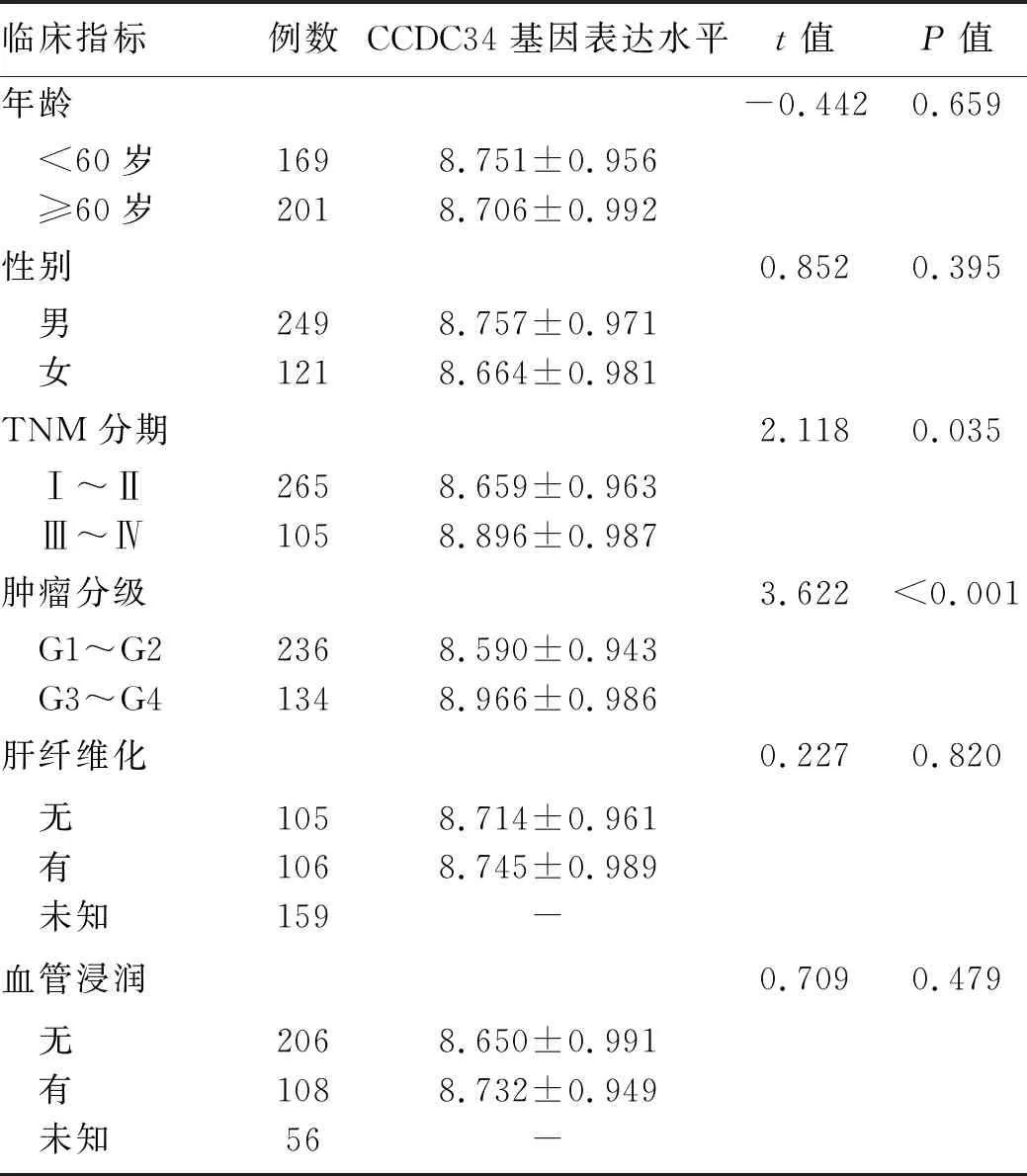
表1 CCDC34基因表達水平與肝細胞癌患者臨床病理指標的關系
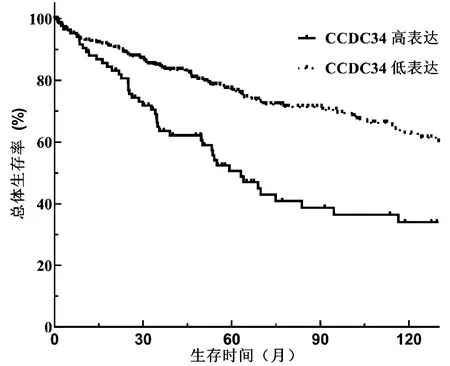
風險人數
高表達n=90n=20n=7n=0n=0
低表達n=280n=89n=35n=9n=1
圖2CCDC34基因表達水平和肝細胞癌患者生存時間的關系
2.4 CCDC34基因功能富集分析 在TCGA庫中的數據分析顯示,CCDC34基因高表達樣本富集到堿基切除修復、剪接體、核苷酸切除修復、嘧啶代謝、DNA復制、同源重組、細胞周期、錯配修復等8個相關通路基因集(P<0.01,FDR<0.05),提示CCDC34基因可能通過上述通路發揮促進腫瘤發生發展的作用(表3,圖3)。
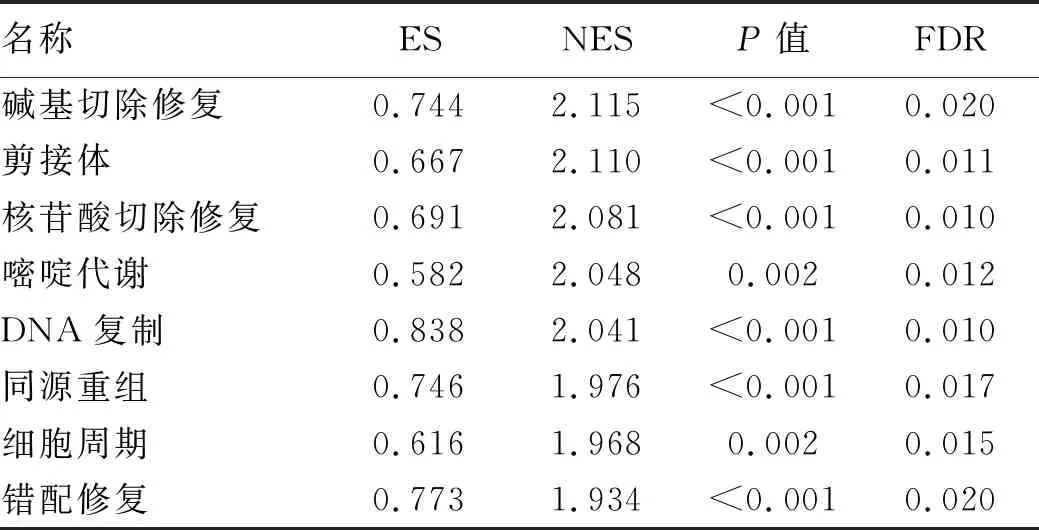
表3 CCDC34基因正相關的肝細胞癌樣本富集的通路基因集
3 討論
近年來越來越多的研究開始關注CCDC蛋白家族在腫瘤中的作用,研究報道CCDC蛋白的表達異常可能通過調節細胞骨架的重排,從而促進腫瘤細胞的運動與遷移[17-18]。CCDC34蛋白作為CCDC蛋白家族中的一員,其在腫瘤中的潛在臨床價值也被日益重視。Geng等[19]報道CCDC34蛋白可能通過抑制癌細胞的凋亡和促進侵襲來促進結直腸癌的發生發展。另有研究[20]證實,CCDC34蛋白在食管鱗癌中過表達,其與腫瘤進展、血管生成和不良的存活率有關,并且可用作指示患者預后不良的獨立參數。探討CCDC34基因與肝細胞癌預后的相關性及其臨床價值無疑將有利于肝細胞癌的個體化診斷,從而為臨床提供潛在的新治療靶點。
本研究著重探討CCDC34基因與肝細胞癌的相關性及其臨床價值,借助TCGA數據庫CCDC34基因 mRNA表達譜證實,CCDC34基因在肝細胞癌組織中mRNA表達水平較癌旁肝組織呈現上調,表明CCDC34基因具備作為肝細胞癌病理診斷標志物的潛在價值。結合TCGA數據庫肝細胞癌患者的臨床數據,本研究進一步分析了CCDC34基因表達水平與肝細胞癌患者預后的相關性,發現CCDC34基因表達水平與TNM分期和腫瘤分級相關。Kaplan-Meier生存分析顯示,CCDC34基因高表達患者總生存期顯著低于低表達患者,多因素Cox回歸分析結果表明,CCDC34基因表達水平是影響肝細胞癌患者總生存期的獨立危險因素,提示該基因有望成為肝細胞癌腫瘤診斷和患者預后判斷的新型分子標志物。借助基因集富集分析,本研究發現CCDC34基因高表達組顯著富集于堿基切除修復、剪接體等8條信號通路。細胞增殖能力是評價腫瘤細胞惡性程度的重要指標之一,腫瘤細胞通過周期性的有絲分裂不斷增殖。在細胞周期的間期,細胞核苷酸嘧啶代謝增強,合成DNA復制所需的各種前體物和酶分子,從而完成DNA復制[21]。Gong等[22]發現CCDC34蛋白在膀胱癌組織和細胞系中表達升高,通過慢病毒介導的siRNA抑制其表達可以顯著抑制膀胱癌細胞的增殖和遷移,誘導細胞周期停滯在G2/M期并增加體外細胞的凋亡。結合GSEA結果,筆者推測CCDC34基因可能通過促進嘧啶代謝、DNA復制等方式調控細胞周期,增強癌細胞的增殖能力。當前,放療和化療仍是治療肝癌的主要手段,其本質是通過造成DNA損傷以誘導癌細胞死亡。腫瘤細胞的DNA修復途徑主要包括錯配修復、堿基切除修復、核苷酸切除修復、跨損傷合成和同源重組等,其修復能力越強,放療化療抵抗往往越強。CCDC34基因可能通過增強肝癌細胞錯配修復、堿基切除修復等能力,提高肝癌細胞對放化療損傷的耐受性[23-25]。通過對血液系統腫瘤的研究發現,剪接體突變可以通過干擾姐妹染色單體的聚集,影響染色體穩定性、DNA修復和基因調節而最終導致腫瘤的發生[26]。雖然本研究為深入探討CCDC34基因在肝細胞癌中的作用提供了線索和依據,但是腫瘤的發生發展是一個由多基因協同進行的復雜調控過程,CCDC34基因通過上述通路參與肝細胞癌發展的具體機制仍有待后續研究予以進一步闡明。

表2 影響肝細胞癌患者預后的單因素和多因素分析

注:a,富集堿基切除修復通路基因集;b,富集剪接體通路基因集;c,富集核苷酸切除修復通路基因集;d,富集嘧啶代謝通路基因集;e,富集DNA復制通路基因集;f,富集同源重組通路基因集;g,富集細胞周期通路基因集;h,富集錯配修復通路基因集。
綜上所述,本研究通過運用相關生物信息學方法揭示了CCDC34基因作為促癌基因參與肝細胞癌的發生發展過程,有助于改善肝細胞癌患者治療后復發的監測策略,從而為臨床上早診斷早治療提供了新的思路。

