月見草素B及其生物活性研究進展
李 偉,張小英,陳 熔,苗建銀,陳運嬌,曹 庸
(華南農業大學食品學院,廣東省功能食品活性物重點實驗室,廣東省天然活性物工程技術研究中心,廣州 510642)
月見草素B(Oenothein B,OEB,圖1)最初是從月見草屬植物中分離出來的一種大環二聚體鞣花鞣質;現代研究指出桃金娘屬、千屈菜屬、柳葉菜屬等植物中均可分離出OEB[1-3](表1)。這些屬許多植物(百千層、香桃木、藍桉等)傳統上常用于各種醫療目的,如前列腺和腸胃疾病、傷口愈合和皮膚應激[4];經過大量體外和體內研究表明,OEB是這些植物提取物中存在的主要生物活性成分之一[5-7]。作為大環二聚體單寧,OEB屬于水解單寧,其分子結構中有大量酯鍵和糖苷鍵,而二聚體結構和葡萄糖上沒食子酰基為增強其生物活性所必需。已有研究指出OEB具備良好的抗腫瘤[8-9]、抗炎[10-11]及抗氧化[12-13]等生物活性,具有重要研究意義。但OEB規模化分離純化困難,國內商業化產品價格昂貴;同時,特殊的多羥基結構造成其易被氧化,體內外穩定性較差。目前,國內關于OEB的研究論文較少,國外研究論文較多。結合國內外文獻,本文旨在綜述OEB的結構特性、理化性質及生物活性研究進展,以期為OEB深入研究提供研究思路。
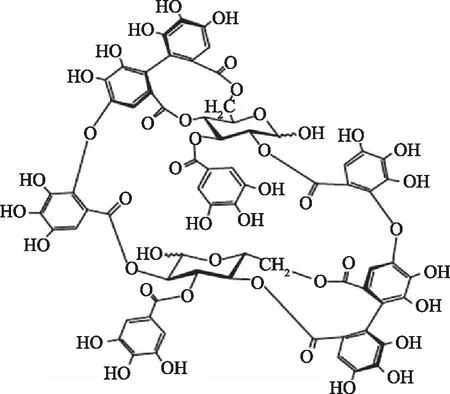
圖1 月見草素B結構式Fig.1 Structural formula of oenothein B

表1 OEB在植物中的分布Table 1 Distribution of oenothein B in plants
OEB被分離出來后是一種無定型的粉末,質譜結果表明其質荷比(m/z)為1569[M+H]+,分子式為C68H48O44。OEB結構上含有兩個未酰基化葡萄糖母核,理論上可以形成四種難以分離的混合物,這也給后續光譜分析造成干擾。常溫條件下氫譜信息中質子信號拓寬和倍增也是這類大環寡聚物的特征之一,這是由于葡萄糖母核上發生異構化導致。然而,在40~50 ℃條件下氫譜數據表明,在δ6.20(d,J=3.5 Hz)和δ4.48(d,J=7.5 Hz)處的特征信號分別是α-葡萄糖和β-葡萄糖[2]。NaBH4降解表明芳香區有6個1H單峰態和2個2H單峰態,證明兩個葡糖糖母核上均有纈氨酰基、沒食子酰基及葡萄糖醇基團,而基團之間的結合模式由1H-13C位移相關光譜和在OEB處理后獲得的部分水解產物鑒定得出[25]。最終確定OEB結構上是以兩個特里馬素Ⅰ單元構成,其中以葡萄糖(α-葡萄糖和β-葡萄糖)為母核,結合沒食子酰基以酯鍵和糖苷鍵的形式形成大環二聚體鞣花單寧[26]。
OEB是一種大環二聚體單寧,分子式C68H48O44,其常溫下呈白色或者淡黃色粉末狀[2]。OEB易溶于水、乙醇等極性溶劑,而在乙酸乙酯和石油醚等低極性溶劑中基本不溶。同時,OEB在高溫(>80 ℃)、堿性pH(>7)以及消化系統水解酶(胰蛋白酶、脂肪酶)等條件下不穩定,容易發生水解,分解成酚酸類和多元醇等,造成功能活性降低[27]。曹素芳等[28]研究指出小鼠體內的代謝實驗也表明OEB在體內代謝不穩定,在胃腸道中已經發生降解,生物利用率低。基于OEB相對分子量大、體內不穩定等特征,現代研究指出可采用納米乳液[29]、微乳[30]以及脂質體[31]等穩態化技術進行包埋,以期提高OEB的穩定性。
2 月見草素B的生物活性
2.1 抗腫瘤
作為二聚體水解單寧的OEB,獨特的結構賦予其良好的抗腫瘤活性。在已有的研究中,OEB除了對腫瘤細胞造成直接殺傷力和抑制/促進相關酶系活力之外,主要以宿主介導的抗腫瘤活性為主。圍繞OEB與機體自身免疫對腫瘤的協同作用進行研究,以期探究OEB抗腫瘤作用機制,將OEB注射到小鼠腹腔中誘導腹腔中巨噬細胞產生腹膜滲出物,引起IL-1釋放,結果表明OEB通過激活巨噬細胞分泌、增強宿主免疫,以達到抑制小鼠體內Meth·A型腫瘤細胞增長的作用[32]。這提示OEB等單寧類物質可能通過增強宿主細胞免疫活性進而達到抗癌的作用。相似研究指出二聚體馬桑鞣素A和月見草素A同樣能夠增強機體免疫以達到宿主介導的抗腫瘤活性[33]。在MM2腹水腫瘤細胞模型中,提前4 d在小鼠腹腔接種S-180細胞,將45種鞣花酸類物質注射進小鼠體內,以小鼠壽命增加70%及以上作為評價抗癌效果指標,結果表明二聚體鞣花酸中OEB具有突出的抗癌活性;單寧單元體和二聚體單寧(OEB)表現出優越抗癌作用,這與結構中葡萄糖母核上2和3位置的沒食子酰基有關[34]。此外,從細葉萼距花中分離出四種二聚體單寧,并對其抗腫瘤活性進行研究。其中OEB能顯著抑制人體腫瘤細胞KB、Hela、Hep3B和HL-60等的生長,而對正常細胞的毒性更低,甚至低于抗腫瘤物質阿霉素;此外,還研究了OEB對S-180細胞和含有S-180瘤細胞的ICR小鼠的作用效果,結果發現體外實驗中月見草素B對S-180細胞表現出很大細胞毒性(IC50=11.4 μg/mL),同時能顯著提高接種S-180腫瘤細胞小鼠的存活率,表明OEB通過抑制S-180細胞活性起到抗腫瘤效果[35]。此外,上述研究提示OEB等二聚體單寧類物質的抗癌作用不是簡單的細胞毒性作用,推測其通過改善宿主自身免疫調節功能從而達到最佳的抗腫瘤活性。
Vitalone等[36]發現柳葉菜屬植物來源的OEB能抑制PZ-HPV-7、LNCaP、HMEC、1321N1四種細胞系的DNA合成,阻止前列腺細胞增殖;通過比較Epilobiumangustifolium和Epilobiumspicatum兩種來源提取物抑制DNA合成的能力和OEB含量,研究發現前者提取物中OEB含量高于相同物種近40倍,抑制人體前列腺細胞系中DNA合成作用明顯,推測OEB以非特異性的方式在抑制前列腺細胞的增殖中起作用。有研究指出這種抑制作用不是細胞毒性作用引起的,而是通過對細胞周期進程的干擾實現的[37]。同時,這也與OEB抑制前列腺增生進程中5α-還原酶和芳香化酶有關[38]。由于抑制前列腺細胞增殖被認為在治療前列腺增生和肥大中是有用的,而這與前列腺炎癥的發生相關。前列腺慢性炎癥可能通過氧化應激或誘導誘變產生的活性氧導致前列腺癌的發生或腫瘤[39]。這提示OEB抑制前列腺細胞增生,在一定程度上能間接性緩解細胞炎癥、降低腫瘤發生率。此外,相似研究指出OEB能抑制EBV病毒中DNA聚合酶的數量從而達到抑制腫瘤的作用[40]。有報道前列腺增生人體體內血管緊張素轉化酶活力和血管緊張素Ⅱ含量顯著高于正常人,這提示腎素-血管緊張素-醛固酮系統(RAAS)的激活可能參與前列腺增生的病理生理過程。而同屬鋅金屬肽酶的中性內肽酶能催化多種活性肽降解以改善前列腺增生的情況,甚至有研究認為中性內肽酶的變化與前列腺癌密切相關。通過PC-3細胞前列腺癌模型得出柳葉菜屬水提取及從中分離的OEB統計學上顯著提高中性內肽酶的活性,一定程度上有利于減緩前列腺增生,這與其抑制細胞內5α-還原酶相關酶類有關,為民間藥物提供了藥理方面的解釋[41]。
2.2 抗炎作用
炎癥是機體受到外界刺激而引起的一系列生理生化變化的病理過程。臨床上非甾體類抗炎藥、甾體類抗炎藥及中藥常被用來阻斷炎癥反應。化學合成抗炎藥物使用過程中機體逐漸產生的抗藥性及毒副作用,而天然產物中抗炎活性成分因毒副作用小、效果顯著等特點受到研究人員的青睞[42]。研究報道指出OEB具有良好的抗炎作用,能有效降低LPS和TLR4誘導的NO含量、iNOS基因及蛋白的表達水平,這與它減少了NF-κβ(p50)亞基與生物素化的共有序列的結合并降低了NF-κβ(p65)易位有關;同時OEB能有效抑制炎癥介質(腫瘤壞死因子、白介素-6)分泌[11]。相似研究發現OEB能顯著抑制NF-κβ活性,降低因激活NF-κβ引起的iNOS基因過度表達,達到緩解炎癥的作用[10]。此外,OEB有效抑制嗜中性粒細胞中髓過氧化物酶(MPO)產生,這與OEB能抑制脂肪氧合酶活性有關;同時,研究發現OEB作為一種有效COX-1抑制劑,能有效地緩解炎癥,起到類似于抗炎藥吲哚美辛的作用[6]。這表明OEB在體外細胞模型中能有效降低刺激物導致的細胞炎癥現象,為開展體內抗炎實驗提供基本的研究數據。有報道以脂多糖注射到ICR小鼠腹膜進行造模,研究小鼠口服OEB對全身炎癥引起的中樞神經系統損傷的影響。結果表明口服OEB組小鼠顯著抑制曠場實驗中LPS誘導造成的小鼠異常行為、海馬和紋狀體中小膠質細胞活化和COX-2的產生;在系統性炎癥過程中,OEB具有緩解腦中神經炎癥的能力[43]。OEB相對分子量為1569,在體內很難被直接吸收利用起到抗炎作用。有研究指出鞣花單寧容易被腸道菌群代謝成更小的代謝物,這些代謝物對結腸成纖維細胞有抗炎作用[44-45]。這些發現也表明OEB可能在體內與腸道菌群發生作用,生成更小的代謝物,再起到抗炎作用。綜上,OEB在體內外均有良好的抗炎活性,但其在體內代謝過程中產生的代謝物仍需深入研究,尤其是抗炎代謝組分。
2.3 免疫調節作用
免疫作用是機體實現自我保護的重要方式,適度的免疫反應對機體健康至關重要。激活巨噬細胞和T細胞等免疫細胞、誘導產生免疫調節因子及提高免疫球蛋白等途徑都能有效提高機體免疫調節作用。有報道發現OEB顯著下調人類樹突狀細胞(DC)細胞表面上CD1a和CD83的表達,抑制DC的分化和成熟,對機體起到免疫調節作用;這種抑制作用與誘導細胞凋亡相關,細胞有明顯核縮合的形態特征支持了上述觀點[46]。目前,研究表明OEB通過下調細胞因子、誘導DC功能障礙以及細胞凋亡來發揮外周免疫調節作用,這些研究一定程度上揭示含鞣質的藥用植物用于治療各種炎性疾病的傳統用途。OEB等多酚類化合物不僅通過傳統的抗氧化作用起到對機體的保護作用,它還能調節細胞反應引起機體的免疫調節作用。例如,研究指出OEB能發揮抗腫瘤作用,但這一定程度上是通過誘導機體白介素-1β含量上升促進宿主免疫調節作用而實現的。Schepetkin等[47]發現柳葉菜屬提取物中OEB是引起中性粒細胞和巨噬細胞活化的主要成分,OEB被注入到小鼠腹腔后引發原發性嗜中性粒細胞趨化劑IL-8和嗜中性粒細胞在小鼠腹膜聚集從而起到免疫調節作用;此外,OEB在體外誘導吞噬細胞發揮功能,包括細胞內Ca2+通量、活性氧的產生、趨化性、NF-κβ活化和促炎細胞因子的產生等。Ramstead等[48]指出OEB能刺激牛和人淋巴細胞(T細胞和NK細胞),誘導細胞表面抗體表達(CD25或CD69);還發現了OEB能單獨或與白介素-18(IL-18)共同作用以促進牛和人的NK細胞產生干擾素-c(IFNc)。干擾素有助于提高機體抗腫瘤、抗菌及抗病毒作用,這也部分解釋了OEB增強機體免疫的作用機制。另外,OEB作為一種相對分子量較大的鞣花單寧,常規情況下其難以被直接吸收起到免疫調節作用。有研究指出以OEB分子式上的子結構物質為參比對象(沒食子酸、鄰苯二酚、鄰苯三酚、3,4-二羥基苯甲酸等),發現OEB完整結構在體內外才具有更強調節細胞吞噬功能的作用。這也說明OEB很有可能不是直接調節機體的免疫調節功能,而是以促進機體產生自身免疫的方式。此外,OEB在體內被腸道微生物代謝成其他的功能小分子,也有可能是促進機體免疫的重要原因之一。
2.4 抗氧化
目前,單寧類物質已被證實具有明確的抗氧化、抗衰老等作用[49-53]。OEB結構上22個酚羥基有助于增強其抗氧化活性,達到淬滅O2-和DPPH自由基的作用,其IC50分別為0.9和6.1 μmoL/L[54]。從桃金娘科桉樹葉中分離出十種酚類化合物,其中OEB能有效的清除DPPH自由基(EC50=6.12 μmoL/L),起到抗氧化作用[55]。Amakura等[14]研究指出桉葉提取物在DPPH和ORAC體外抗氧化評價中表現良好的抗氧化活性,通過HPLC液相色譜分析得出主峰包括沒食子酸、鞣花酸及OEB等物質;同時基于抗氧化活性、液相色譜分離度及相對穩定性,提出OEB可作為桉樹葉提取物標志成分之一。OEB和鞣花酸是多酚化合物,其氧化機理是pH依賴性的,涉及不同數量的電子和質子。OEB除了具有明確的抗氧化能力外,在延緩衰老方面也有不少研究。陳運嬌[56]發現OEB處理野生型秀麗線蟲后平均壽命延長22%,線蟲運動能力增強,并能降低后期老年斑含量。根據自由基理論,推測OEB通過阻斷自由基反應、清除過剩自由基,直接或者間接地通過增強抗氧化性而起到延緩衰老的作用[57]。
2.5 其它作用
OEB除了上述抗腫瘤、抗炎、免疫調節及抗氧化作用,還有抗真菌等作用。有研究表明從扁櫻桃中分離得到的OEB具有有效的抗真菌作用,它能干擾巴西副球孢子菌形態,表現在細胞表面粗糙和細胞壁破裂。它抑制了參與細胞壁的1,3-β-D-葡聚糖合酶(PbFKS1)基因的轉錄,干擾了巴西副球孢子菌的細胞形態[58]。為了闡明候選化合物OEB的作用模式,通過代表性差異分析(RDA)進一步分析OEB處理巴西副球孢子菌后基因的變化,發現OEB調控合成細胞壁的關鍵基因(GLN1、KRE6、FKS1);此外,OEB還參與涉及維持細胞膜形態和壓力等細胞過程[59]。這些結果都表明OEB能起到有效的抗真菌作用,主要通過參與細胞壁合成的相關途徑起作用,為其他植物化合物抗真菌作用機制提供一定的借鑒。此外,許多單寧酸及相關的多酚類化合物對直接作用的誘變劑均具有抗誘變活性,這表明這些化合物可潛在地對抗氧介導的DNA損傷,也有研究報道OEB具有類似的作用。Silva等以SOS-Inductest和體內小鼠骨髓微核(MN)為模型,表明OEB沒有任何遺傳毒性,再用兩種試驗聯合使用絲裂霉素C來評估OEB的抗原毒性和抗細胞毒性活性,它表現出對由絲裂霉素C誘導的原代DNA損傷的體內保護活性[60]。另有研究發現OEB具有抗病毒作用,能有效抑制巴爾病毒(EBV)DNA聚合酶,從而達到抑制EBV復制的效果[40]。天然植物來源的OEB在體內外具有多種生物活性,其優異的抗菌、抗誘變及抗病毒活性是進一步研究利用的基礎,但現階段需要更深入的研究其作用機制。
3 結語與展望
作為大環二聚體鞣花單寧,月見草素B具有良好的生物活性,自發現以來其在抗腫瘤、抗炎、免疫調節及抗氧化等方面展現顯著效果,研究與應用前景十分廣闊。從生物活性的角度來看,OEB早期研究主要體現在其抗腫瘤作用,受限于技術的發展研究層次不高,且抗腫瘤的作用機理不明確,往后的研究可依托于現代先進的分子技術,從基因、蛋白質的層面深入考察OEB的作用機理。同時,OEB在抗炎、免疫調節及抗氧化等方面研究相對較少,仍然需要大量的基礎研究。另,高分子量的物質常因為溶解度和穩定性等原因造成生物利用度比較低,故OEB的高分子量與其高生物活性之間的關系需要謹慎解釋。總體而言,OEB作為一種高分子量的大環二聚體鞣花酸,高效的生物活性使其具有重要的研究及應用價值。

