加速康復外科理念下腹腔鏡遠端胃癌根治術不放置腹腔引流管的臨床研究
洪 亮,史良會,吳澤暉,劉 剛
(皖南醫學院第一附屬醫院胃腸外科,安徽 蕪湖,241000)
腫瘤流行病學的最新研究表明,包括我國在內的東亞地區是胃癌的高發區域,男性患者較多,男性胃癌的新發病人數僅次于肺癌,排名第二,死亡人數僅次于肺癌、肝癌,排名第三[1];疾病負擔重。外科手術依然是治療胃癌最有效的手段。隨著腹腔鏡技術的快速發展及加速康復外科理念的提出,外科醫生在提高手術技巧的同時愈加關注患者圍手術期體驗,而胃癌患者術后體內通常預防性置入鼻胃管、腹腔引流管及導尿管,上述管道會對機體產生疼痛刺激、限制患者活動,可能影響術后恢復。因此“無管化”技術應運而生,國內在腹腔鏡結直腸癌手術[2]、達芬奇機器人縱隔腫瘤切除術[3]等術后不再放置“三管”的“完全無管化”手術讓人印象深刻,但腹部手術是否需要預防性放置腹腔引流尚缺乏循證醫學證據,一直存有爭議。本研究旨在以患者為中心,貫徹加速康復外科理念,通過比較腹腔鏡遠端胃癌根治術后腹腔引流組與無腹腔引流組患者的手術效果、術后早期并發癥,以探討無腹腔引流的安全性及可行性。
1 資料與方法
1.1 臨床資料 納入2018年6月至2019年6月皖南醫學院第一附屬醫院胃腸外科收治的92例胃竇惡性腫瘤患者,排除15例,最終納入77例符合條件的患者。納入標準:(1)經胃鏡病理確診為胃竇惡性腫瘤;(2)手術指征明確,均采取腹腔鏡遠端胃癌D2根治術+Roux-en-Y消化道重建術;(3)18~85歲;(4)告知患者研究目的后取得患者同意。排除標準:(1)術前結合實驗室、影像學檢查及術中腹腔鏡下所見,考慮腫瘤遠處轉移;(2)合并其他嚴重并發癥,并根據美國麻醉醫師協會(American society of anesthesiologists,ASA)手術風險性分級Ⅲ級及以上;(3)術前營養狀況差,NRS2002營養風險篩查表中的營養狀態受損評分結果3分及以上;(4)術中損傷或聯合切除胰腺、脾臟等其他臟器;(5)中轉開腹。本臨床研究已獲得醫院倫理委員會批準。
1.2 分組方法 將納入的77例患者分為引流組(n=40)與無管組(n=37),引流組術后留置鼻胃管、腸內營養管、腹腔引流管及導尿管;無管組術后不放置腹腔引流管,留置鼻胃管、腸內營養管及導尿管。手術均由同一位經驗豐富(腹腔鏡胃切除手術例數超過1 000例)的術者完成,并參與指導患者術后康復工作。
1.3 圍手術期處理
1.3.1 術前處理 兩組患者均進行術前宣教,緩解患者術前緊張心理;術前6~8 h禁食、禁飲,并予以腸道準備;術前2 h口服500 mL 10%葡萄糖溶液;術前30 min預防性輸注抗生素。
1.3.2 術中處理 兩組患者均行靜脈復合麻醉,采用喉罩維持呼吸循環;兩組均行腹腔鏡遠端胃癌D2根治術+Roux-en-Y消化道重建術,關腹前仔細止血、沖洗腹腔、吸凈腹腔殘留組織及液體,確認吻合口血運、張力正常。引流組常規置入鼻胃管、腸內營養管、腹腔引流管及導尿管,無管組僅留置腸內營養管。
1.3.3 術后處理 密切監測兩組患者生命體征變化,動態復查血常規、血生化等實驗室指標,注意術后補液、能量攝入、預防性使用抗生素,根據臨床表現及腹部體征,按需行床旁腹部B超、急診腹部CT等檢查,術后出現并發癥時對癥治療,術后鎮痛統一使用NSAIDs類鎮痛抗炎藥氟比洛芬酯。引流組患者術后通氣后拔除鼻胃管,腹腔引流量持續少于30 mL/d時拔除腹腔引流管,出現尿意行膀胱鍛煉后及時拔除尿管。兩組患者均于術后第3天開始予以腸內營養支持。
1.4 觀察指標
1.4.1 術前基線數據 兩組患者年齡、性別構成、體重指數(body mass index,BMI)、ASA分級、NRS2002評分(營養狀態受損評分)、術前臨床分期。
1.4.2 手術效果指標 兩組手術時間、術中出血量、淋巴結清除數量、術后VAS評分、術后鎮痛藥(氟比洛芬酯)使用劑量、術后首次下床活動時間、術后通氣時間、術后流質飲食時間、住院時間、住院費用及藥占比。
1.4.3 術后早期并發癥 按Clavien-Dindo手術并發癥分級標準,比較兩組術后發熱、腹脹、術后肩痛、腹腔內積液、腹腔內出血、吻合口漏、術后再次置管及肺部感染、切口感染發生率。
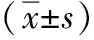
2 結 果
2.1 兩組臨床資料的比較 兩組患者年齡、性別構成、BMI、ASA分級、NRS2002評分(營養狀態受損評分)、術前臨床分期差異無統計學意義(P>0.05)。見表1。
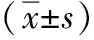
2.2 兩組手術指標的比較 兩組手術時間、術中出血量、淋巴結清掃數量、晚期VAS疼痛評分、術后通氣時間、術后流質飲食時間差異無統計學意義(P>0.05)。無管組術后早期VAS疼痛評分、術后鎮痛藥使用劑量、術后首次下床活動時間、住院時間、住院費用、藥占比優于引流組,差異有統計學意義(P<0.05)。見表2。
2.3 術后早期并發癥的比較 術后早期并發癥如發熱、腹脹、術后肩痛、腹腔內積液、肺部感染發生率兩組差異無統計學意義(P>0.05),兩組均無腹腔內出血、吻合口漏再次手術、再次置管引流、切口感染等Clavien-Dindo評級Ⅲ級及以上嚴重并發癥發生。見表3。
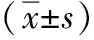
續表2

組別術后首次下床活動時間(h)術后通氣時間(h)進流質飲食時間(h)術后住院時間(d)住院費用(元)藥占比引流組34.50±5.8941.55±13.0641.55±13.069.75±1.0846 681.33±2 260.1725.09%±4.05%無管組28.38±5.2237.46±11.5237.46±11.528.84±1.1744 899.14±3 324.7022.36%±4.46%t值4.8121.4521.4523.5622.6072.816P值<0.0010.1510.1510.0010.0110.006
表3 兩組患者術后早期并發癥的比較(n)

組別發熱腹脹術后肩痛腹腔內積液肺部感染引流組912302無管組117421χ2值0.5231.2700.225-0.271P值0.4700.2600.6140.2280.603
3 討 論
傳統腹部手術尤其胃腸道手術,術后通常放置1根甚至數根腹腔引流管,其目的是引流腹腔內殘余積液、滲液,觀察術后創面滲血或出血情況,而且術后發生胃腸吻合口漏時可起到引流作用。腹腔引流管一般放置約1周,但近年,預防性腹腔引流的必要性一直存有爭議。大量臨床研究表明,在急性膽囊炎[4]、擇期結直腸手術[5]、擇期胃袖狀切除[6]、胃癌[7]等腹部手術后,預防性腹腔引流是沒有必要的,不能給術后恢復帶來實質性益處,相反腹腔引流管與術后并發癥的發生密切相關。Hirahara等[8]的研究認為,腹腔引流可使富含蛋白質的腹水流失,導致低血容量、低蛋白血癥。來自意大利的一項研究表明,腹腔引流管是導致手術部位感染的獨立危險因素[9]。但胰十二指腸切除術[10]預防性放置腹腔引流仍不可缺少。
本研究共納入77例行腹腔鏡遠端胃癌根治術的患者,兩種術式在手術時間、術中出血量、淋巴結清掃數量、術后72 h VAS疼痛評分、術后通氣時間及術后流質飲食時間方面差異無統計學意義;在術后24 h VAS疼痛評分、鎮痛藥物使用劑量、首次下床活動時間、住院時間、住院費用及藥占比方面,無管組優于引流組(P<0.05);兩組均無再次手術、再次置管引流等Clavien-Dindo評級Ⅲ級及以上的嚴重并發癥發生。無管組中1例老年男性患者于術后第3天出現左下腹腹膜刺激征,腹部B超檢查提示盆腔中等量積液,予以禁食、抗感染、輸注人血白蛋白等對癥治療后癥狀好轉,出院前復查B超未見腹腔積液。引流組中3例患者術后2 d內腹腔總引流量少于50 mL,拔除引流管后囑患者側臥位,沿原引流管口流出少量暗褐色腹腔積液,術中放置的引流管并未起到引流作用。筆者認為,術后引流出的腹腔積液主要來自術中沖洗腹腔時殘留的生理鹽水及手術創面少量的滲出液,而腹膜具有天然的抗感染、重吸收分泌物的功能[11];Sagar等[12]的研究認為,引流管作為異物會刺激腹腔積液的產生,我們的研究結果顯示,未放置腹腔引流管并不會直接造成術后腹腔積液。Kandil等[13]認為,腹腔鏡手術后,腹腔內殘留的CO2氣體會在腹膜上生成碳酸,刺激膈肌、引起肩痛。本研究結果顯示,兩組術后肩痛發生率差異無統計學意義,通過腹腔引流管排出殘余氣體以減少肩痛的做法并不合理。Kehlet等[14]的研究表明,術后臥床時間延長會增加胰島素抵抗與肌肉萎縮,影響肺功能導致組織氧合降低,早期下床活動對患者機體康復具有重要意義。本研究結果顯示,無管組患者術后早期疼痛感明顯減輕,使患者主觀上具備早期功能鍛煉的條件,促進了術后康復。此外,無管組住院費用、藥占比少于對照組,可能與其住院時間較短有關,這對減輕患者的經濟負擔具有積極意義。以上結果均提示腹腔鏡遠端胃癌根治術不放置腹腔引流管是安全、可行的。
隨著外科醫生技術水平的提升、圍手術期管理的改進及先進醫療設備的普及,如今腹部手術并發癥發生率明顯下降,預防性腹腔引流作為術后并發癥的診治手段之一,多已呈現濫用的狀態;雖然其可降低漏診、誤診率,但僅為了降低漏診、誤診率而采取過度診療的策略并不可取。當然我們并不贊成所有腹部手術患者均不放置引流管,如果手術創面較大、滲液與滲血較多、有淋巴瘺發生的可能、全身情況差、低蛋白血癥、估計吻合口愈合不良等情況時,建議放置腹腔引流管。
綜上所述,腹腔鏡遠端胃癌根治術后預防性放置腹腔引流管并不能給患者帶來額外收益,不放置腹腔引流管明顯減輕了術后疼痛感,使患者主觀上具備早期功能鍛煉的條件,縮短了住院時間,是安全、可行的,是具有經濟效益的術后快速康復的治療措施,但本研究的局限性在于病例數有限,對患者身體條件的判斷受主觀因素影響,容易產生選擇偏倚,期待大規模、前瞻性的隨機對照實驗進一步證實無腹腔引流在腹腔鏡遠端胃癌根治術中的安全性及有效性。

