水稻未知功能結構域基因OsDUF6的抗體制備
姜身飛 謝云杰 李樂樂 王昱澎 蔡秋華 謝華安 張建福

摘要:[目的]制備特異性OsDUF6多克隆抗體,為深入研究OsDUF6在水稻中的生理生化功能提供強有力的工具,為在分子水平上揭示其作用機理奠定基礎。[方法]通過對OsDUF6基因進行生物信息學分析,從中選取3段不同區域的氨基酸序列作為抗原,用于抗體制備。用Tetras多通道多肽合成儀合成短肽并用高效液相色譜法(HPLC)進行蛋白質純度檢測;免疫新西蘭雄性大白兔,制備相應的多克隆抗體。通過間接酶聯免疫吸附法(ELISA)檢測多克隆抗體效價,通過構建OsDUF6的原核表達載體檢測多克隆抗體的特異性,最后利用轉基因植株進一步檢測抗體。[結果]利用高效液相色譜法(HPLC)檢測3條合成的短肽(蛋白純度>85%)用于免疫新西蘭雄性大白兔,得到效價為1:512000的3種多克隆抗體。構建原核表達載體pGEX6p-1-DUF6,在大腸桿菌中誘導表達重組蛋白GST-OsDUF6,并用GST單克隆抗體成功檢測到重組蛋白。在此基礎上,對制備的抗體進行特異性檢測,結果發現Anti-DUF6-1多克隆抗體結合重組蛋白GST-DUF6的特異性最高。選取該抗體作進一步驗證,以非轉基因植株作為對照,通過提取DUF6過表達水稻植物總蛋白進行抗體檢測,結果表明,Anti-DUF6-1能識別OsDUF6蛋白特異條帶,并且在過表達植株中顯示較高的蛋白豐度。[結論]制備的Anti-DUF6-1多克隆抗體能特異性識別水稻未知功能域蛋白OsDUF6,可用于該蛋白的進一步功能研究。
關鍵詞:OsDUF6;多克隆抗體;原核表達;轉基因水稻
中圖分類號:S511文獻標志碼:A 文章編號:1008-0384(2020)02-0117-07
0 引言
(研究意義)近年來,未知功能結構域蛋白家族(Domains of ullknown function protein families,DUFs)是科研工作者的研究熱點,它是一大群未知功能和沒有注釋的蛋白家族,其蛋白數量占整個蛋白家族的25%左右。此外,它還和一些有命名但是還沒有注釋功能的蛋白家族,統稱為DUFs.21世紀以來,越來越多的報道發現,DUFs在植物整個生命歷程中發揮著重要作用,因此研究該類基因的生物學功能具有重要意義。隨著分子生物學的不斷發展,蛋白水平上的研究已經備受關注,研究基因的功能不再局限于轉錄水平。抗體制備是在蛋白水平上研究基因功能的重要環節,制備高效價的抗體是研究基因功能的前提。(前人研究進展)DUFs普遍存在于生物中,其中在真核生物中約占20%。近年來,已有研究表明,DUFs廣泛存在于植物中,如DUF640、DUF579等。研究發現,DUFs參與植物體內一些重要的生物學過程,發揮一系列的生理功能。DUFs可以參與調控植物生長發育,其中水稻DUF266家族的糖基轉移酶基因BC10與糖基轉移酶標記基因GTs,共同參與植物細胞壁形成發育的生理機制。DUFs也調控植物對病害的防御反應,例如Kim等對稻瘟病菌(Magnaporthe grisea)進行蛋白質組差異分析發現,5個DUF26稻瘟病響應蛋白參與水稻對稻瘟病的防御反應;李娟等通過構建水稻DUF500家族基因OsDUF500的沉默株系,發現其與野生型相比表現出較高的水稻白葉枯病抗性,說明該基因可能對水稻白葉枯病抗性起負調控作用。DUFs還參與調控植物對非生物脅迫的響應,已報道水稻DUF966家族基因OsDSR2和OsDSR4基因參與水稻對干旱和鹽脅迫的響應。因此,DUFs家族在植物生長發育各個階段中充當多種角色,研究DUFs基因功能有助于了解植物體內復雜的分子機制。伴隨著分子生物學的理論不斷發展以及相關生物技術的日趨成熟,研究基因在蛋白水平上的功能,通常利用純化重組蛋白制備多克隆抗體。該技術不僅在動物中廣泛應用而且在植物研究中也成為一種重要手段。例如,為研究水稻PDK2基因在能量代謝的生物學功能及其作用機制,譚才鄧等通過構建PDK2的原核表達載體并在大腸桿菌中高效表達獲得重組蛋白,進一步純化免疫家兔制備得到PDK2多克隆抗體,為研究PDK2的表達模式及其互作蛋白奠定基礎;有研究表明CSN5可以調控植物的生長發育,但是目前對其功能的研究較少,因此何龍等在克隆該基因的基礎上,利用原核表達系統誘導該蛋白并純化,制備該蛋白的特異性抗體,有利于該基因的深入分析研究。抗體已經廣泛應用于生物研究中,如進行內源蛋白的表達分析、蛋白的體外互作驗證等,抗體制備也成為研究基因必不可少的環節。(本研究切入點)水稻為重要的模式植物,但是有關其DUFs家族基因的報道中僅有少數基因被揭示了生物學功能,而大部分家族基因尚未進行功能研究。水稻DUFs家族基因OsDUF6目前尚未有報道研究其生物學功能。(擬解決的關鍵問題)本研究通過對OsDUF6生物信息學分析,從中選取3段不同的氨基酸序列,合成短肽后免疫新西蘭大白兔制備相應的多克隆抗體,并構建OsDU6的原核表達載體來檢測多克隆抗體的特異性,旨在研究OsDUF6在水稻生長發育過程中的生理生化功能,并在蛋白水平上研究OsDUF6基因功能,為揭示其作用機理奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1材料
pGEX6p=1原核表達載體由福建省農業科學院水稻國家工程實驗室保存,大腸桿菌Transl-Tl購自北京全式金公司,大腸桿菌Rosetta購自北京博邁德生物技術有限公司。轉基因植株由福建省農業科學院水稻國家工程實驗室提供。所用的動物材料為雄性新西蘭大白兔、秈稻品種75-1-127、轉基因過表達水稻植株。
1.1.2試劑與設備 試劑:十二烷基磺酸鈉(Sodiumdodecyl sulonate,SDS)、異丙基-β-D-硫代吡喃半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)、氨芐青霉素、考馬斯亮藍R-250、低分子量蛋白預染Maker購自賽默飛世爾科技有限公司;辣根過氧化物酶(HRP)偶聯的羊抗兔IgG、GST單克隆抗體、DNA擴增的高保真酶Primer Star購自TAKARA公司。DNA回收試劑盒以及質粒小提試劑盒購自北京天根生物技術有限公司。PCR引物由白鯨生物有限公司合成。測序由福州鉑尚生物技術有限公司進行。
儀器設備:臺式冷凍離心機、PCR儀、電泳儀與電泳槽、轉膜儀、Amersham Imager 600凝膠成像系統、Tetras多通道多肽合成儀。
1.2 試驗方法
1.2.1抗原表位分析及短肽合成 應用DNAStarProtean軟件提供的抗原指數分析模塊Jameson-Wolf的方法對OsDUF6蛋白的抗原表位進行預測分析,采用DNAStar Protean軟件Kyke-Doolittle的方法對OsDUF6蛋白的親水性進行預測分析。綜合分析OsDUF6蛋白抗原表位及親水性的預測結果,從中選取3段不同區域的氨基酸序列,用Tetras多通道多肽合成儀合成氨基酸序列,并用高效液相色譜法(HPLC)對3條短肽進行蛋白質純度的檢測。
1.2.2多克隆抗體制備及抗體效價檢測 采購的新西蘭大白兔先靜養36d,免疫前靜脈取血3mL,室溫靜止2-3h,4℃放置3-4h,6000r·min-1離心15min,離心后取上清,作為陰性對照。取2mL的蛋白(0.5mg·mL-1)與等量的弗式不完全佐劑充分乳化后免疫新西蘭大白兔,以后每隔l周進行免疫,免疫3-4次。最后1次免疫前少量采血,通過間接酶聯免疫吸附法(ELISA)進行血清效價檢測,檢測達到預期后采取新西蘭大白兔的全部血液,取血清分裝,保存備用。
1.2.3原核表達載體pGEX6p-1-DUF6檢測抗體的特異性
(1)原核表達載體pGEX6p-1-DUF6的構建
以OsDUF6-6P-1-F(5'-CCCCTGGGATCCCCG旦AATTCATGGCCGCCTCCGGCTCCGCC-3.,酶切位點EcoR I)、OsDUF6-6P-1-R(5-GTCACGATGCGGCCGCTCGAGTCATTTTGCCTTCCTTGGCC-3.,酶切位點Xho I)為引物,以水稻品種75-1-127的cDNA作為模板,PCR擴增并純化回收得到目的基因片段,用EcoRI和Xho I酶切目的片段和pGEX6p-1載體,同源重組到原核表達載體pGEX6p-1中,同時轉化大腸桿菌Transl-T1.挑取單菌落,測序正確后,提取質粒并轉化大腸桿菌Rosetta進行蛋白表達。
(2)OsDUF6蛋白的原核表達、純化
挑一個單克隆接種于3mL LB(含Amp+)培養基中活化搖菌至OD600mm=0.6,然后以1:100的比例將活化的培養物轉入新的含Amp+的液體LB培養基中以擴繁菌體,待菌液OD600mm=0.6-0.8時,加入IPTG后繼續誘導,對照組不加IPTG作為陰性對照。誘導結束后,離心收集菌體細胞并超聲破碎,取50uL蛋白樣品與等體積2×SDS上樣緩沖液混勻,100℃煮沸10min,冷卻后上樣進行10%SDS-PAGE電泳并利用考馬斯亮藍染色液染色進行觀察。
擴大體積,用上述的方法誘導重組蛋白,超聲破碎后收集上清。將Glutathione SepharoseTM 4B加入到結合柱中,加入PBS緩沖液漂洗樹脂3次;將誘導破碎后的上清加入到結合柱中。4℃,70r·min-1搖動結合23h,用預冷的PBS緩沖液漂洗樹脂3次,洗脫非特異結合的雜蛋白,然后用還原性谷胱甘肽緩沖液洗脫目的蛋白。取50uL洗脫后的蛋白樣品與等體積2×SDS上樣緩沖液混勻,100℃煮沸10min,冷卻后上樣進行10%SDS-PAGE電泳,并利用考馬斯亮藍染色液染色進行觀察。
各取50uL誘導破碎后和純化后的蛋白樣品與等體積2×SDS上樣緩沖液混勻,100℃煮沸10min,冷卻后上樣進行10%SDS-PAGE電泳。電泳結束后,將蛋白電轉移到PVDF膜上。PVDF膜在封閉液(5%脫脂奶粉的PBS緩沖液)中室溫封閉2h.加入以封閉液稀釋的抗體(GST抗體稀釋度為1:5000,自制多克隆抗體稀釋度為1:500),室溫孵育1h,再用PBST洗滌3次,每次5min.然后用PBS稀釋(稀釋度1:10000)過的HPR羊抗兔二抗,室溫孵育1h,PBST洗滌3次,每次5min.用ELC試劑進行化學顯色并在Amersham Imager 600凝膠成像系統中拍照檢測。
1.2.4植物總蛋白的提取及Western blotting檢測將0.6g樣品(根)置于預冷的研缽中,用液氮研磨成粉末,加入1.5mL蛋白抽提液磨成勻漿,4℃,12000g離心20min,取上清轉移到1.5mL離心管中,放液氮中速凍隨后放-20℃,10min,取出放冰上至溶液融化開。4℃,12000g離心20min,取上清轉移到1.5mL離心管中-80℃冷凍保存。取50uL蛋白樣品與等體積2XSDS上樣緩沖液混勻,100℃煮沸10min,冷卻后上樣進行10%SDS-PAGE電泳。電泳結束后,將蛋白電轉移到PVDF膜上進行Westemblotting分析,具體步驟參考上述方法。
2 結果與分析
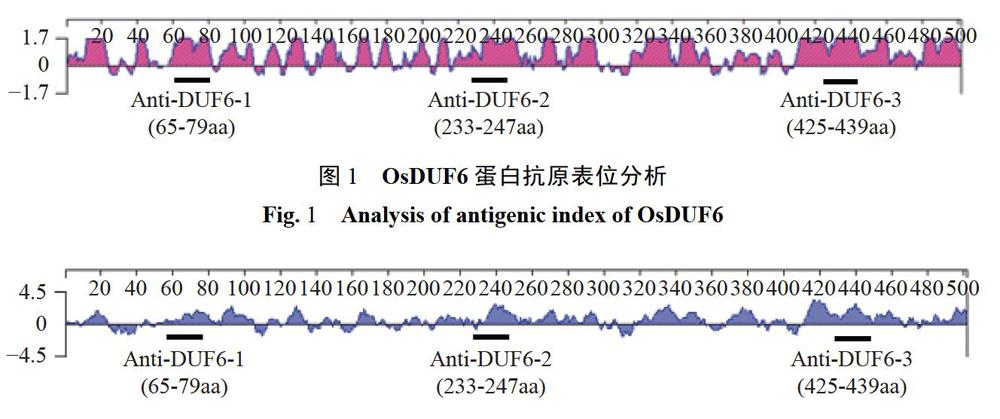
2.1 OsDUF6抗原表位分析及合成短肽
利用DNAStar軟件對該蛋白序列進行蛋白抗原表位以及親水性預測。通過DNAStar Protean軟件的Jameson-Wolf方法對OsDUF6蛋白的抗原表位進行預測。結果顯示,OsDUF6蛋白存在多個潛在的抗原表位,可能的蛋白質抗原表位區域(圖1):1-24aa、39-48aa、58-106aa、112-135aa、140-157aa、164-184aa、193-204aa、218-299aa、313-302aa、373-389aa、409--500aa.根據Kyke-Doolittle的方法對OsDUF6蛋白的親水性進行預測,發現OsDUF6蛋白具有較高的親水性,如:11-25aa、55-109aa、124-135aa、200-256aa、263-299aa、319-361aa、371-388aa、413-500aa(圖2)。綜合分析OsDUF6蛋白抗原表位及親水性的預測結果,從中選取3段不同區域的氨基酸序列:65-79aa(Anti-DUF6-1)、233-247aa(Anti-DUF6-2)、425-439aa(Anti-DUF6-3)分別作為抗原進行抗體制備。利用Tetras多通道多肽合成儀合成氨基酸序列,然后用高效液相色譜(HPLC)對3條短肽進行蛋白質純度的檢測。結果發現,Anti-DUF6-1、Anti-DUF6-2、Anti-DUF6-3的蛋白純度分別為85.493%、88.281%、87.152%,3條短肽的蛋白質純度都在85%以上,可以用來免疫新西蘭大白兔。
2.2 多克隆抗體制備及抗體效價檢測
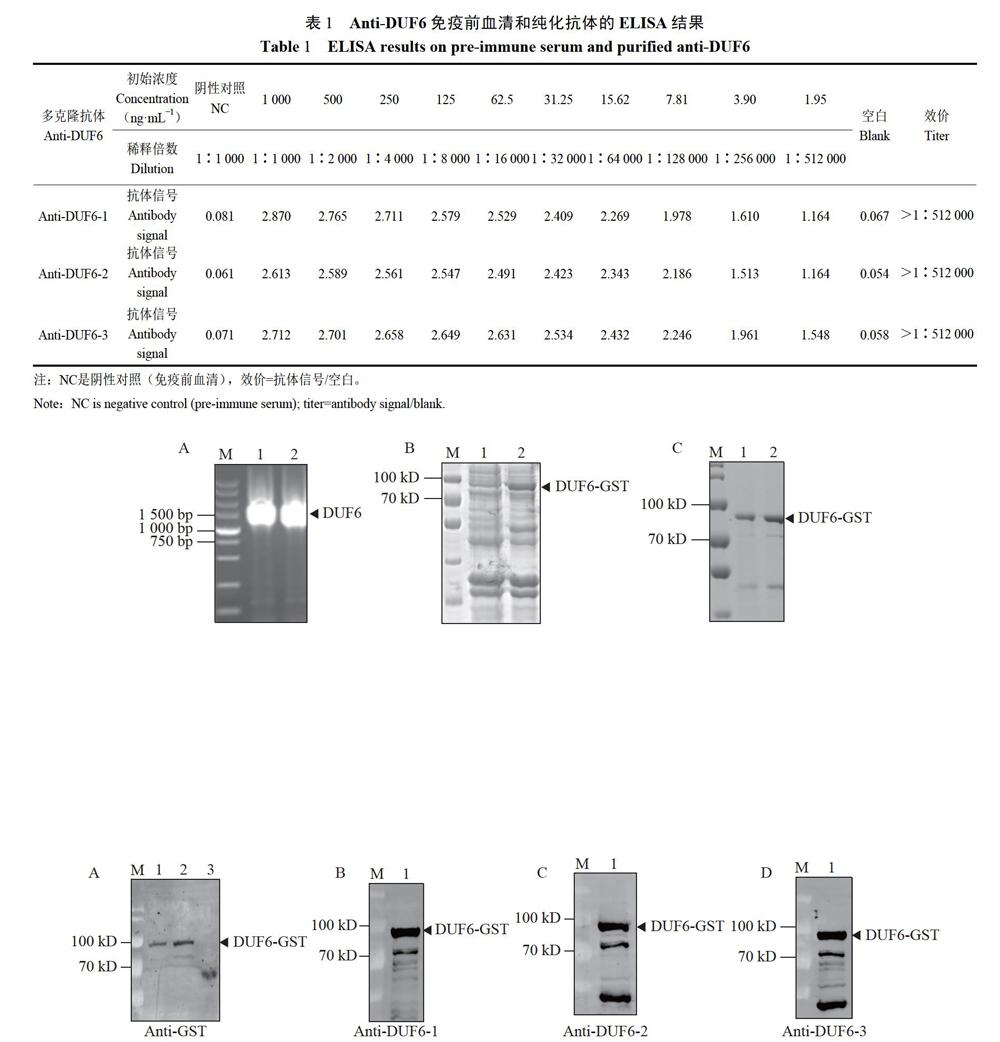
用蛋白質純度在85%以上的3條短肽分別免疫新西蘭雄性大白兔,獲得3份多克隆抗體血清。采用間接酶聯免疫吸附法(ELISA)對制備的多克隆抗體進行血清效價檢測。結果表明,稀釋度為1:512000時,3份制備的抗體血清仍高于免疫前血清的2,1倍以上(表1)。
2.3 原核表達載體pGEX6p-1-DUF6的構建、誘導和純化
以秈稻品種75-1-127的cDNA為模板,設計正反向引物OsDUF6-6P-1-F、OsDUF6-6P-1-R,進行PCR擴增OsDUF6編碼區的1449bp序列(圖3A),將目的片段導人原核表達載體pGEX6p-1中獲得重組質粒,并將重組質粒轉化到大腸桿菌Rosetta中。
挑取陽性克隆于含Amp+的LB液體培養基中擴繁菌體,經IPTG誘導表達后進行10%SDS-PAGE電泳和考馬斯亮藍染色檢測(圖3B)。結果表明,在加入IPTG的重組質粒的宿主菌樣品中存在1條高豐度的蛋白質條帶,相對分子質量約80kD,與預期大小一致(原核表達載體pGEX6p-1中GST標簽的大小約26kD,而OsDUF6相對分子質量約57kD,兩者融合蛋白的總分子量大小與SDS-PAGE結果基本一致)。而誘導的蛋白主要在上清表達,說明OsDUF6蛋白具有較強的可溶性。
大量誘導重組蛋白,超聲破碎后收集上清。經親和層析柱純化后得到的重組蛋白進行SDS-PAGE檢測。結果發現,有一條單一且大小與預期相符的條帶(圖3C),說明獲得純化的OsDUF6蛋白。
為了進一步驗證所誘導重組蛋白的準確性,用GST標簽抗體進行Western blotting檢測,發現GST抗體能特異性的識別pGEX6p-1-OsDUF6載體所表達的蛋白(圖4A),該結果表明成功誘導出GST-OsDUF6重組蛋白。
2.4 GST-OsDUF6重組蛋白驗證抗體特異性
為了初步驗證多克隆抗體是否制備成功,以GST-OsDUF6作為對照,驗證抗體結合GST-OsDUF6的特異性。取適量體積誘導的蛋白進行SDS-PAGE電泳后轉膜,一抗按照1-500稀釋比例進行Westernblotting分析。結果顯示以上所制備的3個抗體均能與重組蛋白GST-OsDUF6結合(圖4-B、C、D),其中Anti-DUF6-1結合特異性最高,而Anti-DUf6-2及Anti-DUF6-3結合非特異蛋白能力較強。因此針對Anti-DUF6-1多克隆抗體進行下一步驗證。
2.5 轉基因水稻植株驗證抗體特異性
為了進一步驗證,提取陽性OsDUF6的過表達轉基因植株以及非轉基因植株的總蛋白,并利用制備的抗體進行Western blotting分析。結果顯示,在非轉基因植株和過表達植株中都能檢測到與OsDUF6蛋白大小一致的目的條帶,并且過表達植株中目的蛋白豐度明顯高于非轉基因植株,符合轉基因水稻植株過表達特性(圖5),說明Anti-DUF6-1多克隆抗體能夠特異性識別水稻內源的OsDUF6蛋白。根據上述結果綜合分析,通過人工合成短肽成功制備出水稻未知功能結構域蛋白OsDUF6的特異性抗體,可正常運用于后續OsDUF6的蛋白功能研究。
3 討論與結論
DUFs家族基因具有的生物學功能是各不相同的。近年來的研究發現,植物中有相當數量并且特有的DUFs能夠參與植物中的一些生理生化反應,如調控植物生長發育、非生物脅迫反應以及病蟲害的防御反應。
本研究通過對OsDUF6基因的生物信息學分析,從中選取了3段不同的氨基酸區域作為抗原進行抗體制備,并利用Tetras多通道多肽合成儀進行人工合成氨基酸序列。通過高效液相色譜法(HPLC)對3條短肽的蛋白純度進行自檢并免疫新西蘭雄性大白兔,進而得到效價為1:512000的3種抗體。目前抗體制備中普遍采用原核表達系統獲取目的蛋白的方法。雖然操作性強、成本低,但有一定的局限性,首先在進行重組蛋白的誘導時,需對蛋白誘導的條件(如溫度、轉速、誘導劑濃度等)進行探索,耗費大量的時間,不利于進行下一步研究;其次,表達可溶性蛋白的效率較低,尤其對于分子量偏大的蛋白,如基因片段大于3kb的蜘蛛絲蛋白表達效率受限;此外,宿主菌(大腸桿菌)自身含有有毒蛋白,可能存在產物中影響重組蛋白的純度等。本研究利用儀器人工合成多肽進行抗體制備,該方法方便快捷,合成的蛋白純度高、抗體的特異性好,時間短,并且隨著分子生物學技術的發展,人工合成多肽的技術已經日益成熟,因此該方法逐漸被科研工作者所推廣。
在驗證抗體特異性上,本研究利用原核誘導表達系統首先對制備的抗體進行初步驗證,結果發現Anti-DUF6-1多克隆抗體能特異性結合重組蛋白GST-DUF6并且非特異結合少。但Anti-DUF6-1結合誘導重組蛋白不能直接說明抗體的實用性,需具有植物內源蛋白特異性結合能力才能最終運用于后續研究中。以經鑒定成功的轉基因過表達水稻植株作為衡量抗體實用性的標準,在驗證結果中表明Anti-DUF6-1能特異性識別植物內源OsDUF6蛋白,且過表達水稻植株OsDUF6蛋白含量明顯高于非轉基因植株。由此推斷該制備的抗體可以用于水稻OsDUF6蛋白的功能分析。
總體來說,本研究成功制備出未知功能域蛋白OsDUF6的抗體,能特異性識別水稻內源OsDUF6蛋白,對下一步用轉基因植物進行功能分析具有重要意義。后續可對OsDUF6轉基因水稻進行表型鑒定,研究轉基因水稻在人工處理前后蛋白水平的變化,進而研究OsDUF6在水稻中的生物學功能;OsDUF6抗體還能運用于研究該基因在水稻中的表達模式,分析該基因在水稻根、莖、葉及其他器官的表達水平。因此,OsDUF6多克隆抗體的制備,有利于進一步研究OsDUF6在水稻中的生物學功能。

