用于藥物毒性評價的微流控器官芯片技術
叢燁 王佑平 韓夏荷 鄧權峰 羅勇 張秀莉
摘要 微流控器官芯片技術的學術研究正在蓬勃發展,其在毒效學方面也又有了越來越多的應用。該技術能實時地、連續地進行指標測量,可實現藥物毒性的動態評價。其次,該技術可將藥物代謝過程與靶器官的損傷過程進行整合,實現藥物代謝物的毒效評價。最后,器官芯片上如全部采用人源細胞,可有效避免因種屬差異帶來的假陽性/假陰性。正是由于上述優勢,多種臟器的微流控器官芯片都曾用于藥物的毒性評價研究,本文將重點介紹用于肝毒性、腎毒性、心臟毒性的器官芯片的進展。
關鍵詞 器官芯片;藥物毒性;藥物代謝;肝毒性;腎毒性;心臟毒性
Organ-on-chip Technology for Drug Toxicity Evaluation
CONG Ye1,WANG Youping2,HAN Xiahe2,DENG Quanfeng2,LUO Yong1,ZHANG Xiuli2
(1 Dalian University of Technology,Dalian 116024,China; 2 College of Pharmaceutical Sciences,Soochow University,Suzhou 215123,China)
Abstract The academic research of organ-on-chip technology is developing vigorously.It also has more and more applications in toxicology.The technology can carry out real-time and continuous index measurement to dynamically evaluate the toxicity of drugs; secondly,the technology can integrate drugs metabolic process with the damage process of the target organ to realize the toxicity evaluation of drug metabolites.Finally,the organ-on-a-chip technology can all use human cells,effectively avoiding false positives/false negatives due to species differences.It is precisely because of the above advantages that microfluidic organ chips for various organs have been used in drug toxicity evaluation studies.This paper will focus on the progress of organ chips for liver toxicity,nephrotoxicity,and cardiotoxicity.
Keywords Organ-on-a-chip; Drug toxicity; Drug metabolism; Hepatotoxicity; Nephrotoxicity; Cardiotoxicity
中圖分類號:R285;TP399文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2020.23.002
器官芯片屬于微流控芯片的一種特殊亞型,而微流控芯片是研究微米、亞微米尺度流體控制技術的一個分支。最初,微流控芯片與微色譜法和毛細管電泳結合,被用于構建一個“μ-TAS”或“芯片上的實驗室”模型,以取代傳統的實驗室分析方法[1]。之后,隨著微流控芯片技術的廣泛應用,人們開始將其應用于細胞生物學和細胞分析領域,并在技術上實現了芯片上的細胞培養、芯片上活體微環境的模擬和構建、單細胞分析芯片以及更進一步的“器官芯片”模型[2-3]。
器官芯片的目標是能夠在體外模擬人體器官的功能。為了達到該目標,它將細胞微環境、細胞共培養和細胞間的相互作用等多種因素整合到了微流控芯片上。具體而言,器官芯片可以根據細胞類型準確地調整與其生長和功能相關的環境條件,流動的培養基可以控制營養物質的供應,從細胞周圍去除積累的細胞廢物或次生代謝產物。此外,它還能調節氧合水平,提供剪應力,保證細胞層的屏障完整性,并能控制細胞在體外的遷移[4]。在器官芯片上,人們可以利用細胞重現許多傳統體外模型難以實現的功能。例如,重建組織屏障功能,培養實質組織,整合多種器官功能[5]。在過去的十年中,關于在芯片上構建有機系統的學術研究不斷推陳出新,研究人員實現了許多器官芯片技術的進一步發展。
器官芯片技術與類器官技術各有側重點,器官芯片技術強調微尺度對細胞微環境的調控,類器官技術強調干細胞的分化和自組裝[6]。近些年越來越多的研究將兩者的優勢結合在一起,即在微通道中,利用各種方法,對干細胞的微環境進行持續的調控,幫助其分化和自主裝成具有特異質性細胞的類組織。2019年,Dongeun Huh對該主題的最新應用進展進行了綜述,發表在Science上[7]。
藥物毒性評價是新藥研發的重要組成部分。藥物毒性評價的難點是在只有人源細胞和整體動物2個主要“工具”的情況下,評價候選藥物對人體器官可能造成的傷害程度。動物模型具有整體性,但與人體具有種屬差異[8],人源細胞沒有了該差異性,但整體性不強。而器官芯片技術剛好可以填補中間的空缺,它既可以保證人源性的細胞,又能表現出多種細胞相互作用后的毒效結果,即器官層面的毒效作用,而且還是在少量測試樣品的基礎上。上述特性正是中藥毒效評價亟需的。當前的中藥毒效研究,多集中于化合物-細胞,和提取物(組分)-動物這2個層面,中間的多化合物——器官層面的研究因為樣品和評價方法的缺乏,鮮少有人研究。而器官芯片技術剛好具有樣品需求量小和器官表觀功能的特性,未來在中藥毒效評價中將大有可為。
為了研究候選藥物對人體不同器官的毒性作用,科學家利用多種生物組織工程技術,構建了許多器官芯片,例如肝臟[9]、腎臟[10]、心臟[11]、神經[12]和多器官芯片[13]。在這篇綜述中,我們將重點介紹用于肝毒性、腎毒性、心臟毒性的器官芯片的進展。
1 用于藥物肝毒性評價的肝芯片
1.1 肝臟及藥物肝毒性 肝臟是人體內最大的內臟,以代謝功能為主,并在身體里面起著去氧化、儲存肝糖、分泌性蛋白質的合成等作用,也是外源性物質與內源性物質發生生物轉化、解毒的主要場所,是藥物毒性重要的靶器官。藥物肝損傷(Drug-induced Liver Injury,DILI)是急性、慢性肝病的重要致因,也是新藥研發失敗的主要原因。因此,進行藥物的肝毒性測試是藥物研發中的關鍵步驟。
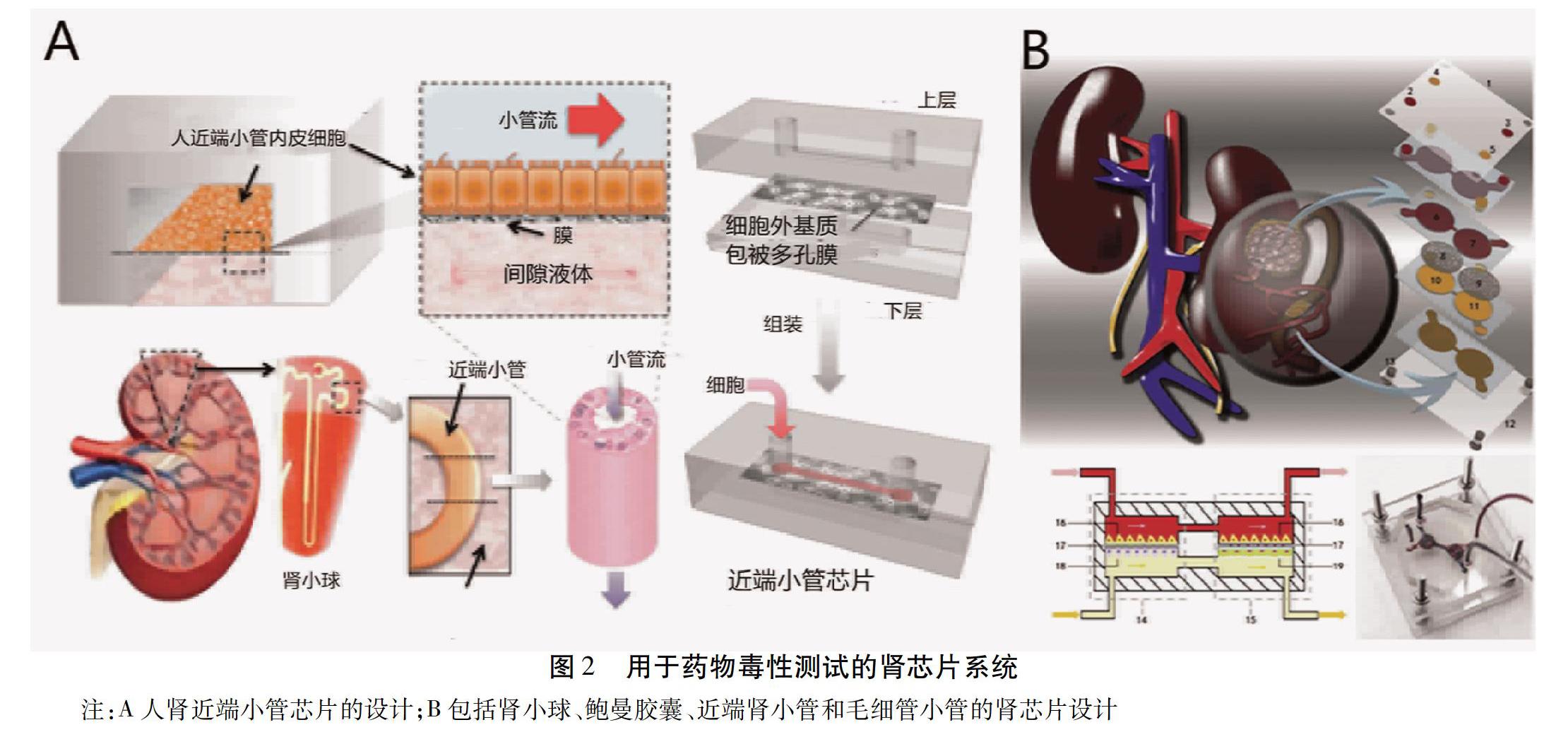
1.2 用于藥物毒性檢測的肝芯片 目前常用于安全性評價的模型是在體模型和體外模型,在體模型主要為動物實驗,它一直以來是毒性研究的金標準,但是實驗周期長、耗費財力、而且存在倫理、動物福利等問題,與人類的種屬差異不容忽視[14];而體外評價模型常使用永生化細胞系和原代分離的肝細胞,有限的通量,活力喪失快以及肝臟特異性功能和基因表達的降低是這些模型的常見缺點[15]。因此,建立既能保留體內細胞微環境的物質結構基礎、模擬體內肝臟組織各項功能、實現長期重復給藥,在進行藥物安全性評價時又能達到高效、準確、直觀、可控的體外肝毒評價體系是目前藥物肝毒性研究的熱衷方向。Bhise等[16]開發了一種用于長期培養人HepG2細胞或C3A細胞的肝芯片,采用光交聯明膠甲基丙烯酰基水凝膠包裹HepG2細胞或C3A細胞制成球體,再用生物打印機將這種球狀體排布于微流控芯片上,通過檢測特異性標志物的變化評估肝毒性。在該平臺中,球體在培養的30天內仍保持其活性,且證明了其應用于藥物毒性分析的可能性。Zuchowska等[17]基于微流控系統中長期3D球形的培養,用HepG2細胞檢測抗癌藥物5-氟尿嘧啶(5-FU)的肝毒性,并發現隨著球體直徑的增大,HepG2細胞對2個受試濃度的5-FU耐藥性降低。為建立有利于維持肝細胞功能、更加貼近體內的微環境,實現實質細胞與非實質細胞(星狀細胞、肝竇內皮細胞、枯否細胞)之間的共培養對于實現細胞間聯系以及信號分子的傳遞,增強肝細胞功能及肝的仿生性尤為重要。Kostadinova等[18]建立了一個允許肝細胞與非實質細胞包括枯否細胞、星狀細胞、肝竇內皮細胞以及膽管內皮細胞進行三維培養的尼龍支架,能夠長時間維持肝臟的特異性功能,并形成膽小管樣結構,對炎性反應刺激作出反應。Ma等[19]開發了一種模擬肝小葉樣結構的微流體裝置,實驗發現肝細胞(HepG2)與非實質細胞(HAECs)的共培養形成了肝索狀結構及肝竇結構,成功構建了具有仿生形態結構的三維肝小葉樣微組織,維持肝細胞和非實質細胞共培養能力使該系統成為毒性測試的替代方案。由此證明,在肝芯片中實現立體培養與共培養相結合一定程度上更加接近復雜的人體肝臟系統,不僅實現更長時間培養,保持良好的肝功能,更是接近于復雜的機體對藥物毒性的反應,是未來藥物毒性評價體外檢測的發展趨勢。Jang等[20]構建了特定種類(人、狗、大鼠)的雙細胞和四細胞培養的肝芯片,用于藥物的肝毒性測試以及確定作用機制和鑒定生物標志物等,不僅檢測DILI的不同表型,包括肝細胞損傷、膽汁淤積、枯否細胞耗竭、脂肪變性以及星狀細胞的激活可引起肝纖維化;還模擬測定人類與動物在藥物肝毒性測試時的相關性。見圖1A。
為增強肝細胞體外培養的仿生性,模擬體內微環境,器官芯片還與灌注培養技術相結合,模擬體內血液或其他流體對細胞的剪切力作用。Deng等[21]構建了由4種細胞系組成的肝竇芯片裝置,并使用蠕動泵驅動灌流,細胞組成、比例和空間排列與體內肝竇的生理性特征相似,并增強了HepG2細胞肝毒性藥物測試的敏感性,也實現了藥物間相互作用研究。除蠕動泵灌流外,重力驅動,紙基虹吸法以及CO2氣體驅動的灌流方式也與器官芯片有效結合。Yu等[22]構建了一種PIC芯片,脫離傳統芯片需要
在培養箱中培養的方法,自身集成氣泡與溫度處理裝置,此外通過CO2壓力驅動培養基流量并實現PH控制,14 d維持肝細胞特異性功能處于較好的水平,并能實現對乙酰氨基酚和雙氯芬酸進行急性和慢性重復劑量的藥物毒性測試。見圖1B。Jang等[23]在3D灌注芯片中加入相位引導器,實現沒有泵驅動的條件下進行灌流。近年來,對灌注培養技術的創新不僅更貼近體內微環境,也使芯片培養裝置簡單化,更適用于藥物毒性測試。肝損傷的發生和發展是一個動態過程,僅使用終點測量無法正確表征。對此,肝芯片通過與其他生物傳感器相結合,無論有無流量,均可實現對許多細胞參數的實時監測。例如熒光生物傳感器的結合和活細胞3D成像允許在整個研究中直接評估細胞形態和行為,此外,與生物反應器耦合的電化學傳感器提供了關于細胞或特定細胞器的功能狀態的更多信息,并且可以提供對氧攝取的實時監測。Bavli D等[24]提出了一種跟蹤線粒體功能障礙動態,實時模擬肝損傷的肝臟芯片裝置,使用組織嵌入的磷光微探針的雙頻相位調制實時監測線粒體呼吸狀況,通過計算機控制的微流體開關允許連續電化學測量葡萄糖和乳糖,提供從氧化磷酸化到無氧糖酵解的微小轉變的實時分析,以此來表明線粒體應激受損狀況。除此之外,一些肝芯片還開發了高通量快速監測系統,以便快速評價藥物的藥效和毒性,Riahi等[25]研制了一種用于細胞分泌生物標志物在線檢測的微流珠電化學免疫傳感器,實現對肝芯片中細胞分泌的生物標記物進行在線監測,以此為藥物肝毒性的長期體外評估和實時監測提供了一個新的平臺。
微流控芯片其小型化和流通式操作大大減少了樣品消耗,同時顯著提高了檢測的可靠性、分辨率和靈敏度。Kwon等[26]設計了一種基于藥物代謝毒性機制可用于高通量篩選的Teamchip,可以預測潛在的新陳代謝誘導的藥物和候選藥物的肝毒性。可用于高通量篩選的肝芯片不僅簡化數據收集難度,也降低了研究成本。除此之外,3D生物打印技術與器官芯片的聯用也是研究的熱門方向,Massa等[27]通過集成水凝膠支架、3D生物打印和微流控技術,設計了一種帶血管層的3D肝臟結構,實驗證明該平臺能有效的模擬肝血管層,利于觀察和預測微循環水平的藥物肝毒性機制。除此之外,Nguyen等[28]將患者來源的肝原代細胞與3D生物打印技術相結合,可有效地模擬DILI。使用3D生物打印技術實現肝芯片或肝臟組織的快速高通量生產會大大降低生產成本,并降低操作難度。用于藥物毒性測試的肝芯片是開發肝毒性預測體外模型的重大進展,當然未來仍面臨著諸多挑戰。由干細胞培育形成類器官一直是近來的研究熱點,將類器官培育與器官芯片相結合能更好的對類器官及其生長微環境控制,加強組織間及多器官間的相互作用,其研究仍在進行中。通常3D肝臟模型局限于僅反映肝臟內的毒性反應,肝臟與循環中其他器官或細胞的體內相互作用缺失,對于相互作用所導致的肝毒性無法進行預測,還需適合長期培養的多器官芯片對此類藥物進行毒性測試。
1.3 小結 藥物性肝損傷(DILI)是在藥物使用過程中,因藥物本身及其代謝產物或由于特殊體質對藥物的超敏感性或耐受性降低所導致的肝臟損傷。近年來我國藥物性肝損傷的發生率普遍高于西方國家,其中保健品及中藥占26.81%[29]。仿生微流控器官芯片是基于組織工程、生物材料和微流體力學前沿技術發展起來的一個新興領域,它具有方便、靈敏、快速、高通量等優點,在藥效和毒性評價中具有重要的應用前景。利用肝芯片對中藥進行慢性毒性檢測以獲取肝損傷時藥物的最大劑量及作用機制,為后續臨床用藥提供更加準確的服務。隨著研究工作的不斷進展,仿生微流控器官芯片技術將越來越趨向成熟,有可能作為動物實驗體外替代模型,在化合物藥效和毒理評價中得到實際應用。
2 用于藥物腎毒性評價的腎芯片
2.1 腎臟及藥物腎毒性 藥物腎毒性(Drug-induced Nephrotoxicity,DIN)是一類較嚴重的藥物毒性,在臨床環境中,藥物腎毒性約占嚴重藥物不良反應的25%。目前,動物和二維細胞模型是檢測DIN的常用工具。由于動物和人類間的物種種屬差異,使用動物模型得到的腎毒性預測結果參考性有限。而二維細胞模型往往許多生物標志物的表達水平較低。近年來,腎芯片模型由于高仿生性逐漸被用于測試藥物腎毒性,腎芯片模型可以實現多種細胞的共培養、體內微環境模擬和體外生物標志物分析。此類模型具有作為DIN篩選新型標準的潛力。
2.2 用于藥物毒性檢測的腎芯片 腎芯片的一種常見類型是夾膜結構,聚二甲基硅氧烷(PDMS)層和微流控通道之間放置細胞外基質包被的多孔膜,并在該多孔膜上進行腎細胞的培養[30-32]。LeClerc的小組建立了一種微流控腎芯片來研究丙烯醛和異環磷酰胺的腎毒性[31]。Van der Meer的團隊在腎芯片平臺上集成了TEER(跨膜電阻)測量,以評估人腎上皮細胞和狗腎小管細胞等相關細胞的細胞屏障功能[33]。Jang組在人近端小管芯片上檢測了順鉑毒性和P-糖蛋白(P-GP)外排轉運體活性。與傳統的細胞模型比較,在腎芯片模型上得到的結果與體內實驗結果具有更好的相關性,這也是在器官芯片平臺上使用人原發性腎小管細胞進行腎毒性研究的首次報道[30]。見圖2A。Kim等[34]利用Madin-Darby犬腎(MDC K)細胞在纖維涂層多孔膜上構建了夾膜結構的PDMS芯片,并利用該模型研究了慶大霉素腎毒性動力學。檢測了KIM-1,細胞活死,ZO-1表達等指標,結果表明,高濃度暴露于慶大霉素會破壞MDCK細胞間的緊密連接,降低細胞活力,增加膜透性,證明了該腎芯片對藥物腎毒性研究的潛力。
Sakolish組使用永生細胞系模擬了腎小球和近端小管的功能[35]。除了為HK-2細胞提供剪切壓力培養環境外,該平臺還包含一個培養有HUVECs的腎小球過濾器,以在設備內提供更加仿生的原尿。在此基礎上,該小組評估了順鉑和環孢素的DIN,結果表明,在這種微流控裝置中培養的HK-2細胞更敏感。流體剪應力的存在可促進近端腎小管上皮細胞(PTECs)保留更成熟的表型,并發展形成腎小球芯片模型。Weber和他的團隊將單通道微生理系統(MPS)和PTECs結合,在體外重建了人近端小管的生理功能,并利用該平臺評價了多黏菌素的腎毒性。當PTECs暴露于多黏菌素B時,包括KIM-1和一組與損傷相關的miRNAs在內的損傷信號表達明顯增加。該平臺可以對新化合物進行安全檢測,并定義分子的不同毒理學途徑反應[36]。
原代大鼠腎細胞也常被用于目前的腎臟芯片模型。Wang組利用鼠原代腎細胞構建了一個腎小球芯片,在器官水平上重建了部分腎功能,以模擬高糖環境下腎小球的刺激。該裝置由平行通道組成,其中原代腎小球微組織包括腎小球內皮細胞,三維基底膜和足細胞。這些組織與液體流動結合,模擬腎小球濾過屏障(GFB)的功能[37]。Li等[38]在微流控芯片上培養原代大鼠腎小球內皮細胞(GECs)模擬腎屏障的選擇通透性,然后通過檢測ZO-1蛋白的表達來研究鎘誘導的腎毒性。Qu等[39]構建了一個模擬腎單位的微流控平臺,該裝置包含腎小球、鮑曼式囊、近端腎小管和毛細管。見圖2B。將順鉑和阿霉素加入含有牛血清白蛋白、E-cadherin和血管內皮生長因子(VEGF)的“腎血流”中,并通過熒光成像記錄多種原代腎細胞的損傷。結果表明,該裝置內置的復雜微環境使腎臟細胞對藥物腎毒性更加敏感,為藥物誘導的腎毒性檢測提供了新的見解。
2.3 小結 腎芯片模型在腎毒性試驗中顯示出一系列優勢。例如,流體剪切應力的存在使細胞對藥物更加敏感,原代細胞的使用使體外腎毒性試驗與體內結果在生理上更加相關。盡管如此,在腎芯片平臺上的高通量篩選尚未實現。此外,藥物代謝產物引起的腎毒性很難通過腎芯片模型直接研究。腎芯片與其他器官芯片,特別是與肝芯片的聯用是深入研究新藥候選化合物腎毒性的理想方法。同時,這種檢測方法還迫切需要系統地結合體外,體內和臨床檢查,確定合適的生物標志物,可以有效和安全地檢測和治療,以得到診斷和監測腎臟損傷和恢復的可靠結果。
3 用于藥物心臟毒性評價的心臟芯片
3.1 心臟及藥物心臟毒性 “心臟毒性”是指藥物對心臟組織造成的直接損害和藥物對血流動力學的影響造成的間接損害,如引起心臟血栓形成[40]。“心臟毒性”最初是在1946年提出的,目的是描述局部麻醉劑、水銀利尿劑和洋地黃對心臟的毒性作用。在20世紀70年代后期,它被用來描述由蒽環類,阿霉素和5-氟尿嘧啶引起的心臟并發癥[41]。
心臟毒性是藥物臨床試驗失敗和退出市場的主要原因之一,因此藥物心臟毒性的臨床前篩選是至關重要的。目前,二維細胞培養模型和動物模型占據藥物心臟毒性評估的主導地位;然而,二維細胞模型不能重現體內心臟組織的復雜結構和微環境,動物模型在離子通道、生物途徑和藥代動力學方面與人類差異很大,它們還不能完全再現人體生理功能。在許多情況下,傳統模型不能準確預測藥物對人體是否存在心臟毒性。其他心臟毒性篩查技術,如如膜片鉗,往往涉及勞動密集型和侵入性的細胞操作[42]。綜上所述,有必要建立一個仿生性良好、更準確、簡單的體外模型用于心臟毒性的測試。
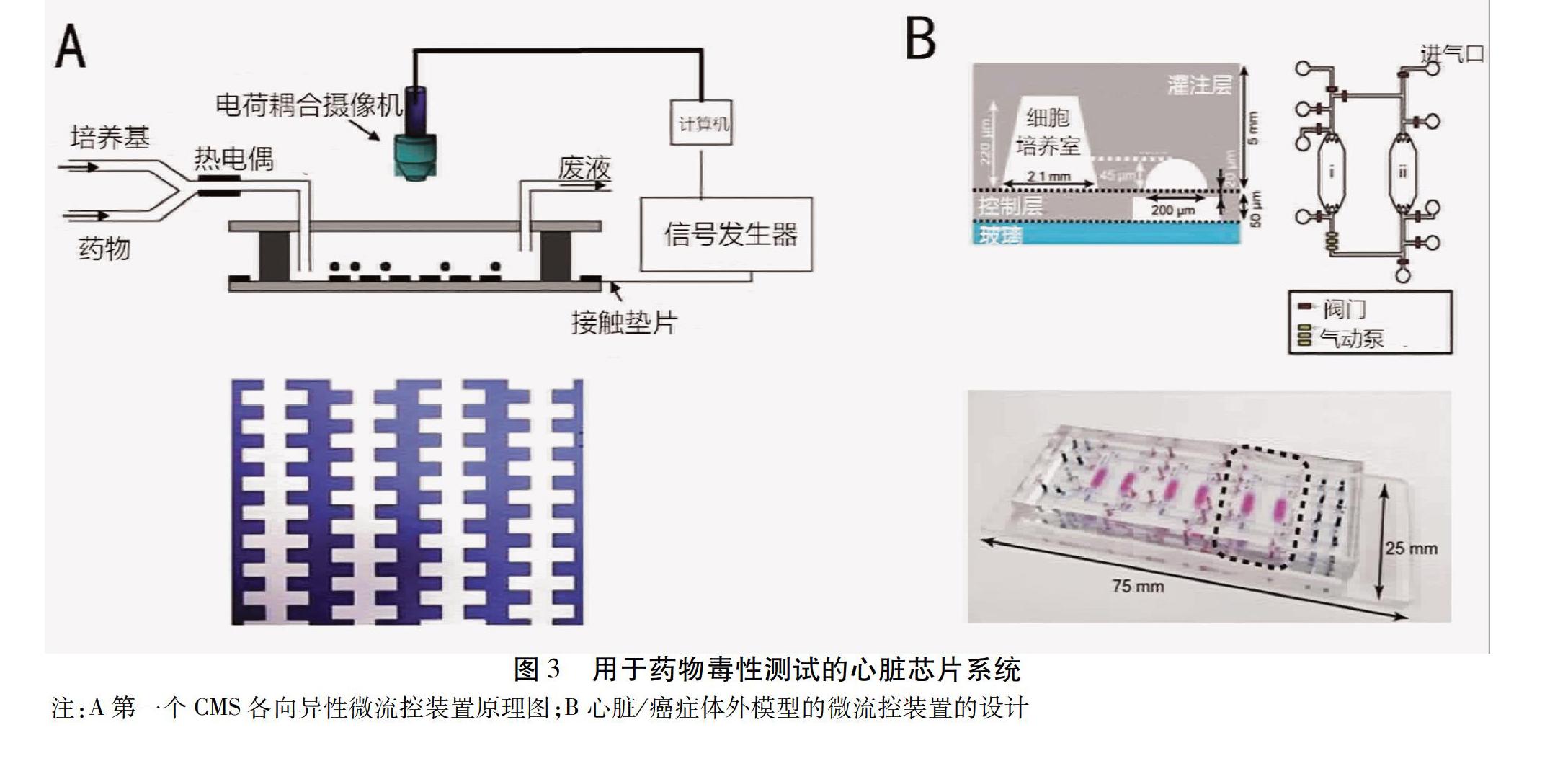
3.2 用于藥物毒性檢測的心臟芯片 電刺激可促進心肌細胞的體外成熟。采用電刺激的心臟芯片技術已逐漸成熟。楊建民等[43]首次報道了實現心肌細胞各向異性的微流控裝置。見圖3A。Qian等[44]構建了一個由用于電位場指示的微電極陣列(MEA)和用于轉換的交錯電極陣列組成一個心臟芯片模型。該平臺利用人誘導多能干細胞(hiPSC-CMs)衍生的心肌細胞(CMs)作為細胞材料,分別測量了心肌細胞在生理條件和藥物刺激下的電生理和收縮力。微電極(主要是MEA)的電刺激顯著增強了心臟細胞的結構和排列。利用這一心臟芯片模型測試了一種用于治療低血壓和心力衰的臨床藥物去甲腎上腺素的作用。Maoz等[45]建立了一種集成MEA和電極的微流控裝置,通過TEER驗證了組織屏障功能,有助于了解心臟藥效學。該裝置由MEA、PDMS層、聚乙烯(PET)薄膜、頂部芯片通道和TEER電極組成。在PET膜上覆蓋一層HUVEC,在MEA表面培養HIPSC-CM。該裝置可用于監測炎性反應和腎上腺素藥物對心功能的影響。Caluori等[46]在心臟芯片上集成了一種機電細胞生物傳感器,可以同時檢測心臟興奮-收縮耦合。他們使用該系統測試藥物刺激下細胞的反應,結果表明該系統對鈣通道藥物異丙腎上腺素和維拉帕米產生劑量依賴性反應,證明該裝置在藥物篩選和藥物心臟毒性測試中具有應用潛力。Ville等[47]構建了基于人多能干細胞源性心肌細胞的微電極陣列芯片和多級陣列。該方法能夠構建類似于天然心肌的分層心臟組織,并測量電生理數據。該系統通過測量hiPSC-CMs在存在心臟毒性前藥(Terfenadine)及其非心臟毒性代謝物(Fexofenadine)的情況下的藥物反應,證明hiPSC-CMs具有用于藥物心臟毒性篩查的潛力。
除了電刺激外,目前還有許多心臟芯片試圖在體外模擬心肌的環狀單軸應變。Marsano等[48]開發了一種具有心包積水的心臟芯片,通過傳導機械刺激促進心肌細胞成熟,改善電刺激起搏性能,并對心臟組織起搏進行分析。Parker小組采用肌肉薄膜技術(MTF)構建了心臟芯片,進一步提高了MTF的吞吐量。該裝置反映了β腎上腺素受體激動劑異丙腎上腺素對新生大鼠心室CMS收縮能力的影響[49]。在此基礎上,Parker小組組裝了柔性薄膜傳感器,并開發了一種高通量微流控裝置,可以同時讀取24個心肌組織的收縮應力和搏動速率。
最近,科學家提出了一種Biowire平臺,其中心肌細胞嵌入在水凝膠中,心臟組織懸浮在兩根聚合物絲上的PDMS微井中,模擬心臟中肌肉纖維的生長。當心肌細胞收縮時,對纖維絲產生一個可測量的偏轉,轉化為心臟的搏動信號[50]。在最新的研究,趙等人第一次使用可生物降解的、彈性可紫外聚合的POMaC聚合物材料,為細胞生長創造一個二維網格,稱為Biowire II平臺。該平臺模擬了不同心房和心室的異極心臟組織,可同時定量力和鈣離子瞬變[51]。
雖然絕大多數的心臟芯片設備都用于模仿心肌,但近年來已經報道了結合心臟和其他器官組織的心血管模型和系統的研究。Ellis等[52]開發了一種通過空間控制CMs和內皮細胞的共培養的微流控裝置,以模擬人心肌及其周圍的微血管。Kamei等[53]報道了一種基于軟光刻法的微流控裝置,使用集成的氣動閥門和泵來產生精確的流體流動來模擬癌癥藥物的不良反應。該平臺能夠模擬血液循環系統并連接各種組織細胞,實現在不同腔室中共培養人健康心臟細胞(HCMs)和肝癌細胞(HepG2)。見圖3B。該裝置評估了阿霉素對心臟細胞的不良反應,這是由HepG2細胞通過循環向心臟細胞輸送有毒代謝物引起的。
3.3 小結 藥物引起的心臟毒性是藥物開發中的一個關鍵問題。目前的體外方法在預測、判斷和治療心臟毒性方面缺乏準確性。微流控技術的發展使心臟芯片成為一種新型的體外工具,但仍有幾個核心問題需要解決,如由于芯片厚度過高,難以實現精確的實時成像[54]。目前的研究重點是通過集成高效液相色譜法、質譜法和電泳[55]等片上分析技術來解決這些問題。除此之外,心臟芯片的另一個挑戰是將不同類型的細胞整合到單個組織中,以更好地模擬體內環境。然而,由于體內環境的復雜性和組織穩定性所需的長期體外培養,這可能是一個高成本且具有挑戰性的過程。心臟芯片可以集成傳感設備、多細胞共培養和三維組織形成,是一項發展迅速,潛力巨大的新技術,有望成為評價藥物心臟毒性的新型臨床前藥物篩選工具。
4 用于藥物毒性評價的生物標志物
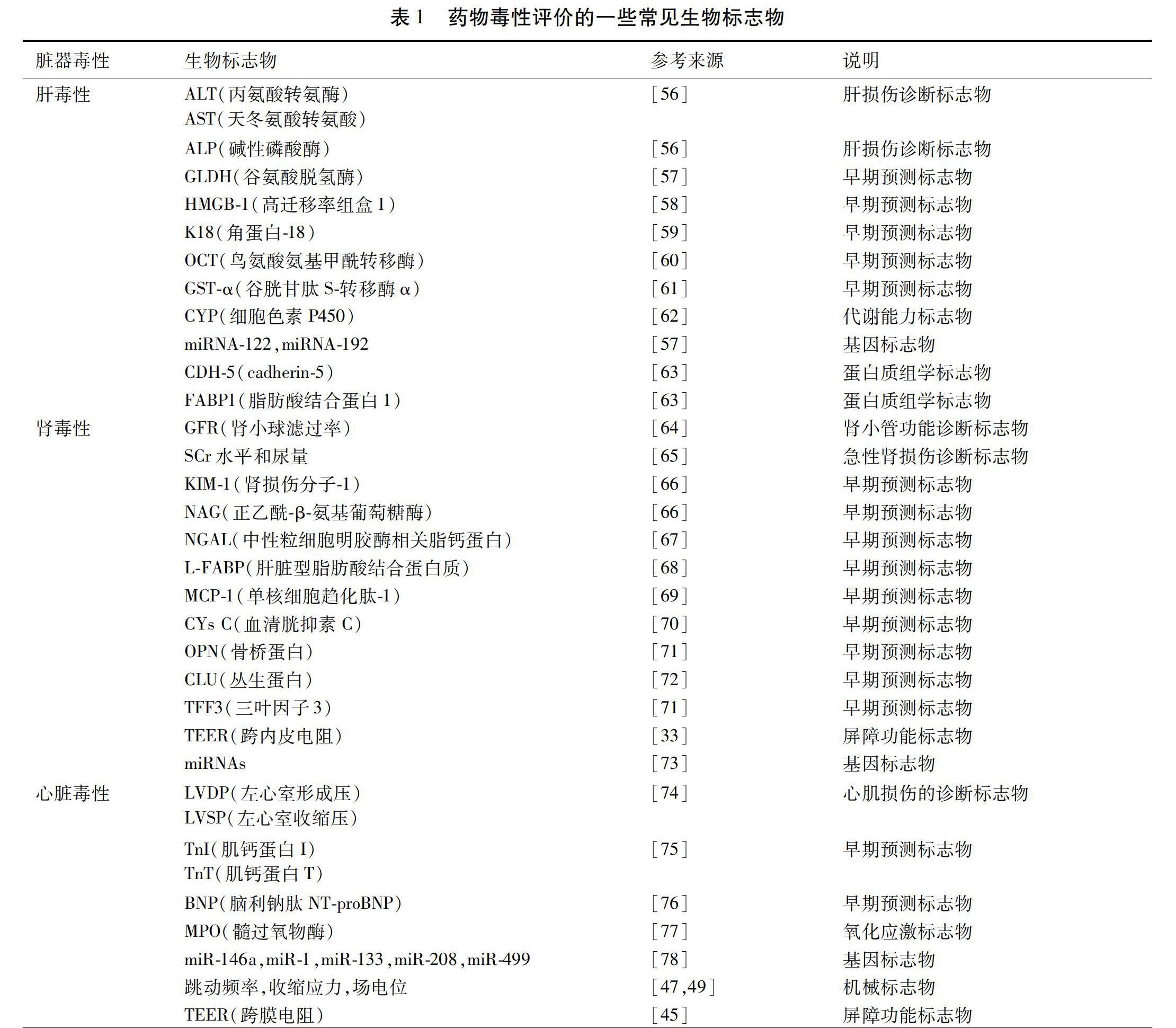
器官芯片用于藥物毒性評價的優勢之一是可以在不同時期、對不同生物標志物進行定量測定,因此生物標志物的選擇是器官芯片研究的重要內容。生物標志物既要兼顧檢測限,又要考慮其生理功能。本文特意總結了各種體外評價方法中曾用到的肝毒性、腎毒性、心臟毒性生物標志物。見表1。它們中只有少部分已用于器官芯片的毒性評價中。我們正在進行將它們組合后的器官芯片毒性評價工作,期望能為毒性評價帶來更多有用的信息。
5 總結與展望
在臨床前藥物開發中,利用人體細胞預測候選化合物的毒性以提高臨床試驗的成功率是幾乎所有主要制藥公司都在探索的課題。器官芯片可以在體外為細胞,組織或器官提供良好的生存環境,增強其功能和對藥物刺激的敏感性,這在藥物毒性中非常重要。美國食品和藥品管理局(FDA)和其他國家的藥物監管機構已經開始關注器官芯片技術,該技術有可能在食品/藥品的臨床前測試中取代動物模型。目前器官芯片在材料、細胞來源、通量和仿生性等方面仍面臨著一些挑戰,特別是與臨床數據進行有效的轉換,是器官芯片在毒性評價領域的“卡脖子”問題。但隨著多器官聯用和干細胞誘導等技術的發展,上述問題有望被攻克,從而使得器官芯片技術形成一種新的藥物毒性評價標準。
參考文獻
[1]Yeo LY,Chang HC,Chan PP,et al.Microfluidic devices for bioapplications[J].Small,2011,7(1):12-48.
[2]Volpatti LR,Yetisen AK.Commercialization of microfluidic devices[J].Trends Biotechnol,2014,32(7):347-350.
[3]Zhuang Q C,Ning R Z,Ma Y,et al.Recent Developments in Microfluidic Chip for in vitro Cell-based Research[J].Chinese Journal of Analytical Chemistry,2016,44(4):522-532.
[4]Bhatia SN,Ingber DE.Microfluidic organs-on-chips[J].Nat Biotechnol,2014,32(8):760-772.
[5]Zhang B,Korolj A,Lai B F L,et al.Advances in organ-on-a-chip engineering[J].Nature Reviews Materials,2018,3(8):257-278.
[6]Fatehullah A,Tan SH,Barker N.Organoids as an in vitro model of human development and disease[J].Nat Cell Biol,2016,18(3):246-254.
[7]Park SE,Georgescu A,Huh D.Organoids-on-a-chip[J].Science,2019,364(6444):960-965.
[8]Caplin JD,Granados NG,James MR,et al.Microfluidic Organ-on-a-Chip Technology for Advancement of Drug Development and Toxicology[J].Adv Healthc Mater,2015,4(10):1426-1450.
[9]Knowlton S,Tasoglu S.A Bioprinted Liver-on-a-Chip for Drug Screening Applications[J].Trends Biotechnol,2016,34(9):681-682.
[10]Faria J,Ahmed S,Gerritsen K,et al.Kidney-based in vitro models for drug-induced toxicity testing[J].Arch Toxicol,2019,93(12):3397-3418.
[11]Conant G,Lai B,Lu R,et al.High-Content Assessment of Cardiac Function Using Heart-on-a-Chip Devices as Drug Screening Model[J].Stem Cell Rev Rep,2017,13(3):335-346.
[12]van de Wijdeven R,Ramstad OH,Bauer US,et al.Structuring a multi-nodal neural network in vitro within a novel design microfluidic chip[J].Biomed Microdevices,2018,20(1):9.
[13]Rezaei Kolahchi A,Khadem Mohtaram N,Pezeshgi Modarres H,et al.Microfluidic-Based Multi-Organ Platforms for Drug Discovery[J].Micromachines(Basel),2016,7(9):162.
[14]Hartung T.Toxicology for the twenty-first century[J].Nature,2009,460(7252):208-212.
[15]Han W,Wu Q,Zhang X,et al.Innovation for hepatotoxicity in vitro research models:A review[J].J Appl Toxicol,2019,39(1):146-162.
[16]Bhise NS,Manoharan V,Massa S,et al.A liver-on-a-chip platform with bioprinted hepatic spheroids[J].Biofabrication,2016,8(1):014101.
[17]Zuchowska A,Kwapiszewska K,Chudy M,et al.Studies of anticancer drug cytotoxicity based on long-term HepG2 spheroid culture in a microfluidic system[J].Electrophoresis,2017,38(8):1206-1216.
[18]Kostadinova R,Boess F,Applegate D,et al.A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity[J].Toxicol Appl Pharmacol,2013,268(1):1-16.
[19]Ma C,Zhao L,Zhou EM,et al.On-Chip Construction of Liver Lobule-like Microtissue and Its Application for Adverse Drug Reaction Assay[J].Anal Chem,2016,88(3):1719-1727.
[20]Jang KJ,Otieno MA,Ronxhi J,et al.Reproducing human and cross-species drug toxicities using a Liver-Chip[J].Sci Transl Med,2019,11(517):5516.
[21]Deng J,Zhang X,Chen Z,et al.A cell lines derived microfluidic liver model for investigation of hepatotoxicity induced by drug-drug interaction[J].Biomicrofluidics,2019,13(2):24101.
[22]Yu F,Deng R,Hao Tong W,et al.A perfusion incubator liver chip for 3D cell culture with application on chronic hepatotoxicity testing[J].Sci Rep,2017,7(1):14528.
[23]Jang M,Neuzil P,Volk T,et al.On-chip three-dimensional cell culture in phaseguides improves hepatocyte functions in vitro[J].Biomicrofluidics,2015,9(3):34113.
[24]Bavli D,Prill S,Ezra E,et al.Real-time monitoring of metabolic function in liver-on-chip microdevices tracks the dynamics of mitochondrial dysfunction[J].Proc Natl Acad Sci U S A,2016,113(16):E2231-2240.
[25]Riahi R,Shaegh SA,Ghaderi M,et al.Automated microfluidic platform of bead-based electrochemical immunosensor integrated with bioreactor for continual monitoring of cell secreted biomarkers[J].Sci Rep,2016,6:24598.
[26]Kwon SJ,Lee DW,Shah DA,et al.High-throughput and combinatorial gene expression on a chip for metabolism-induced toxicology screening[J].Nat Commun,2014,5:3739.
[27]Massa S,Sakr MA,Seo J,et al.Bioprinted 3D vascularized tissue model for drug toxicity analysis[J].Biomicrofluidics,2017,11(4):44109.
[28]Nguyen DG,Funk J,Robbins JB,et al.Bioprinted 3D Primary Liver Tissues Allow Assessment of Organ-Level Response to Clinical Drug Induced Toxicity In Vitro[J].PLoS One,2016,11(7):e0158674.
[29]Shen T,Liu Y,Shang J,et al.Incidence and Etiology of Drug-Induced Liver Injury in Mainland China[J].Gastroenterology,2019,156(8):2230-2241.
[30]Jang KJ,Mehr AP,Hamilton GA,et al.Human kidney proximal tubule-on-a-chip for drug transport and nephrotoxicity assessment[J].Integr Biol(Camb),2013,5(9):1119-1129.
[31]Snouber LC,Letourneur F,Chafey P,et al.Analysis of transcriptomic and proteomic profiles demonstrates improved Madin-Darby canine kidney cell function in a renal microfluidic biochip[J].Biotechnol Prog,2012,28(2):474-484.
[32]Ferrell N,Ricci KB,Groszek J,et al.Albumin handling by renal tubular epithelial cells in a microfluidic bioreactor[J].Biotechnol Bioeng,2012,109(3):797-803.
[33]Odijk M,van der Meer AD,Levner D,et al.Measuring direct current trans-epithelial electrical resistance in organ-on-a-chip microsystems[J].Lab Chip,2015,15(3):745-752.
[34]Kim S,LesherPerez SC,Kim BC,et al.Pharmacokinetic profile that reduces nephrotoxicity of gentamicin in a perfused kidney-on-a-chip[J].Biofabrication,2016,8(1):15021.
[35]Sakolish C M,Mahler G J.A novel microfluidic device to model the human proximal tubule and glomerulus[J].RSC Advances,2017,7(8):4216-4225.
[36]Weber EJ,Lidberg KA,Wang L,et al.Human kidney on a chip assessment of polymyxin antibiotic nephrotoxicity[J].JCI Insight,2018,3(24):e123673.
[37]Wang L,Tao T,Su W,et al.A disease model of diabetic nephropathy in a glomerulus-on-a-chip microdevice[J].Lab Chip,2017,17(10):1749-1760.
[38]Li Z,Jiang L,Tao T,et al.Assessment of cadmium-induced nephrotoxicity using a kidney-on-a-chip device[J].Toxicol Res(Camb),2017,6(3):372-380.
[39]Qu Y,An F,Luo Y,et al.A nephron model for study of drug-induced acute kidney injury and assessment of drug-induced nephrotoxicity[J].Biomaterials,2018,155:41-53.
[40]Brana I,Tabernero J.Cardiotoxicity[J].Annals of Oncology Official Journal of the European Society for Medical Oncology,2018,21(7):i173.
[41]Chung R,Ghosh AK,Banerjee A.Cardiotoxicity:precision medicine with imprecise definitions[J].Open Heart,2018,5(2):e000774.
[42]Doherty KR,Talbert DR,Trusk PB,et al.Structural and functional screening in human induced-pluripotent stem cell-derived cardiomyocytes accurately identifies cardiotoxicity of multiple drug types[J].Toxicol Appl Pharmacol,2015,285(1):51-60.
[43]Yang M,Zhang X.Electrical assisted patterning of cardiac myocytes with controlled macroscopic anisotropy using a microfluidic dielectrophoresis chip[J].Sensors & Actuators A Physical,2007,135(1):73-79.
[44]Qian F,Huang C,Lin YD,et al.Simultaneous electrical recording of cardiac electrophysiology and contraction on chip[J].Lab Chip,2017,17(10):1732-1739.
[45]Maoz BM,Herland A,Henry O,et al.Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities[J].Lab Chip,2017,17(13):2294-2302.
[46]Caluori G,Pribyl J,Pesl M,et al.Non-invasive electromechanical cell-based biosensors for improved investigation of 3D cardiac models[J].Biosens Bioelectron,2019,15:124-125,129-135.
[47]Kujala VJ,Pasqualini FS,Goss JA,et al.Laminar ventricular myocardium on a microelectrode array-based chip[J].J Mater Chem B,2016,4(20):3534-3543.
[48]Marsano A,Conficconi C,Lemme M,et al.Beating heart on a chip:a novel microfluidic platform to generate functional 3D cardiac microtissues[J].Lab Chip,2016,16(3):599-610.
[49]Agarwal A,Goss JA,Cho A,et al.Microfluidic heart on a chip for higher throughput pharmacological studies[J].Lab Chip,2013,13(18):3599-3608.
[50]Nunes SS,Miklas JW,Liu J,et al.Biowire:a platform for maturation of human pluripotent stem cell-derived cardiomyocytes[J].Nat Methods,2013,10(8):781-787.
[51]Zhao Y,Rafatian N,Feric NT,et al.A Platform for Generation of Chamber-Specific Cardiac Tissues and Disease Modeling[J].Cell,2019,176(4):913-927.e18.
[52]Ellis BW,Acun A,Can UI,et al.Human iPSC-derived myocardium-on-chip with capillary-like flow for personalized medicine[J].Biomicrofluidics,2017,11(2):24105.
[53]Kamei K I,Kato Y,Hirai Y,et al.Integrated heart/cancer on a chip to reproduce the side effects of anti-cancer drugs in vitro[J].Rsc Advances,2017,7(58):36777-36786.
[54]Beulig RJ,Warias R,Heiland JJ,et al.A droplet-chip/mass spectrometry approach to study organic synthesis at nanoliter scale[J].Lab Chip,2017,17(11):1996-2002.
[55]Maschmeyer I,Lorenz AK,Schimek K,et al.A four-organ-chip for interconnected long-term co-culture of human intestine,liver,skin and kidney equivalents[J].Lab Chip,2015,15(12):2688-2699.
[56]Ware BR,Khetani SR.Engineered Liver Platforms for Different Phases of Drug Development[J].Trends Biotechnol,2017,35(2):172-183.
[57]Thulin P,Hornby RJ,Auli M,et al.A longitudinal assessment of miR-122 and GLDH as biomarkers of drug-induced liver injury in the rat[J].Biomarkers,2017,22(5):461-469.
[58]Huebener P,Pradere JP,Hernandez C,et al.The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosis[J].J Clin Invest,2015,125(2):539-550.
[59]Church RJ,Watkins PB.The transformation in biomarker detection and management of drug-induced liver injury[J].Liver Int,2017,37(11):1582-1590.
[60]McGill MR,Sharpe MR,Williams CD,et al.The mechanism underlying acetaminophen-induced hepatotoxicity in humans and mice involves mitochondrial damage and nuclear DNA fragmentation[J].J Clin Invest,2012,122(4):1574-1583.
[61]Church RJ,Kullak-Ublick GA,Aubrecht J,et al.Candidate biomarkers for the diagnosis and prognosis of drug-induced liver injury:An international collaborative effort[J].Hepatology,2019,69(2):760-773.
[62]Desai PK,Tseng H,Souza GR.Assembly of Hepatocyte Spheroids Using Magnetic 3D Cell Culture for CYP450 Inhibition/Induction[J].Int J Mol Sci,2017,18(5):1085.
[63]Mikus M,Drobin K,Gry M,et al.Elevated levels of circulating CDH5 and FABP1 in association with human drug-induced liver injury[J].Liver Int,2017,37(1):132-140.
[64]Swan SK.The search continues--an ideal marker of GFR[J].Clin Chem,1997,43(6):913-914.
[65]Rewa O,Bagshaw S M.Acute kidney injury-epidemiology,outcomes and economics[J].Nature Reviews Nephrology,2014,10(4):193-207.
[66]Vlasakova K,Erdos Z,Troth SP,et al.Evaluation of the relative performance of 12 urinary biomarkers for renal safety across 22 rat sensitivity and specificity studies[J].Toxicol Sci,2014,138(1):3-20.
[67]George B,Joy MS,Aleksunes LM.Urinary protein biomarkers of kidney injury in patients receiving cisplatin chemotherapy[J].Exp Biol Med(Maywood),2018,243(3):272-282.
[68]Katagiri D,Hamasaki Y,Doi K,et al.Interstitial renal fibrosis due to multiple cisplatin treatments is ameliorated by semicarbazide-sensitive amine oxidase inhibition[J].Kidney Int,2016,89(2):374-385.
[69]Liu X,Guan Y,Xu S,et al.Early Predictors of Acute Kidney Injury:A Narrative Review[J].Kidney Blood Press Res,2016,41(5):680-700.
[70]Pianta TJ,Pickering JW,Succar L,et al.Dexamethasone Modifies Cystatin C-Based Diagnosis of Acute Kidney Injury During Cisplatin-Based Chemotherapy[J].Kidney Blood Press Res,2017,42(1):62-75.
[71]Huang JX,Blaskovich MA,Cooper MA.Cell-and biomarker-based assays for predicting nephrotoxicity[J].Expert Opin Drug Metab Toxicol,2014,10(12):1621-1635.
[72]Wu CY,Yang HY,Chien HP,et al.Urinary clusterin-a novel urinary biomarker associated with pediatric lupus renal histopathologic features and renal survival[J].Pediatr Nephrol,2018,33(7):1189-1198.
[73]Saikumar J,Hoffmann D,Kim TM,et al.Expression,circulation,and excretion profile of microRNA-21,-155,and-18a following acute kidney injury[J].Toxicol Sci,2012,129(2):256-267.
[74]Ewer MS,Ali MK,Mackay B,et al.A comparison of cardiac biopsy grades and ejection fraction estimations in patients receiving Adriamycin[J].J Clin Oncol,1984,2(2):112-117.
[75]Wallace KB,Hausner E,Herman E,et al.Serum troponins as biomarkers of drug-induced cardiac toxicity[J].Toxicol Pathol,2004,32(1):106-121.
[76]Causey M W,Singh N.Clinical implications of B-type natriuretic peptide and N-terminal proB-type natriuretic peptide in the care of the vascular surgery patient[J].Seminars in Vascular Surgery,2014(27):143-147.
[77]Tan LL,Lyon AR.Role of Biomarkers in Prediction of Cardiotoxicity During Cancer Treatment[J].Curr Treat Options Cardiovasc Med,2018,20(7):55.
[78]Marta O P O,Dorota G,Agnieszka F W,et al.Circulating microRNAs in Cardiovascular Diseases[J].Acta Biochimica Polonica,2016,63(4):725.
(2020-11-19收稿 責任編輯:王明)

