EN2及β-catenin在卵巢癌組織中的表達及臨床意義
宋 晨 王春蓮 趙麗榮 王箴言 戴紅英
卵巢癌發生率較高,是全球范圍內最常見的惡性腫瘤之一,癌癥致死率位居第8位[1]。每年約有24萬女性被診斷患有卵巢癌,5年生存率約為45%,嚴重威脅女性生命健康[2,3]。Engrailed-2(EN2)基因是同源異型盒基因家族的成員之一,在胚胎和神經系統發育中起著重要的作用[4]。既往研究表明,EN2基因在多種類型的惡性腫瘤中均有高表達,包括前列腺癌、乳腺癌、膀胱癌及卵巢癌[5~8]。進一步研究發現,EN2可作為Wnt信號通路的關鍵性信號之一,參與調控細胞分化,并能通過調控Wnt信號轉導通路中β-連環蛋白(β-catenin)調控細胞增殖[9]。本研究通過免疫組化法檢測了EN2、β-catenin在卵巢癌、交界性腫瘤、良性腫瘤及正常卵巢組織中的表達,旨在探究EN2、β-catenin蛋白在卵巢癌組織中的表達水平及其與患者臨床病理學的相關性。
資料與方法
1.研究對象:收集筆者醫院2012年1月~2013年12月收治的卵巢腫瘤患者的病例資料共110例,其中卵巢癌60例,交界性腫瘤28例,良性腫瘤22例,患者年齡45~70歲,平均年齡50.5歲。所有患者均為首發病例,在術前均未接受過化療或放療,術后均經病理檢查進一步診斷確診,且所有患者病歷資料完整。此外,收集同期因子宮良性病變行卵巢切除術的20例正常卵巢組織作為對照組。臨床病理分期按照國際婦產科協會(International Federation Of Gynecology And Obstetrics, FIGO)2009年分期標準,卵巢癌臨床早期Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期40例;分化程度:高分化(G1)17例、中分化(G2)12例,低分化(G3)31例;發生淋巴結轉移17例,無淋巴結轉移者43例;漿液性腺癌43例,黏液性腺癌17例。正常對照組年齡45~68歲,平均年齡52.4歲。
2.免疫組化法檢測:對所有病理組織進行石蠟包埋,將所有石蠟包埋后的病理組織進行連續切片,切片厚度4μm,展開切片后在玻片上進行貼片,脫蠟修復后,滴加一抗后室溫孵育1~2h,洗滌后滴加二抗,室溫孵育15~20min,洗滌后DAB顯色5min,蘇木精復染細胞核30s,脫水后封片。
3.結果判定:以細胞質出現淡黃色至棕黃色或棕褐色為細胞染色陽性,綜合陽性細胞數及染色強度判斷,0~4分為EN2或β-catenin染色陰性,5~12分為EN2或β-catenin染色陽性,以陰性表達為低表達,陽性表達為高表達。低倍鏡下觀察整張切片,高倍鏡下隨機選取5個視野計數陽性細胞數。所有染色結果均由兩名經驗豐富的病理科醫生采用雙盲法在光鏡下進行觀察。

結 果
1.EN2蛋白在不同卵巢組織中的表達情況:免疫組化結果顯示,EN2表達于細胞質內且在所有的檢測樣本中均有表達(圖1),卵巢癌組織及交界性腫瘤組織EN2陽性表達率明顯高于正常組織,差異有統計學意義(P<0.05,表1)。

圖1 EN2及β-catenin蛋白在不同卵巢組織中的表達情況(免疫組化,×200)

表1 不同組織中EN2蛋白表達情況[n(%)]
與對照組比較,*P<0.05
2.β-catenin蛋白在不同卵巢組織中的表達情況:免疫組化結果顯示,β-catenin表達于細胞質內且在所有的檢測樣本中均有表達(圖1),卵巢癌組織及交界性腫瘤組織β-catenin陽性表達率明顯高于正常組織,差異有統計學意義(P<0.05,表2)。

表2 不同組織中β-catenin蛋白表達情況[n(%)]
與對照組比較,*P<0.05
3.EN2蛋白表達與卵巢癌臨床病理特征之間的關系:EN2蛋白的陽性表達與患者年齡、卵巢癌病理類型無顯著相關性(P>0.05);EN2蛋白在低分化卵巢癌組織中的陽性表達率明顯高于高分化組,差異有統計學意義(P<0.05);EN2蛋白在早期(Ⅰ~Ⅱ)卵巢癌中的陽性表達率與晚期(Ⅲ~Ⅳ)卵巢癌比較,差異無統計學意義(P>0.05);EN2蛋白淋巴結轉移卵巢癌中的陽性表達率與未轉移的卵巢癌比較,差異無統計學意義(P>0.05,表3)。
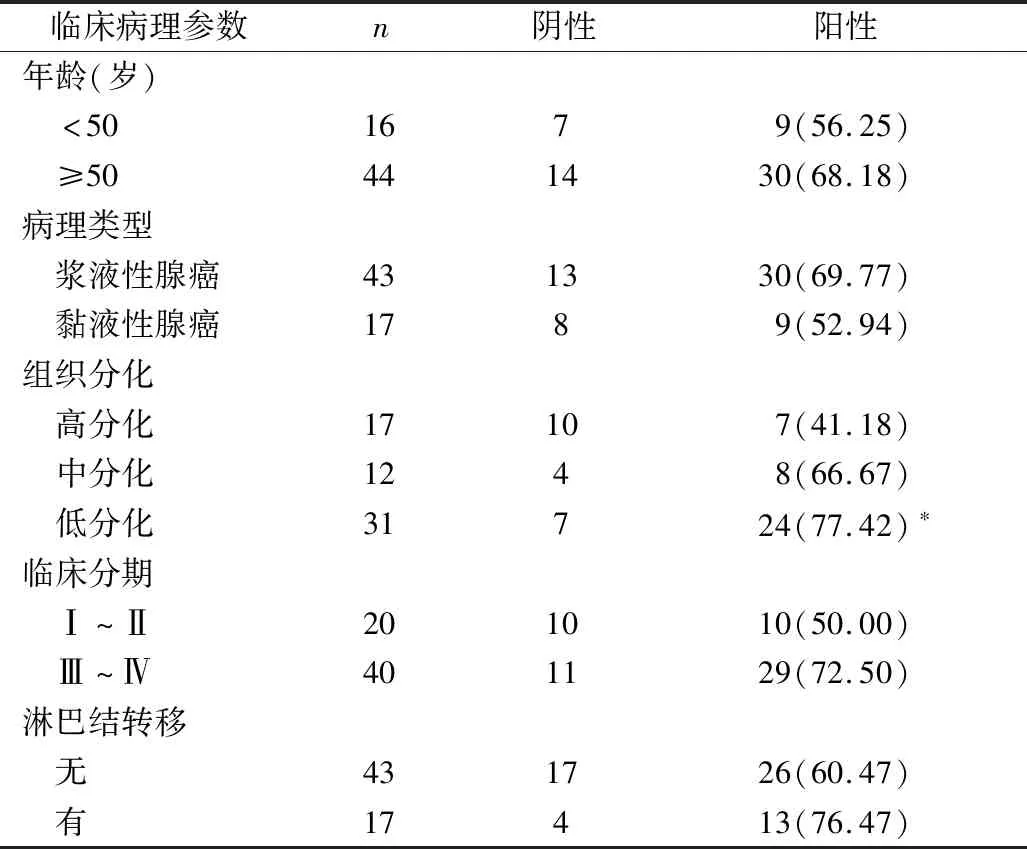
表3 EN2表達與臨床病理特征相關情況[n(%)]
與高分化比較,*P<0.05
4.β-catenin蛋白表達與卵巢癌臨床病理特征之間的關系:β-catenin的陽性表達與患者年齡、卵巢癌病理類型無顯著相關性(P>0.05);β-catenin蛋白在低分化卵巢癌中的陽性表達率明顯高于高分化組,差異有統計學意義(P<0.05);β-catenin蛋白在早期(Ⅰ~Ⅱ)卵巢癌中的陽性表達率與晚期(Ⅲ~Ⅳ)卵巢癌比較,差異無統計學意義(P>0.05);β-catenin蛋白淋巴結轉移卵巢癌中的陽性表達率與未轉移的卵巢癌比較,差異無統計學意義(P>0.05,表4)。
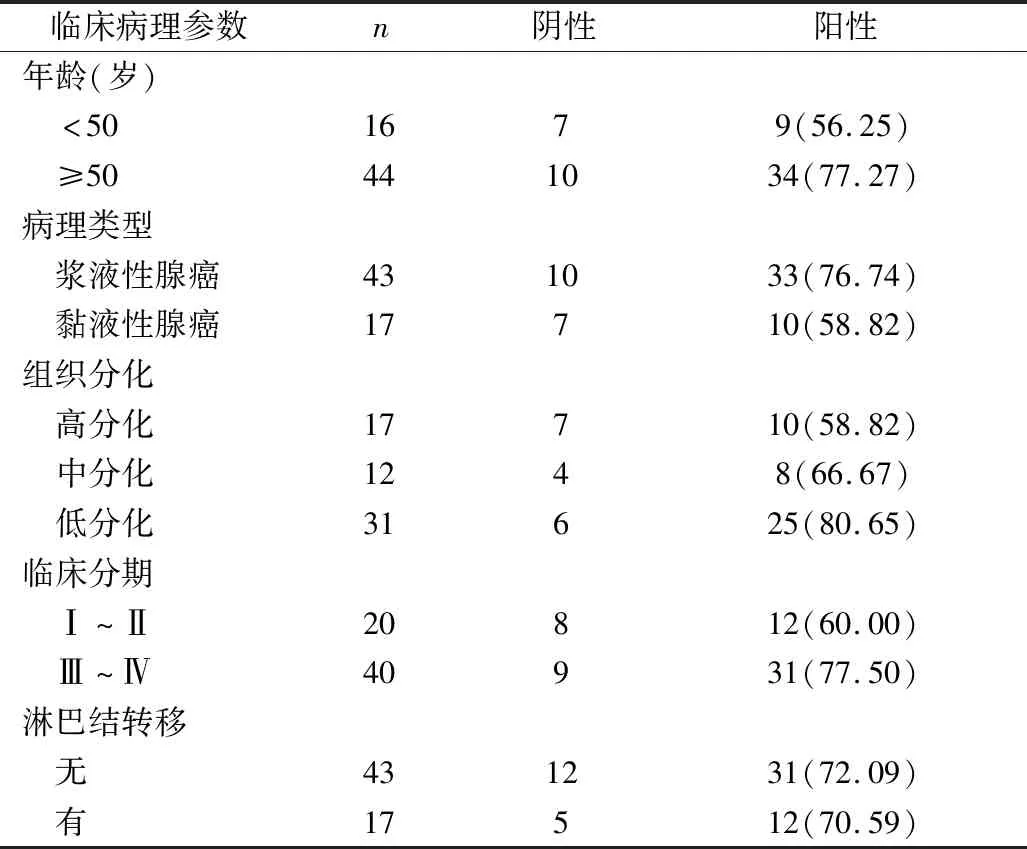
表4 β-catenin表達與臨床病理特征相關情況[n(%)]
5.EN2與β-catenin表達的相關性分析:Spearman等級相關性分析結果顯示,EN2、β-catenin在卵巢癌中的表達呈正相關(P<0.05),詳見表5。

表5 EN2與β-catenin之間的相關性[n(%)]
討 論
卵巢癌5年生存率低、預后差,因此,明確卵巢癌的發病機制、探索有效的治療手段尤為重要。同源異型盒基因(homeobox,HOX)作為轉錄因子,可與特定的DNA區域結合,激活或抑制靶基因的表達,進而參與細胞凋亡、運動與分化、血管生成和器官功能維持等多種生物學過程[10~12]。EN2基因屬于HOX家族,在人類胚胎期神經系統發育過程中起著至關重要的作用[13~15]。有報道指出,EN2可能在胚胎的早期發育和神經系統功能的維持中起著重要作用,并且與神經系統發育缺陷和自閉癥的發展密切相關[4]。
研究發現,EN2與腫瘤的發生和發展密切相關,在某些類型的癌癥中可能充當腫瘤抑制基因[16,17]。Martin等[6]報道,乳腺癌細胞中EN2的表達上調,可能促進了腫瘤細胞的增殖。Bose等[18]研究顯示,前列腺癌細胞系中的EN2表達水平上調,而EN2表達的沉默可能通過下調PAX2基因表達來抑制前列腺癌細胞的增殖。McGrath等[8]對8種上皮性卵巢癌細胞株及100例術后卵巢癌組織中EN2的表達水平進行了研究分析,結果顯示卵巢癌細胞系及漿液性卵巢癌癌癥組織中EN2 mRNA表達水平明顯高于正常對照組,提示EN2可能有一定的預測價值。Wnt/β-catenin信號是經典Wnt通路,通過激活下游靶基因的轉錄與表達,調控細胞生長。李云飛等[19]研究發現,EN2及β-catenin在同一種癌癥中的表達均明顯增高,說明EN2可能通過激活Wnt/β-catenin信號通路,參與腫瘤的發生、發展。
本研究發現,EN2及β-catenin在卵巢癌中的表達明顯增加,這與McGrath等[8]的研究結果一致,表明EN2及β-catenin的高表達可能與卵巢癌的發生、發展有關。本研究EN2及β-catenin的表達與卵巢癌的分化程度顯著相關,但與患者年齡、卵巢癌類型、臨床病理分期及有無淋巴結轉移無關,提示EN2及β-catenin蛋白可能與卵巢癌的浸潤、進展、轉移無關。本研究EN2及β-catenin的表達與卵巢癌的病理分期及淋巴結轉移無顯著相關性,但有相關性趨勢(P=0.08),其原因可能與樣本量少有關。今后的研究中需進一步收集病理數據,探究EN2及β-catenin的表達與病理分期及淋巴結轉移的關系。Spearman相關性分析結果表明,卵巢癌組織中EN2與β-catenin的蛋白表達呈正相關,二者均與組織學分級顯著相關,推測EN2與β-catenin在卵巢癌的發生、發展過程中存在協同作用。
綜上所述,卵巢癌組織中EN2及β-catenin蛋白表達明顯增高,并與病理分化程度呈正相關,提示EN2及β-catenin可能在卵巢癌的發生過程中作為腫瘤促進因子發揮生物學作用。

