丙戊酸對食管癌細胞增殖凋亡的影響及其抗腫瘤活性機制的研究
楊鯨蓉 柳亞明 張錦燦 曾志勇

[摘要]目的 探索丙戊酸(VPA)對食管癌細胞增殖凋亡的影響以及Bcl-2蛋白、Caspase蛋白表達及信號轉導通路的分子機制。方法 將食管癌ECa-109細胞株培養于PRMI1640培養液,按照溶劑對照和溶度梯度分組:空白對照及VPA 0.25 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、4.0 mmol/L。根據不同的藥物濃度處理細胞24、48、72 h后,觀察食管癌ECa-109細胞的變化,運用不同的檢測方法檢測食管癌ECa-109細胞的細胞活力、細胞凋亡及周期的變化;Western Blot檢測CyclinD1、p21、Survivin、Bcl-2和Caspase蛋白及PI3K/Akt和MAPK信號轉導通路的變化。結果 VPA可有效影響ECa-109細胞的活力、增殖和分化,能夠通過誘導細胞周期阻滯使細胞產生凋亡。Western Blot實驗結果顯示,VPA可以影響ECa-109細胞中Bcl-2、Survivin以及Caspase蛋白的表達;VPA可明顯降低ECa-109細胞中CyclinD1蛋白表達水平,同時增加p21蛋白的表達,使其能夠影響信號通路PI3K/Akt和MAPK途徑中AKT、MAPK等關鍵蛋白的磷酸化。結論 VPA能夠影響食管癌細胞的增殖凋亡,并具有濃度依賴性;能夠通過影響多種蛋白激酶途徑中的信號通路、生存蛋白的表達以及PI3K/Akt和MAPK信號通路的表達而影響食管癌細胞的生長。
[關鍵詞]組蛋白去乙酰化酶;組蛋白去乙酰化酶抑制劑;食管癌;ECa-109細胞;丙戊酸;Bcl-2;Caspase3;Akt
[中圖分類號] R966? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1674-4721(2020)5(c)-0004-06
Effect of Valproic Acid on proliferation and apoptosis of esophageal cancer cells and study on its antitumor activity mechanism
YANG Jing-rong1? ?LIU Ya-ming1? ?ZHANG Jin-can2? ?ZENG Zhi-yong1
1. Department of Cardiothoracic Surgery, the 900th Hospital of the Joint Support Force (the Former Fuzhou General Hospital of Nanjing Military Region), Fujian Province, Fuzhou? ?350025, China; 2. Fuzong Clinical College of Fujian Medical University, Fujian Province, Fuzhou? ?350025, China
[Abstract] Objective To explore the effect of Valproic Acid (VPA) on proliferation and apoptosis of esophageal cancer cells, and expression of Bcl-2, Caspase protein, as well as molecular mechanisms of signal transduction pathways. Methods ECa-109 cell line of esophageal cancer was cultured with PRMI1640 medium, and grouped according to solvent control and solubility gradient: blank control and VPA 0.25 mmol/L, 0.5 mmol/L, 1.0 mmol/L, 2.0 mmol/L, 4.0 mmol/L. After treating cells for 24, 48 and 72 hours according to different drug concentrations, the changes of esophageal cancer ECa-109 cells were observed, and different detection methods were used to detect the changes of cell viability, apoptosis and cycle of esophageal cancer ECa-109 cells. Western Blot was used to detect CyclinD1, p21, Survivin, Bcl-2, Caspase protein and PI3K/Akt and MAPK signal transduction pathway changes. Results VPA showed different extent changes on vitality, proliferation, differentiation of ECa-109 cells, could induce cell apoptosis by inducing cell cycle arrest. Western Blot experiment results showed that VPA could affect the expression of Bcl-2, Survivin and Caspase proteins in ECa-109 cells. VPA could significantly reduce the expression level of CyclinD1 protein in ECa-109 cells and increase the expression of p21 protein, which influenced the phosphorylation of key proteins such as AKT and MAPK in the signaling pathway PI3K/Akt and MAPK pathway. Conclusion VPA has an effect on the proliferation and apoptosis of esophageal cancer cells and it is concentration-dependent, which can affect the growth of esophageal cancer cells through the signaling pathways of multiple protein kinase pathways, the expression of survival proteins, the expression of PI3K/Akt and MAPK signaling pathways.
1.2.5 Western Blot檢測? VPA可促進食管癌細胞凋亡來抑制食管癌細胞的生長。為了進一步探究VPA誘導的食管癌細胞凋亡的潛在的分子機制,選用Western Blot檢測CyclinD1、p21、Survivin、Bcl-2家族和Caspase蛋白、C-PARP及PI3K/Akt和MAPK信號因子;在濃度為0.5 mmol/L VPA處理0、24、48 h后,經過RIPA裂解、蛋白的提取、蛋白溶度的測定、蛋白電泳、轉膜、封閉后進行抗體孵育及顯影。加入配置好的一抗室溫下孵育2 h,TBST洗滌干凈后,再加入辣根過氧化物酶標記的二抗,室溫下孵育1 h,然后將多余的抗體棄去,加入顯影液使其覆蓋膜表面,最后進行顯影。
1.3統計學方法
采用SPSS 15.0統計軟件進行統計學處理,實時定量RT-PCR實驗重復3次,每次做3個重復孔,計量資料用均數±標準差(x±s)表示,比較采用t檢驗,以P<0.05為差異有統計學意義。
2結果
2.1 MTT檢測不同VPA濃度處理對細胞生長的抑制作用
VPA能夠抑制ECa-109細胞活力,且抑制作用具有濃度依賴性,隨著濃度的增高,抑制效果明顯增強,而且其IC50值為0.5 mmol/L,此濃度將作為后續試驗VPA的濃度;進一步分析得出,相同時間及濃度下,藥物作用時間越長,抑制率越高,生存能力越低。不同濃度VPA兩兩比較,差異有統計學意義(P<0.05)。VPA對細胞的增殖抑制作用隨其濃度的增加而增強,用濃度為0.5 mmol/L的VPA分別作用于細胞24、48、72 h后,發現其對細胞生長均有明顯的抑制作用,抑制率分別為(31.20±0.21)、(54.30±0.23)、(57.40±0.33)%,與空白對照組比較,差異有統計學意義(P<0.05)。不同時間下VPA對細胞的抑制率有顯著影響(P<0.05)(圖1)。
2.2流式細胞檢測細胞凋亡及周期的變化
經VPA處理后的食管癌細胞,處于G2/M期的細胞隨著濃度的增加而逐漸增多;VPA對食管癌細胞誘發凋亡有作用,0.5 mmol/L VPA在0、24和48 h時,細胞凋亡比例依次為2.6%、11.9%、17.4%,食管癌凋亡細胞的數目隨著藥物作用時間的延長,細胞凋亡的數目逐漸增多(圖2)。
2.3 VPA對CyclinD1蛋白和p21調控蛋白表達的影響
經0.5 mmol/L VPA處理后的食管癌細胞,CyclinD1蛋白表達水平降低,而p21表達水平增高,而且隨著藥物作用時間的延長,具有一定的時效關系(圖3~4)。
2.4 VPA對Caspase家族蛋白表達的影響
經過0.5 mmol/L VPA處理后的食管癌細胞對Caspase家族蛋白的影響主要是通過調節相應的活化蛋白C-Caspase-3、C-Caspase-8、C-PARP的表達水平,且隨著藥物作用時間的延長,增加了相應的活化蛋白C-Caspase-3、C-Caspase-8、C-PARP的表達水平(圖5~7)。
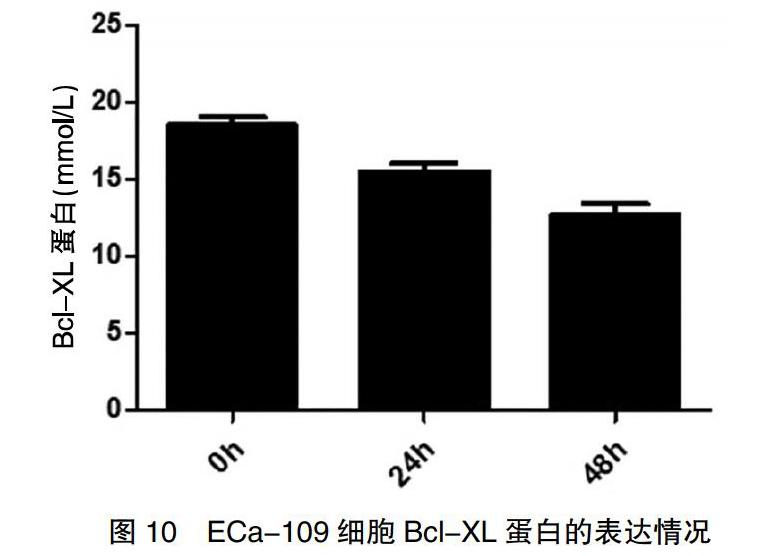
2.5 VPA對Bcl-2家族蛋白和Survivin蛋白表達的影響
經過0.5 mmol/L VPA處理后的食管癌細胞,降低了Bcl-2家族蛋白和Survivin蛋白的表達,且隨著作用時間的延長,Survivin蛋白的表達以及抗凋亡蛋白Mcl-l、Bcl-XL的表達逐漸降低(圖8~10)。
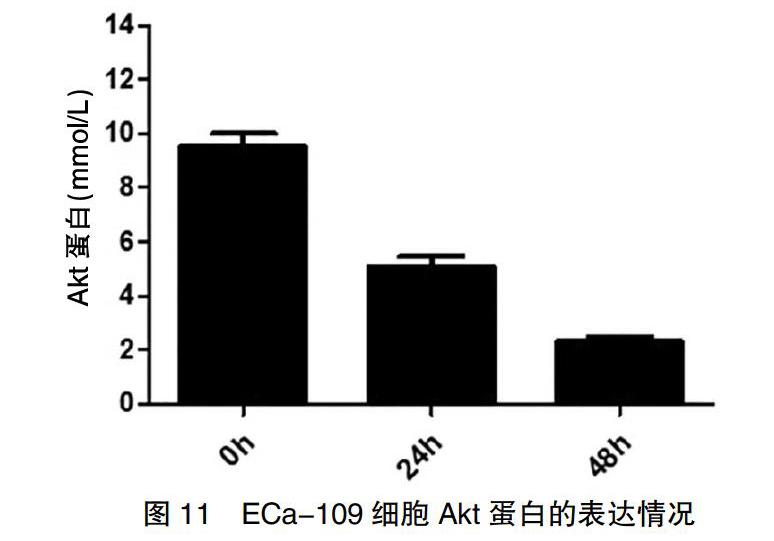
2.6 VPA對PI3K/AKT和MAPK信號通路的影響
經0.5 mmol/L VPA處理食管癌細胞后,Akt和MAPK信號因子表達水平降低,且隨著作用時間的延長,Akt、MAPK的表達逐漸下降(圖11~12)。
3討論
隨著臨床醫學研究工作的逐漸深入,越來越多的研究發現在腫瘤的發生與發展中,除了基因突變外,表觀遺傳調控也扮演者重要的角色[5-6]。在眾多的表觀遺傳調控中都存在著相對應的一系列酶對其進行修飾,而在這些表觀遺傳調控修飾酶中,HDACS作為其中的一類存在意義重大,其參與了許多生物化學信號傳導通路的去乙酰化修飾,其作用與有效干擾腫瘤發生、發展的信號傳導激活密切相關,這為在臨床展開研究工作和治療腫瘤提供了新的切入點。目前,所有HDACi按照化學結構可分為4大類:以MGCD0103、MS-275等為代表的苯酰胺類;以TSA、PXD-101、SAHA等為代表的異羥肟酸類;以丁酸鈉、丙戊酸等為代表的羧酸類;以Trapoxin、Aci- dipin、FK-228等為代表的環肽類。由于HDACi的抗腫瘤分子機制相對的復雜,再加上不同腫瘤類型中其抗腫瘤機制有著非常大的差別,對于各個HDACi在體內的抗腫瘤機制依然存在欠缺[7-10]。目前已有多種HDACi被批準上市,主要用于血液/淋巴系統的治療,包括伏立諾他、羅米地辛、貝林司他、西達本胺等[4,11]。但是,由于藥代動力學性質以及腫瘤特異性等原因,大多數HDACi在實體瘤治療中的效果并不令人滿意。
根據目前相關研究顯示,VPA具有明顯的HDACi活性,可以特異性地作用在HDACⅠ與HDACⅡ中,故具有抗腫瘤作用的效果[12]。本次研究所使用的VPA歸于短鏈脂肪酸(SCFA)的范疇內。其優勢在于患者耐受性較好且不會產生明顯的副作用。本研究結果顯示,VPA可影響ECa-109細胞的增殖凋亡以及抑制細胞的生長,而且具有濃度依賴性,尤其在濃度為0.05 mmol/L時即可明顯抑制食管癌細胞的活力和增殖。能夠通過抑制CyclinD1啟動子組蛋白H4的乙酰化水平,誘導細胞G2/M期阻滯和細胞凋亡,顯示出較強的抗食管癌活性。相關研究表明,在大多數的腫瘤模型當中,HDACi已經被證實可以通過影響細胞內、外信號轉導途徑而發揮作用[13]。死亡受體(DR)轉導通路在大多數的轉導途徑中有與其相對應的配體,當死亡受體和其相對應的配體結合后就能夠啟動凋亡途徑,誘導相對應的細胞凋亡。相關的研究已經證實,在乳腺癌中,MS275和SAHA能夠誘導TRAIL的表達而不改變DR4和DR5水平,通過募集FADD和激活Caspase8促進腫瘤細胞的調亡[14]。另有研究表明,線粒體凋亡途徑也被證實能夠通過細胞內外信號轉導途徑而發揮作用,其受到外界應激因素的干擾破壞線粒體內蛋白質的釋放,導致Caspase8、Caspase9的釋放和活化,緊接著被活化的Caspase3、Caspase6、Caspase8和已被激活的Caspase8和Caspase9共同作用誘導細胞的調亡[14]。在調節細胞凋亡的過程中,細胞內的促調亡蛋白和抗調亡蛋白也發揮著非常重要的作用[15]。本研究結果顯示,VPA能夠通過對Caspase通路的干擾及減少Survivin蛋白的表達,下調Bcl-2家族中的抗凋亡蛋白Bcl-XL、Mcl-1等機制促進細胞的凋亡來影響食管癌細胞。相關研究表明,細胞周期抑制劑p21可以被HDACi特異性地抑制[16-17];而且,抑制HDACS可以阻斷多種腫瘤生長相關信號通路,如PI3K/Akt、MAPK/Erk等[18-19]。因此,本研究通過Western Blot檢測了VPA對p21表達和PI3K/Akt、MAPK/Erk這兩條細胞生長依賴的生存信號通路的影響,結果顯示,VPA可明顯上調細胞周期抑制劑p21的表達水平以及抑制這兩條信號通路中的關鍵蛋白Akt、MAPK的磷酸化,提示VPA抗食管癌活性不僅僅涉及簡單的分子機制,還可以通過上調p21、抑制PI3K/Akt和MAPK信號通路在其中發揮重要作用。經0.5 mmol/L VPA處理食管癌細胞后,Akt和MAPK信號因子表達水平降低,且隨著作用時間的延長,Akt、MAPK的表達逐漸降低。出現這一結果的原因為VPA作用癌細胞后,抑制了AKt及MAPK的激活,使其表達降低,間接影響其下游靶基因的激活,從而調節下游凋亡相關蛋白Caspase表達。
綜上所述,本研究報道的一種高活性的HDACi——VPA的抗食管癌作用及其分子機制,VPA可以影響食管癌細胞的增殖凋亡,且具有濃度依賴性;可以通過降低CyclinD1啟動子組蛋白H4的乙酰化水平,抑制G2期CyclinD1的轉錄和表達使食管癌細胞周期停滯在G2/M期;可以通過影響蛋白酶途徑和減少Survivin蛋白的表達促進細胞凋亡,并下調Bcl-2家族中的抗凋亡蛋白Bcl-XL和Mcl-1,從而激活多重信號轉導途徑和誘導細胞凋亡;可以通過降低CyclinD1蛋白的表達和上調細胞周期抑制劑p21表達水平,并有效抑制Akt和MAPK的磷酸化,影響PI3K/Akt和MAPK信號通路的表達而影響食管癌細胞的生長,為進一步臨床用藥提供了理論依據;然而,目前有關VPA在食管癌患者體內單獨用藥效果如何以及用藥后不良反應的相關報道罕見,需要進一步的動物實驗及臨床研究,隨著該領域研究工作的不斷深入,HDACi VPA在食管癌方面的應用價值必然會不斷的增強。
[參考文獻]
[1]郭瓊.甲基化、乙酰化修飾改變對食管癌細胞生長及相關基因表達的研究[D].烏魯木齊:新疆醫科大學,2015.
[2]王小兵.MIC1在食管鱗癌診斷和抗體靶向治療中的意義及其作為腫瘤干細胞治療靶點的初步研究[D].北京:北京協和醫學院,2014.
[3]吳健,王晶晶,楊鯨蓉,等.組蛋白去乙酰化酶抑制劑對食管癌細胞抗腫瘤活性及其相關機制的研究進展[J].東南國防醫藥,2018,20(4):394-398.
[4]Wahaib K,Beggs AE,Campbell H,et al.Panobinostat:A histone deacetylase inhibitor for the treatment of relapsed or refractory multiple myeloma[J].Am J Health Syst Pharm,2016, 73(7):441-450.
[5]Conte M,Palma RD,Altucci L.HDAC inhibitors as epigenetic regulators for cancer immunotherapy[J].Int J Biochem Cell Biol,2018,98:65-74.
[6]Carolina V D A,Julia H,César C,et al.Epigenetic priming in cancer initiation[J].Trends Cancer,2018,4(6):408-417.
[7]Knipstein J,Gore L.Entinostat for treatment of solid tumors and hematologic malignancies[J].Expert Opin Investig Drugs,2011,20(10):1455-1467.
[8]Ozaki T,Wu D,Sugimoto H,D,et al.Runt-related transcription factor 2 (RUNX2) inhibits p53-dependent apoptosis through the collaboration with HDAC6 in response to DNA damage[J].Cell Death Dis,2019,4(4):e610.
[9]Lopez G,Bill KL,Bid HK,et al.HDAC8,a potential therapeutic target for the treatment of malignant peripheral nerve sheath tumors (MPNST)[J].PLoS One,2015,10(7):e133302.
[10]Saito T,Nishida K,Furumatsu T,et al.Histone deacetylase inhibitors suppress mechanical stress-induced expression of RUNX-2 and ADAMTS-5 through the inhibition of the MAPK signaling pathway in cultured human chondrocytes[J].Osteoarthritis Cartilage,2013,21(1):165-174.
[11]Yoon S,Eom GH.HDAC and HDAC inhibitor:from cancer to cardiovascular diseases[J].Chonnam Med J,2016,52(1):1-11.
[12]Yang H,Maddipoti S,Quesada A,et al.Analysis of class Ⅰ and Ⅱ histone deacetylase gene expression in human leukemia[J].Leuk Lymphoma,2015,56(12):3426-3433.
[13]Glaser KB.HDAC inhibitors:Clinical update and mechanism-based potential[J].Biochem Pharmacol,2007,74(5):659-671.
[14]Xu J,Zhou JY,Wei WZ,et al.Sp1-mediated TRAIL induction in chemosensitization[J].Cancer Res,2008,68(16):6718-6726.
[15]Fulda S.Modulation of TRAIL-induced apoptosis by HDAC inhibitors[J].Curr Cancer Drug Targets,2008,8(2):132-140.
[16]Zhou H,Cai Y,Liu D,et al.Pharmacological or transcriptional inhibition of both HDAC1 and 2 leads to cell cycle blockage and apoptosis via p21Waf1/Cip1 and p19INK4d upregulation in hepatocellular carcinoma[J].Cell Prolif,2018,51(3):e12447.
[17]Arts J,King P,Marien A,et al.JNJ-26481585,a novel "second-generation" oral histone deacetylase inhibitor,shows broad-spectrum preclinical antitumoral activity[J].Clin Cancer Res,2009,15(22):6841-6851.
[18]Witt O,Sand K,Pekrun A.Butyrate induced erythroid differentiation of human K562 cells involves inhibition of ERK and activation of p38 MAP kinase pathways[J].Blood,2000, 95(7):2391-2396.
[19]Peng Z,Guo Z,Ying W,et al.Histone deacetylase inhibitors inhibit the proliferation of gallbladder carcinoma cells by suppressing AKT/mTOR signaling[J].PLoS One,2015,10(8):e136193.
(收稿日期:2020-02-14? 本文編輯:任秀蘭)
[基金項目]福建省自然科學基金項目(2017J01223)
通訊作者

