基于延胡索投料情況研究宮炎康顆粒質量現狀
曹 歡 袁 楊 林 林 筆雪艷
(黑龍江省藥品檢驗研究中心, 黑龍江 哈爾濱150088)
延胡索又名元胡,為罌粟科植物延胡索Corydalis yanhusuoW.T.Wang 的干燥塊莖,能活血、行氣、止痛,用于胸脅、脘腹疼痛等癥。如今其市場需求量較大,逐漸出現不法商販以次充好、以假冒真、牟取暴利等現象,其常見偽品有薯蕷珠牙、天南星等,經金胺O 染色加工后使用,對成藥質量及消費者健康安全均有極大影響[1-5]。
宮炎康顆粒由當歸、醋香附、川芎、海藻、赤芍、炮姜、紅花、鹽車前子、北敗醬、澤蘭、柴胡、延胡索12 味藥材組成[6],具有活血化瘀、解毒消腫的功效,臨床上用于治療慢性盆腔炎[7-8],尚無不良反應報道。本品共2個規格,規格一每袋裝9 g(無蔗糖),規格二每袋裝9 g,對近20個生產企業的調研發現,方中延胡索均是粉碎后,原粉入藥,其他藥材則為提取后的揮發油及清膏入藥。現有標準中,宮炎康顆粒及其他系列制劑的含有量測定指標大多為芍藥苷[9-10],很少涉及阿魏酸[11-12],也尚無延胡索含有量控制的方法[13]。因此,本實驗基于延胡索現狀,以及宮炎康顆粒工藝特點、標準缺陷等因素,對方中該藥材投料情況進行全面質量研究,以期為其相關標準的完善提供依據,保障人民用藥安全。
1 材料
1.1 儀器 DM2500 Leica 熒光顯微鏡;Linomat5 半自動點樣儀;Agilent 1100 液相色譜儀;Waters e2695 液相色譜儀;TW-20 水浴鍋;SK2510LHC 超聲儀。
1.2 試劑與藥物 延胡索乙素(批號110736-201438,純度99.9%)、金胺O(批號111770-200701) 對照品均購自中國食品藥品檢定研究院;宮炎康顆粒為國家評價抽驗樣品。乙腈、甲醇為色譜純(美國霍尼韋爾公司);磷酸為色譜純(美國Sigma 公司);二氯甲烷(上海試一化學試劑有限公司);三乙胺(分析純)、醋酸銨、氨水(氫氧化銨)、乙酸乙酯、甲酸均購自國藥集團化學試劑有限公司。預制板硅膠G 板、進口MN 板。
2 方法與結果
2.1 異性有機物 取顆粒9 g,加50 mL 水超聲30 min,放冷,濾過,濾渣中加入適量水合氯醛試液,裝片,判定視野中不得檢出除延胡索以外其他藥材植物組織特征,見圖1。
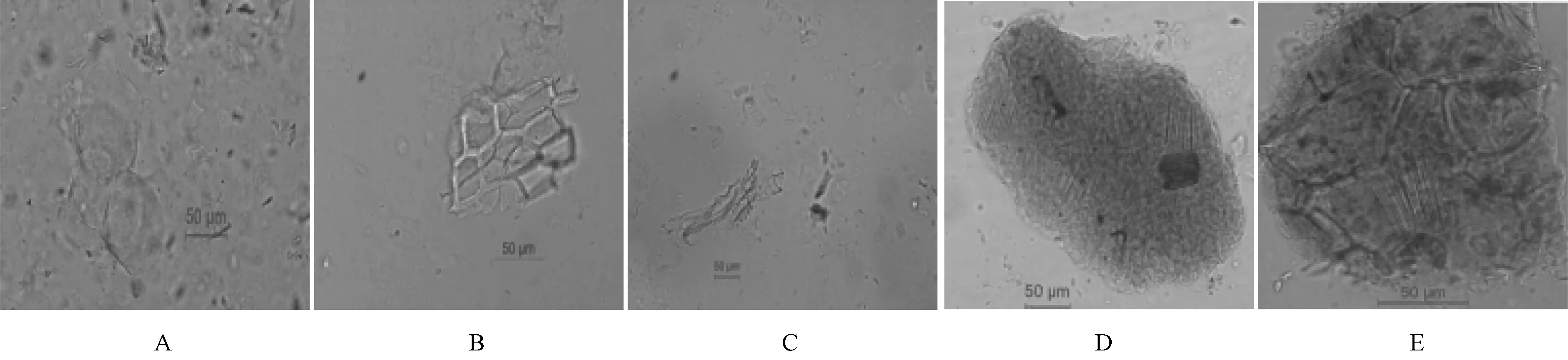
圖1 植物組織特征
2.2 TLC 鑒別及金胺O 檢查
2.2.1 TLC 鑒別(延胡索) 取顆粒(規格一) 約4.5 g或(規格二) 約9 g,研細,加5 mL 濃氨潤濕,再加30 mL三氯甲烷超聲處理40 min,濾過,濾液蒸干,殘渣加1 mL甲醇溶解,作為供試品溶液;取缺藥材陰性樣品,同法制備陰性樣品溶液;取對照藥材0.5 g,同法制備對照藥材溶液;取延胡索乙素對照品適量,加甲醇制成每1 mL 含0.5 mg該成分的對照品溶液。按照2015 年版《中國藥典》四部通則0502(薄層色譜法),吸取上述溶液各5 μL,點于同一硅膠G 薄層板上,以正己烷-氯仿-甲醇(7.5∶4∶1) 為展開劑,展開,取出,晾干,置碘蒸氣中熏至斑點清晰,紫外燈(365 nm) 下檢視,結果見圖2。由此可知,供試品色譜在與對照藥材、對照品相應位置上顯相同顏色的斑點。
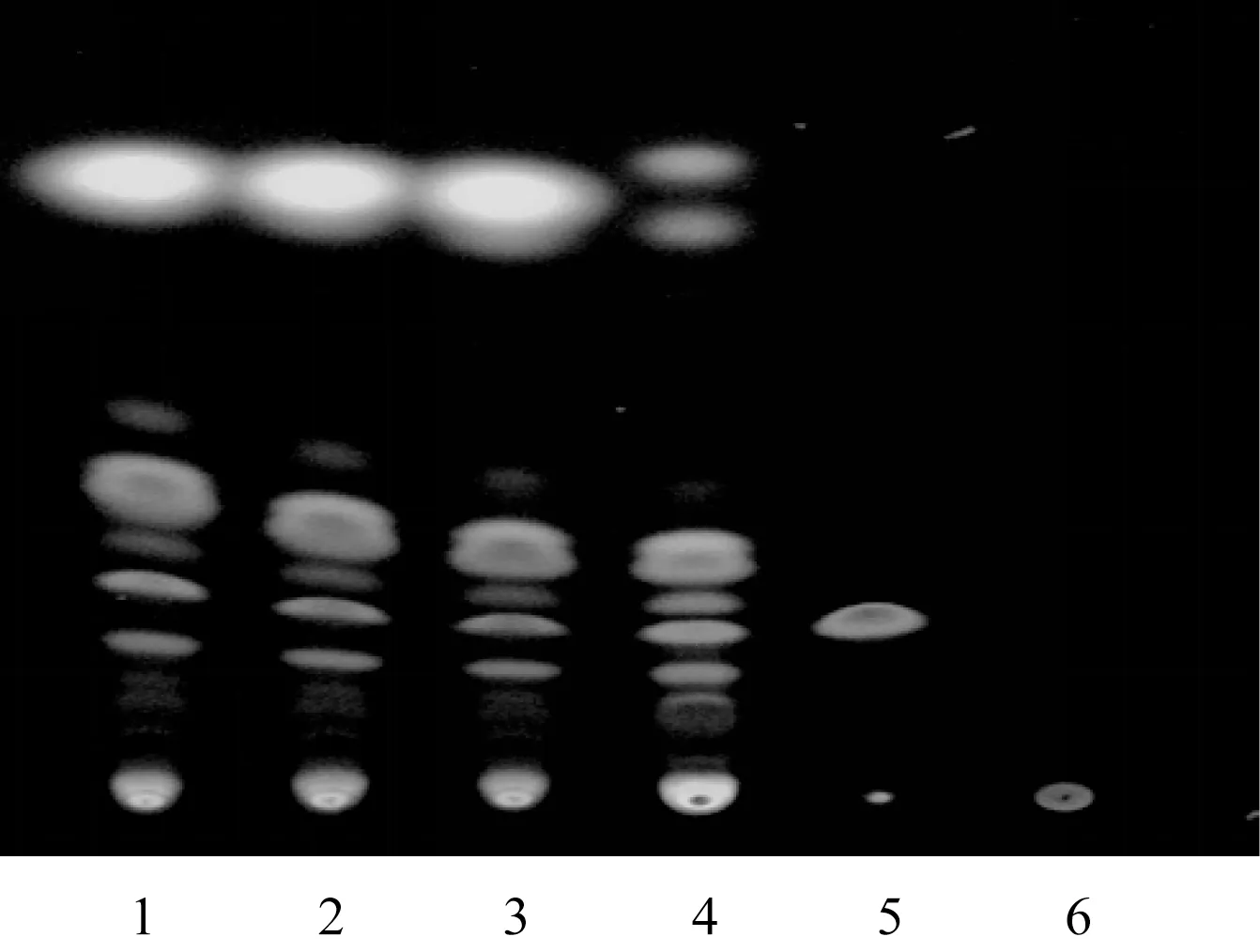
圖2 顆粒TLC 色譜圖
2.2.2 金胺O 檢查
2.2.2.1 TLC 法 取顆粒9 g,研細,加0.1%甲酸甲醇溶液50 mL,密塞,超聲處理30 min,放冷,濾過,濾液蒸干,殘渣加甲醇2 mL 溶解,作為供試品溶液;取金胺O 對照試劑適量,加甲醇制成每1 mL 含0.3 mg 該成分的溶液,作為對照試劑溶液。按照2015 年版《中國藥典》 通則0502(薄層色譜法),取供試品溶液5 μL、對照試劑溶液2 μL,點于同一硅膠G 薄層板上,以二氯甲烷-乙酸乙酯-甲醇-氨水(4∶5∶1∶1) 下層溶液為展開劑,展開,取出,晾干,日光下檢視,結果見圖3。按規定,供試品色譜在與對照試劑相應位置上不得顯示相同顏色的斑點,若出現,則采用HPLC 法驗證。

圖3 顆粒金胺O 檢查結果(預制板)
2.2.2.2 HPLC 法 按照2015 年版《中國藥典》 0512(高效液相色譜法) 測定。
色譜條件與系統適應性試驗:以十八烷基硅烷鍵合硅膠為填充劑;流動相甲醇(A) -0.05 mol/L 醋酸銨(B),梯度洗脫,程序見表1;檢測波長為432 nm。理論塔板數按金胺O 對照試劑色譜中的主峰計算,應不低于2 000。
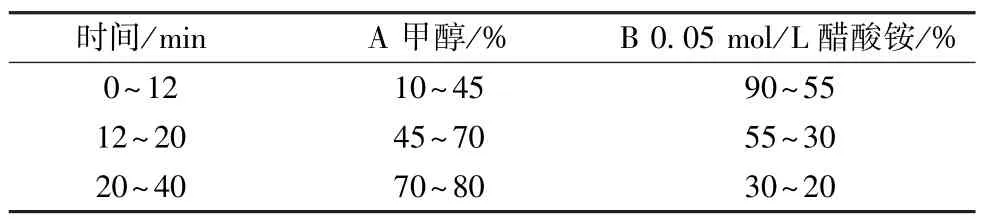
表1 梯度洗脫程序
對照試劑溶液制備:取金胺O 對照試劑適量,加甲醇制成每1 mL 含8 μg 該成分的溶液,即得。供試品溶液制備:取“2.2.2.1” 項下的供試品溶液,上清液用0.45 μm微孔濾膜過濾,取續濾液,即得。
取對照試劑、供試品溶液各10 μL,在上述色譜條件下進樣測定,結果見圖4。按規定,供試品色譜在與金胺O對照試劑保留時間相應位置不得出現相同色譜峰,若出現,則采用二極管陣列檢測器比較其在320~450 nm 波長范圍的紫外-可見吸收光譜,而且應不相同。
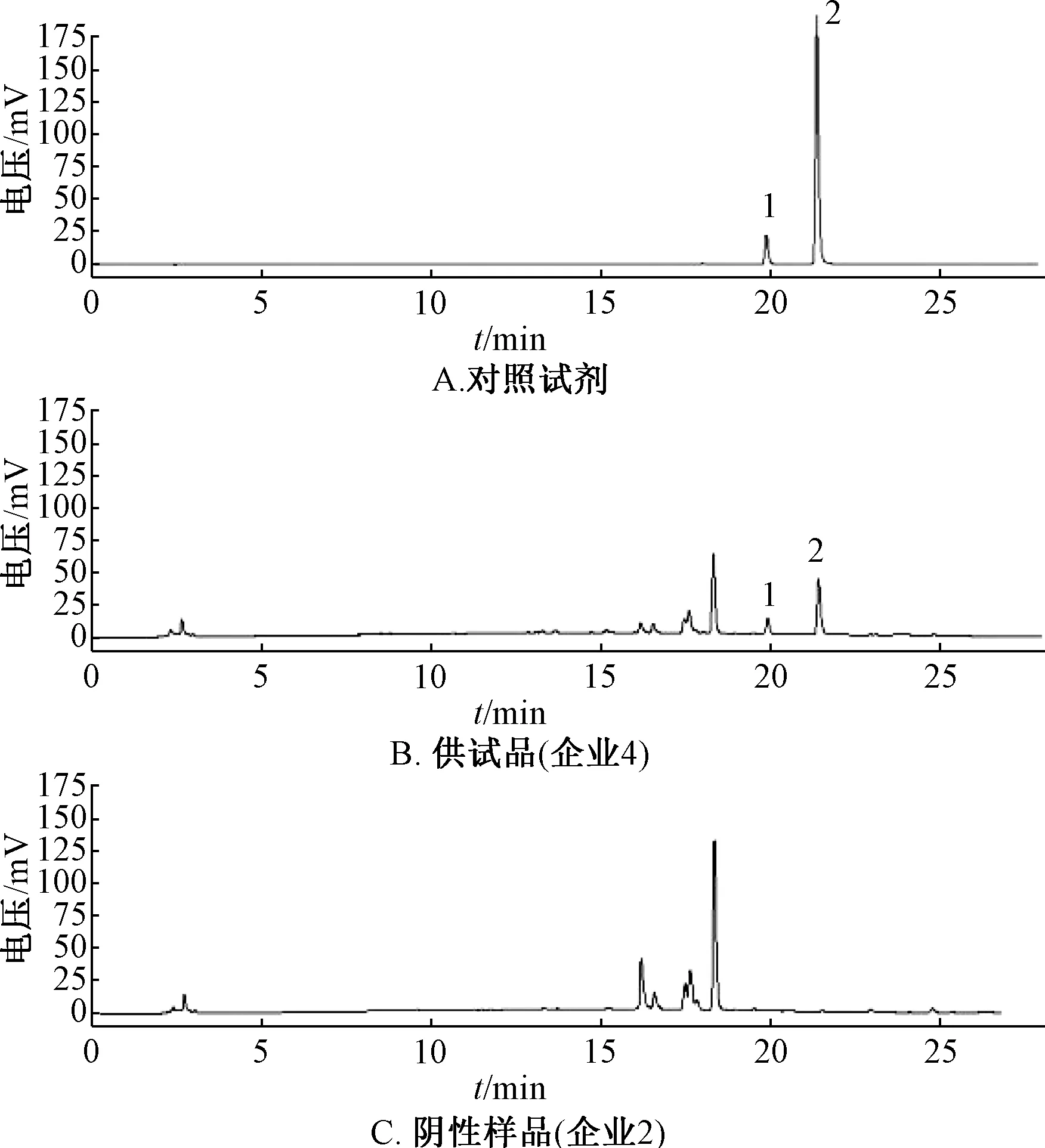
圖4 金胺O HPLC 色譜圖
檢測限:取金胺 O 對照試劑適 量,配制成1.566 μg/mL,在上述色譜條件下進樣1 μL 測定,測得信噪比為12.7(主峰),儀器檢出限(進樣量×3/信噪比) 為0.37 ng,方法檢出限[儀器檢出限×樣品稀釋倍數/(樣品取樣量×樣品進樣體積)]為8.2 mg/kg;耐用性:采用Kromasil、Thermo C18、Ultimate LP-C18十八烷基硅烷鍵合硅膠色譜柱,取供試品、對照試劑溶液,上述色譜條件下進樣測定,發現色譜峰分離度、理論塔板數均滿足要求,耐用性良好。
2.3 含有量測定
2.3.1 色譜條件及系統適應性試驗 Agilent TC-C18(2)色譜柱(4.6 mm×250 mm,5 μm);流動相乙腈-0.1%磷酸(三乙胺調pH 值至6.0)(40∶60);體積流量1.0 mL/min;柱溫30℃;檢測波長280 nm,理論塔板數按延胡索乙素峰計算應不低于3 000。精密取供試品溶液20 μL、對照試劑溶液10~20 μL,在上述色譜條件下進樣測定,結果見圖5。由此可知,供試品色譜圖在與對照品相應位置上有相同保留時間的色譜峰,陰性無干擾。
2.3.2 對照品溶液制備 精密稱取延胡索乙素對照品適量,甲醇制成每1 mL 含50 μg 該成分的溶液,即得。
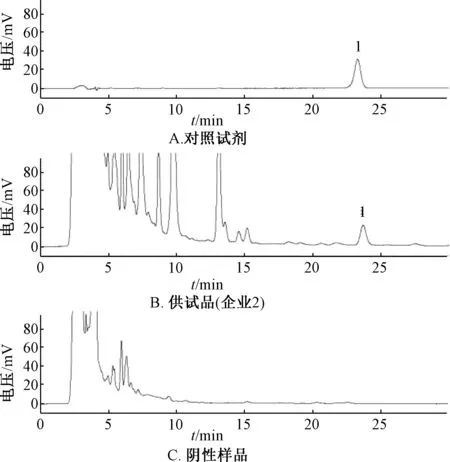
圖5 延胡索乙素HPLC 色譜圖
2.3.3 供試品溶液制備 取顆粒(規格一) 約4.5 g 或(規格二) 約9 g,精密稱定,置于錐形瓶中,精密加入濃氨試液-甲醇(1∶20) 混合溶液50 mL,稱定質量,加熱回流1 h,放冷,濃氨試液-甲醇(1∶20) 混合溶液補足減失的質量,搖勻,濾過,精密量取續濾液25 mL,蒸至近干,50%甲醇溶解,轉移至5 mL 量瓶中,并稀釋至刻度,搖勻,濾過,取續濾液,即得。
2.3.4 線性關系考察 精密稱取延胡索乙素對照品適量,加甲醇分別制成每 1 mL 含 1.163、5.814、11.628、29.071、116.284 μg 該成分的溶液,在“2.3.1” 項色譜條件下各進樣20 μL 測定。以進樣量為橫坐標(X),峰面積為縱坐標(Y) 進行回歸,得方程為Y=18.119 5X+3.561 2(r=1.000 0),在23.26~2 325.68 ng 范圍內線性關系良好。
2.3.5 精密度試驗 取對照品溶液適量,在“2.3.1” 項色譜條件下進樣測定5 次,測得延胡索乙素峰面積RSD 為0.1%,表明儀器精密度良好。
2.3.6 穩定性試驗 取同一份供試品溶液(企業2,批號150326),于0、2、6、10、16 h 在“2.3.1” 項色譜條件下進樣20 μL 測定,測得延胡索乙素含有量RSD 為1.8%,表明溶液在16 h 內穩定性良好。
2.3.7 重復性試驗 取同一批顆粒6 份,按“2.3.3” 項下方法制備供試品溶液,在“2.3.1” 項色譜條件下進樣測定,測得延胡索乙素含有量RSD 為2.9%,表明該方法重復性良好。
2.3.8 加樣回收率試驗 精密稱取延胡索乙素含有量已知(0.051 mg/g) 的顆粒(企業2,批號150326) 9 份,每份約4.5 g,精密加入已知量對照品溶液,按“2.3.3” 項下方法制備供試品溶液,在 “2.3.1” 項色譜條件下進樣20 μL測定,計算回收率,結果見表2。
2.3.9 耐用性試驗 采用不同儀器(Agilent 1100、Waters e2695)、色譜柱[Agilent TC-C18(2)、WelchUltimate LP-C18、Kromasil 100-5C18],取供試品、對照試劑溶 液,在“2.3.1” 項色譜條件下進樣測定。結果,色譜峰分離度、理論塔板數均能滿足要求,表明該方法耐用性良好。
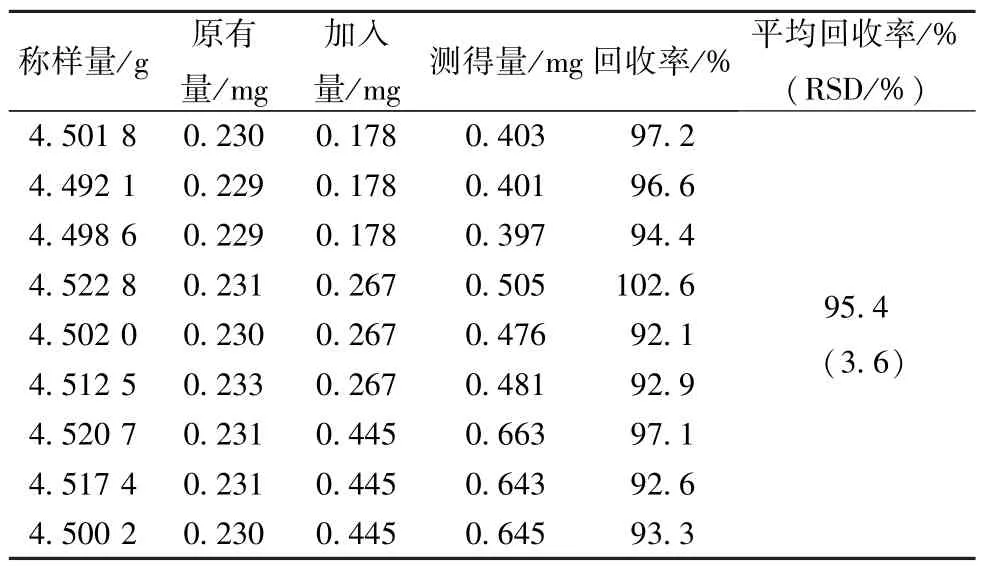
表2 延胡索乙素加樣回收率試驗結果(n=9)
2.3.10 樣品含有量測定 精密吸取供試品溶液20 μL,在“2.3.1” 項色譜條件下進樣測定,計算含有量,結果見表3。
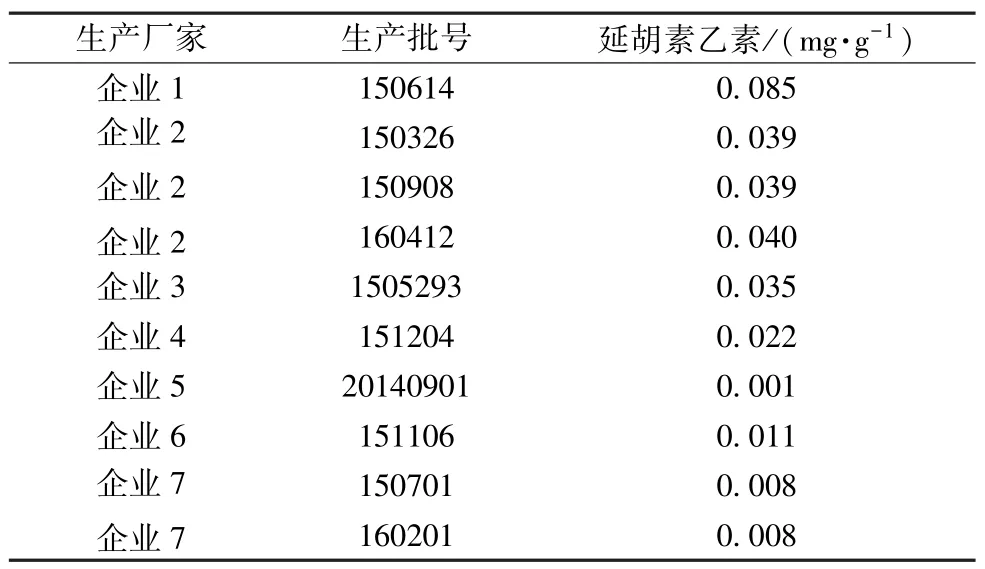
表3 延胡索乙素含有量測定結果
3 討論
本實驗采用異性有機物檢查法對7個企業宮炎康顆粒進行測定,發現企業4、6 檢出草酸鈣針晶,不屬于方中任一藥味,可能為延胡索常見偽品薯蕷珠牙,表明上述企業可能存在摻偽投料情況;采用TLC、HPLC 法,發現企業4檢出金胺O 斑點及色譜峰,進一步印證了該現象。
現行標準及文獻中有3 種延胡索鑒別方法,提取方法分別為(1) 濃氨濕潤,氯仿提取;(2) 甲醇提取后溶液蒸干,殘渣水溶調堿性后乙醚提取[14];(3) 甲醇提取后溶液蒸干,殘渣加5%醋酸溶解,調堿性后乙醚提取,發現方法(1) 操作簡便,提取充分,延胡索藥材及延胡索乙素熒光斑點較強,而展開方法分別為正己烷-氯仿-甲醇(7.5∶4∶1)、正己烷-氯仿-乙酸乙酯-丙酮(8∶1∶2∶1)、正己烷-乙酸乙酯-氨水(6∶4∶0.2),發現正己烷-氯仿-甲醇(7.5∶4∶1) 展開時,樣品與對照藥材對應熒光斑點更多,Rf值適宜,分離效果較好,陰性無干擾。
延胡索為原粉入藥,占整個處方的6.7%。2015 年版《中國藥典》 一部[15]規定,延胡索乙素含有量不低于0.050%,按該限度折算后宮炎康顆粒中其應不低于0.034 mg/g,結合實際生產可能由于粉碎、運輸、加工等造成的損失,按50%轉移率規定含有量限度為每1 g 含延胡索以延胡索乙素(C21H25NO4) 計不得少于0.017 mg,本實驗發現10 批樣品中其最低值0.001 mg/g,最高值0.085 mg/g,低于限度的共有4 批。由此可知,不同企業生產的宮炎康顆粒中延胡索質量存在較大差異,部分可能存在少投料情況。
綜上所述,本實驗檢驗結果均反映宮炎康顆粒中延胡索的質量,可全面控制其是否摻偽,定性定量控制其是否存在投料不實、藥材質量差等情況,通過綜合手段保證用藥安全,也可為后續質量標準的建立奠定基礎。

