藍斑介導右美的鎮痛鎮靜作用的神經機制研究
施 伍,賈 欣,梁 悅,胡丹丹,王烈成,張 玲
右美托咪定(dexmedetomidine, DEX)是一種高選擇性α2腎上腺素受體激動劑,廣泛應用于臨床的輔助麻醉和重癥監護[1-2]。DEX具有明顯的鎮靜和鎮痛作用[3- 4],然而其鎮靜和鎮痛的中樞機制尚未完全闡明。腦干藍斑(locus coeruleus,LC)是腦內去甲腎上腺素能神經元聚集的主要核團,由LC發出的纖維向上可以到達皮層廣泛區域參與覺醒和睡眠,由LC向下發出的纖維到達脊髓構成內源性的疼痛下行抑制調控環路[5-6]。大量的研究[7-9]表明DEX在腦內的作用的主要靶點是LC且DEX和嗎啡具有協同作用[10]。現利用在體電生理技術在自由活動的小鼠上記錄系統性給予不同劑量DEX對LC神經元放電的影響,并結合行為學和藥理學實驗,研究DEX的鎮痛和鎮靜作用的關系和中樞機制。
1 材料與方法
1.1 材料與試劑DEX購自江蘇恒瑞醫藥有限公司;納洛酮購自上海愛必信公司;育亨賓購自美國Sigma公司。c-Fos一抗購自美國abcam公司;p-ERK一抗購自美國CST公司;二抗購自美國Invitrogen公司。實驗動物選用成年健康的SPF級雄性C57BL/6小鼠,體質量20~25 g,共52只,由上海市實驗動物資源中心(西普爾-必凱公司)提供,按照實驗動物管理條例進行飼養,動物實驗方案經上海同濟大學動物倫理委員會批準。
1.2 方法
1.2.1機械縮足閾值的測定 提前將小鼠放入高架金屬網底板的鐵籠中適應30 min。測試時,用Von Frey纖維絲垂直刺小鼠后爪腳底,各纖維絲之間需間隔5 s,小鼠在受刺激時若出現快速抬足、抖足或舔足中的任意一種現象,此次刺激反應即被視為陽性反應,用up-down方法統計分析小鼠機械縮足閾值。
1.2.2熱甩尾潛伏期的測定 熱甩尾實驗中,用軟毛巾將小鼠的身體輕輕包住,只露出尾巴,注意頭部尤其眼部遮光可以使小鼠盡量安靜,將小鼠尾端3~4 cm的尾巴浸入48、50、52 ℃的水浴鍋中,為防止小鼠尾巴燙傷,每次測試間隔應大于10 s,以尾回縮出水面的潛伏期,即熱甩尾潛伏期為測定痛域的指標。
1.2.3鞘內注射 使用微量注射器在小鼠L4-5椎間隙進針,當出現輕微甩尾反射則視為成功,30 s內注射完10 μl藥物,并剔除有運動障礙的動物。
1.2.4鎮靜評定 將單個小鼠置于干凈的飼養籠中,讓其自由活動,待測小鼠經過30 min的適應后,采用Chuck的鎮靜評定量表對其行為進行評分。
1.2.5電極制作 電極由16根單獨絕緣的鎳鉻合金線(內徑35 μm,阻抗300~900 KΩ; Stablohm 675,California Fine Wire)組成。16根微線陣列以4×4×4×4圖案排列(線之間約200 μm間距)。焊接到18針連接器(Mil-Max)上,焊接處用AB膠封固,裸露的鎳鉻合金線用聚乙二醇2000保護。
1.2.6電極埋植 將用異氟烷誘導麻醉的小鼠固定于定位儀上,手術期間持續氣體麻醉(誘導3%,維持1.5%),涂抹金霉素眼膏保護小鼠眼睛,剪開頭皮暴露顱骨,將小鼠顱骨調整至符合定位標準的位置。用定位電極在顱骨標記埋植位點,用顱骨鉆在該位點開窗。將自制的微絲電極陣列從開窗部位插入LC上方(前后距:5.20 mm,旁開距:0.92 mm,深度:3.58 mm),埋植前將電極陣列頭端沾取少許Neuro-DiI染料(Biotium,美國),以便后期確定埋植位置。將參考電極纏繞到兩個顱釘上后擰緊。將3M Vetbang組織膠(美國3M公司)涂抹于顱骨和顱釘表面,之后迅速用牙科水泥將裸露的電極和顱骨封蓋。待牙科水泥堅硬后將小鼠取下,放到電熱毯上保溫以加快術后恢復。
1.2.7在體電生理記錄 神經元信號記錄應在安靜房間中的屏蔽箱中進行,并在小鼠電極埋植恢復7 d后開始,為了減少電極脫落的風險,記錄前將小鼠用異氟烷輕度麻醉后,迅速將埋植在小鼠頭上的電極與記錄系統相連接,將小鼠放在記錄箱中自由活動30 min以適應環境,使用多通道數據采集系統同步采集小鼠腹腔注射DEX之后鞘內注射納洛酮或育亨賓后的實時LC神經元電信號,采樣頻率為500 Hz,記錄40 min。
1.2.8在體電生理數據分析 為了篩選出高質量的單細胞聚集波,用Offline Sorter軟件去掉明顯的雜波,經篩選的數據用NeuroExplorer(Nex Technologies,美國)軟件分析,可得出LC神經元的放電頻率的變化圖表。
1.2.9免疫組織化學 切好的腦片漂洗2次,液室溫封閉1 h后,棄封閉液,加入一抗(1 ∶2 000)4 ℃孵育過夜,再棄一抗漂洗3次后加二抗(1 ∶1 000),室溫孵育2 h后棄二抗,漂洗3次后將腦片貼在載玻片上,封片拍攝。
2 結果
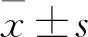
2.1 腹腔注射DEX對小鼠機械性觸誘發痛的鎮痛和鎮靜作用為了明確DEX是否影響小鼠機械痛,給予小鼠腹腔注射不同劑量的DEX (0~20 μg/kg) ,每組5只,20 min后使用Von Frey纖維絲測量小鼠機械痛。結果顯示,DEX增加小鼠的機械痛閾,并且鎮痛作用具有劑量依賴性 (圖1 A)。值得注意的是,腹腔注射DEX在10 μg/kg或以下劑量時,小鼠的痛閾值沒有明顯改變,只有當DEX濃度升高到12 μg/kg及以上,小鼠機械痛閾值明顯升高。
為了明確DEX的鎮痛作用是否由鎮靜效應引起,課題組除了測量不同劑量DEX對小鼠的痛閾值的影響以外,同時還對小鼠的鎮靜行為進行評分。根據小鼠的行為從清醒到睡眠依次以0~5分進行統計(具體評分標準見材料與方法)。結果顯示,腹腔注射DEX 10~16 μg/kg時,小鼠并沒有明顯的鎮靜作用,而腹腔注射DEX升高到18 μg/kg及以上時,出現逐漸增強的鎮靜作用 (圖1 B)。以上結果提示,DEX在小鼠表現出鎮痛和鎮靜雙重作用,低劑量時主要表現為鎮痛,高劑量時則出現鎮靜作用,并且DEX的鎮痛和鎮靜作用均具有劑量依賴性。
2.2 DEX對LC神經元放電的影響在小鼠LC埋植記錄電極(圖2G),使用多通道在體電生理技術記錄LC神經元放電(圖2E),在小鼠腹腔注射DEX 20 min后記錄DEX對LC神經元放電的影響,并與給藥前進行比較。實驗顯示低劑量的DEX(6 μg/kg)可引起45.5%(10/22)的LC神經元放電頻率增加(圖2C、D),18.2%(4/22)的神經元放電頻率降低,36.3%(8/22)放電頻率不變,記錄細胞總數22作為分母 (圖2F);而高低劑量DEX(20 μg/kg)則引起大部分(90%,34/38)LC神經元放電抑制 (圖2A、B),5%(2/38)的LC神經元放電增加,5%(2/38)不變,記錄細胞總數38作為分母(圖2 F)。該結果提示,不同劑量的DEX對LC神經元的活動產生不同的作用。
2.3 較高劑量的DEX(20 μg/kg)降低LC去甲腎上腺素能神經元活性為了確定腹腔注射DEX所致的鎮靜鎮痛作用是否有LC去甲腎上腺素能神經元的參與,給予小鼠腹腔注射6、20 μg/kg DEX,運用免疫組織化學的方法對LC神經元c-Fos和p-ERK表達做定性定量分析,并對LC去甲腎上腺素能神經元進行染色。結果顯示,腹腔注射DEX(6 μg/kg)會引起LC去甲腎上腺素能神經元活動增加(圖3 A)。腹腔注射DEX(20 μg/kg)會引起LC去甲腎上腺素能神經元活動下降(圖3 B)。統計各斷面被激活的去甲腎上腺素能神經元與所有去甲腎上腺素能神經元的比值發現,在距離Bregma點-5.34 mm和-5.40 mm 2個斷面,與腹腔注射DEX 6 μg/kg 相比,20 μg/kg LC去甲腎上腺素能神經元活性顯著下降(圖3C、D)。
2.4 DEX對小鼠的鎮痛作用由脊髓α2受體介導為了研究DEX的鎮痛機制,給予小鼠腹腔注射DEX(14 μg/kg)20 min后于鞘內注射α2受體拮抗劑育亨賓(0.03 μg溶于10 μl PBS)。熱甩尾實驗顯示,DEX(14 μg/kg)明顯增加小鼠在48、50、52 ℃熱水中的甩尾潛伏期并且DEX抑制小鼠熱痛敏的作用可被育亨賓阻斷 (圖4A)。 Von Frey實驗結果也顯示育亨賓阻斷DEX對機械痛的鎮痛作用 (圖4B)。而高劑量的DEX(20 μg/kg)的鎮痛及鎮靜作用并不受α2受體拮抗劑育亨賓(0.03 μg 溶于10 μl PBS)的影響(圖4C、D)。以上結果提示低劑量DEX抑制機械痛敏和熱痛敏的作用均由脊髓α2受體介導,而高劑量DEX的鎮靜作用不受脊髓α2受體影響。
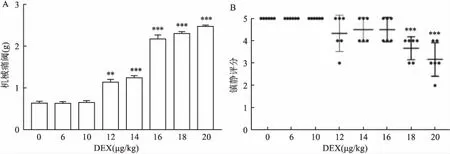
圖1 DEX對小鼠鎮痛和鎮靜作用
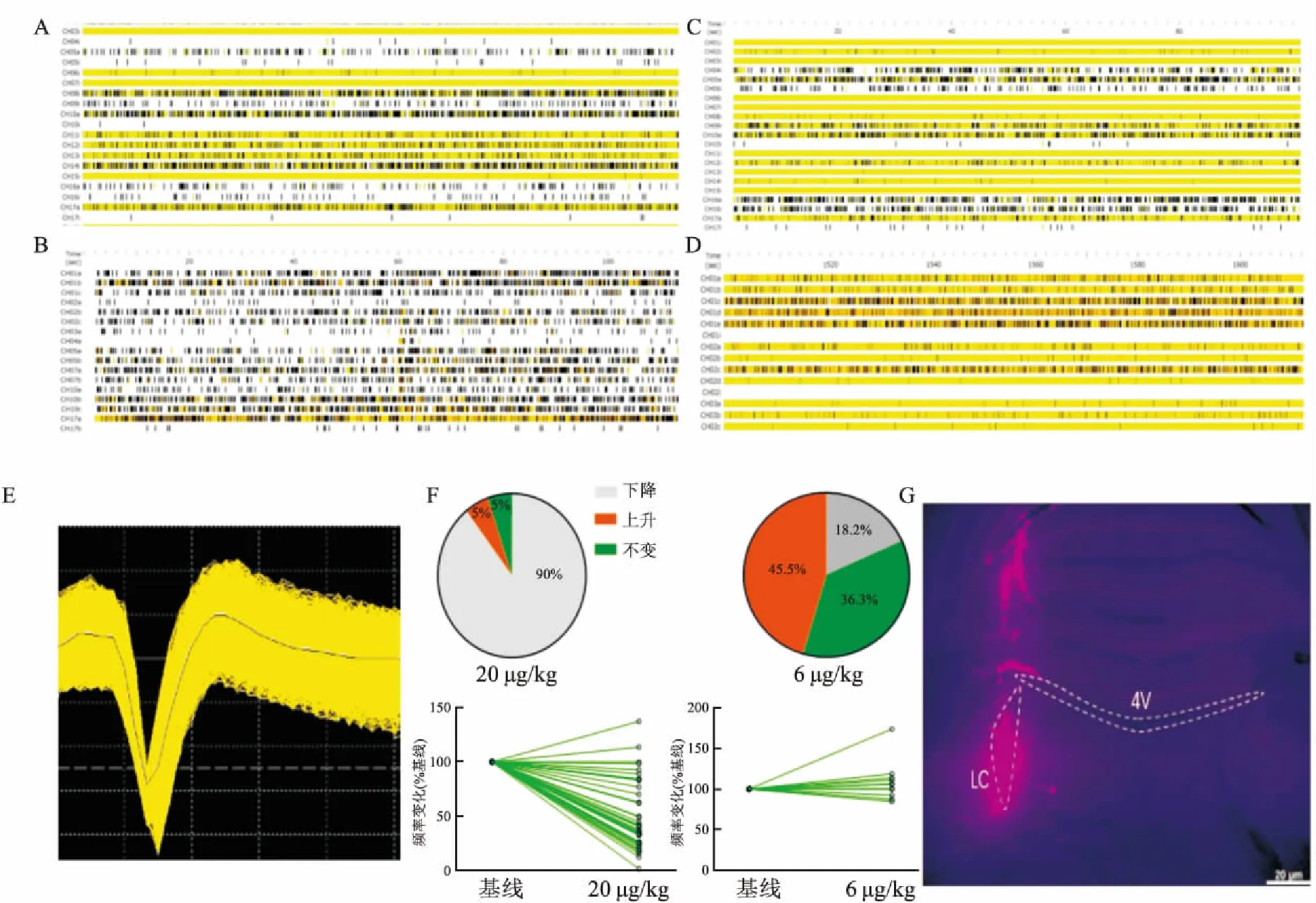
圖2 DEX對LC神經元放電頻率的影響
A、B:腹腔注射DEX(20 μg/kg)前(A)和后(B)的LC放電光柵圖;C、D:腹腔注射DEX(6 μg/kg)前(C)和后(D)的LC放電光柵圖;E:單個神經元放電模式圖;F:腹腔注射DEX 20、6 μg/kg后LC放電頻率變化的細胞數的比例和分布圖;G:電極埋植位點示意圖×5
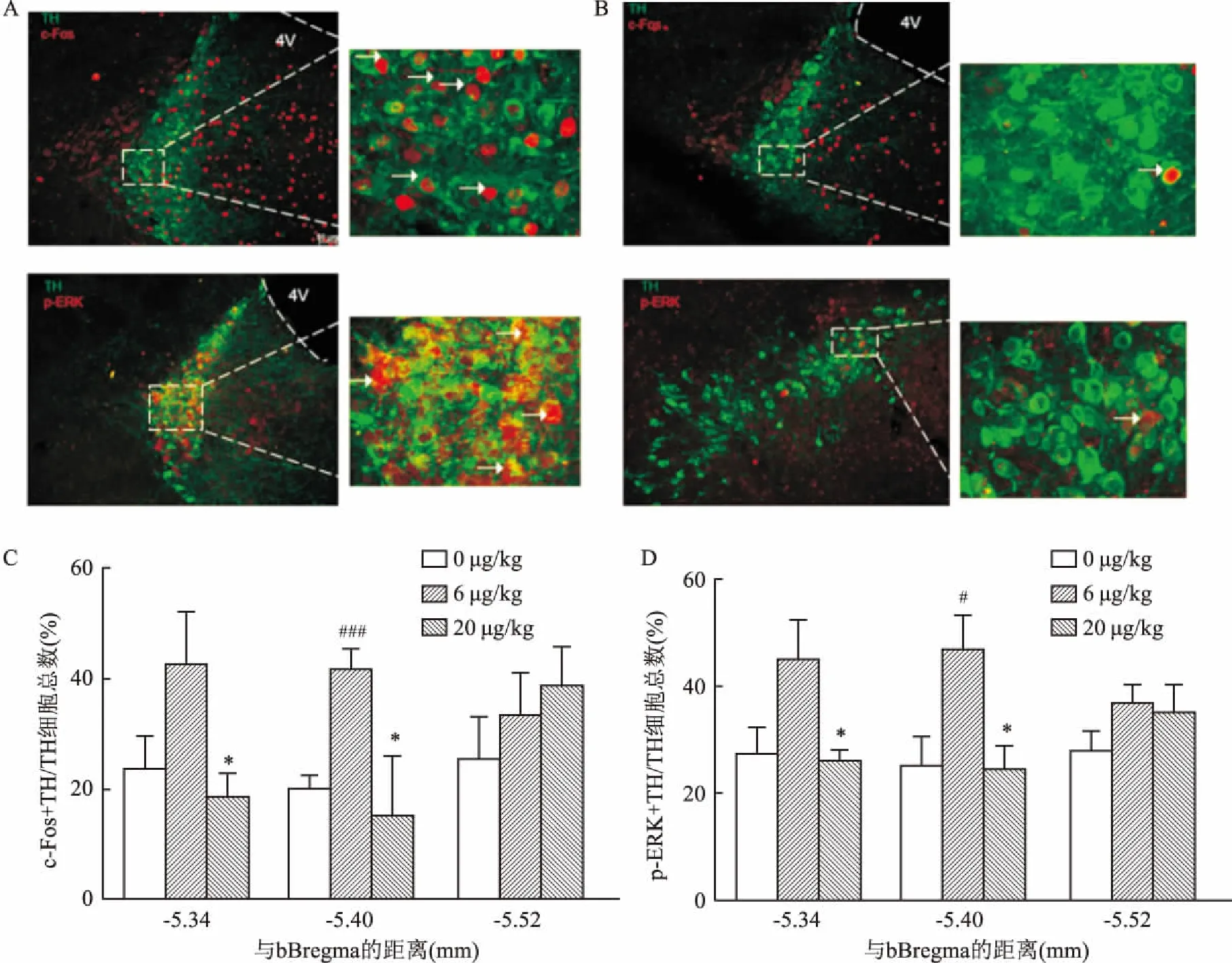
圖3 DEX對LC神經元c-Fos和p-ERK表達的影響
A:腹腔注射 DEX(6 μg/kg)對LC神經元c-Fos和p-ERK表達的情況示意圖 ×20;B:腹腔注射DEX(20 μg/kg)對LC神經元c-Fos和p-ERK表達的情況示意圖(箭頭指TH神經元和c-Fos或p-ERK共標的細胞)×20;C:腹腔注射不同濃度DEX對LC神經元c-Fos表達的情況比較;D:腹腔注射不同濃度 DEX對LC神經元p-ERK表達的情況比較;與6 μg/kg 組比較:*P<0.05;與0 μg/kg組比較:###P<0.001,#P<0.05
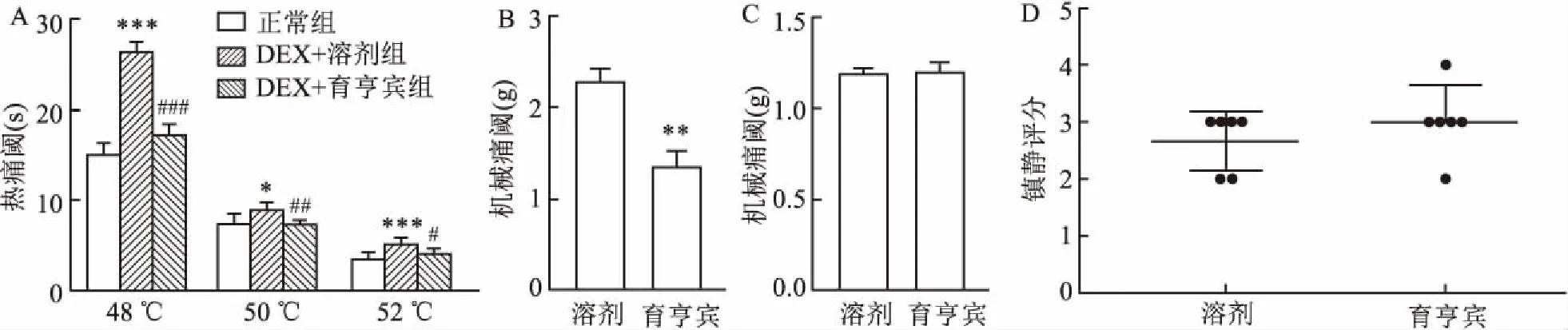
圖4 低劑量的DEX對小鼠機械痛和熱痛的鎮痛作用均由脊髓α2受體介導
A:腹腔注射DEX后鞘內注射育亨賓在不同溫度下對熱甩尾潛伏期的影響;B:腹腔注射14 μg/kg DEX后鞘內注射育亨賓對機械痛閾的影響;C:腹腔注射20 μg/kg DEX后鞘內注射育亨賓對機械痛域的影響;D:腹腔注射20 μg/kg DEX后鞘內注射育亨賓對鎮靜評分的影響;與正常組比較:***P<0.001,*P<0.05;與DEX+溶劑組比較:###P<0.001,##P<0.01,#P<0.05
2.5 納洛酮不能逆轉DEX的鎮痛作用為研究DEX鎮痛效果是否與嗎啡受體相關,小鼠腹腔注射DEX(14 μg/kg)20 min后鞘內注射納洛酮(0.03 ng 溶于10 μl PBS)并不影響小鼠的熱痛行為(圖5A);鞘內注射0.3 ng和30 ng納洛酮也不影響小鼠的機械痛行為(圖5B)。實驗結果表明DEX對熱痛和機械痛的鎮痛作用并不經脊髓的嗎啡受體介導。
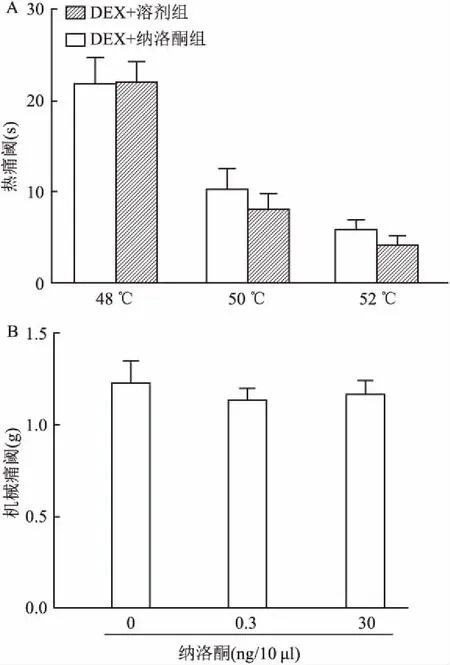
圖5 低劑量DEX的鎮痛作用不依賴嗎啡受體
A:腹腔注射DEX后鞘內注射納洛酮對熱甩尾潛伏期的影響;B:腹腔注射14 μg/kg DEX后鞘內注射納洛酮對機械痛閾的影響
3 討論
大量的研究[11]證明以不同的途徑給予DEX均可以產生鎮痛效應,但因為DEX也有明顯的鎮靜作用,因此為了研究系統給予DEX對小鼠鎮痛和鎮靜的作用及其機制,課題組首先給小鼠腹腔注射不同劑量的DEX,觀察對小鼠機械痛閾的影響并對鎮靜行為進行評分。顯示在低劑量時DEX只有鎮痛作用而不產生鎮靜作用。隨著劑量升高,DEX使小鼠出現明顯的鎮靜行為,且DEX的鎮痛和鎮靜作用均具有量效關系,這一結果提示不同劑量的DEX可能通過不同的機制產生鎮痛和鎮靜作用。
腦干的藍斑核是包括DEX在內的多種腎上腺素α2受體的激動劑主要作用的核團[12]。離體腦片膜片鉗實驗顯示30 nmol/L的DEX可以直接通過LC神經元膜上的腎上腺素α2受體使神經元產生超激化[7]。Funai et al[13]使用在體脊髓膜片鉗技術證明腹腔給予低劑量的DEX(<10 μg/kg)可以增強脊髓背角神經元的抑制性突觸后電位;而同樣劑量的DEX在LC主要產生興奮神經元的作用。因此可以確定DEX不僅對不同部位的神經元產生不同的作用,而且不同濃度的DEX對神經元的作用也有所不同。然而DEX對清醒小鼠的LC神經元活動究竟產生怎樣的作用至今卻未見報道。為了避免麻醉藥物的影響,進一步明確DEX鎮靜和鎮痛作用的神經機制,課題組采用多通道在體電生理記錄技術檢測了不同劑量DEX對自由活動小鼠藍斑神經元放電的影響。顯示低劑量的DEX主要增加LC的神經元放電頻率,而高劑量的DEX則使大部分神經元的放電產生抑制。由于LC發出下行纖維主要到達脊髓構成疼痛的下行抑制環路[12],為了確定DEX對疼痛的調控是否由LC到脊髓的下行環路介導,課題組給予脊髓鞘內注射腎上腺素α2受體阻斷劑育亨賓,結果顯示育亨賓可以阻斷DEX對熱痛和機械痛的鎮痛作用,這一研究結果表明了DEX激活了LC到脊髓的下行痛抑制環路并且脊髓α2受體介導了DEX的鎮痛作用。由于脊髓的α2受體可表達在LC到脊髓的下行纖維以及脊髓的神經元中[14],DEX的鎮痛作用主要由突觸前還是突觸后的α2受體介導仍需要進一步的研究。然而,鞘內給與α2受體拮抗劑并不影響高劑量DEX引發的鎮痛和鎮靜作用,推測高劑量DEX可能通過抑制LC神經元的活動從而抑制了LC上行的與覺醒相關的神經環路產生鎮靜作用。對于不同濃度的DEX為什么會對LC神經元興奮性和由LC構成的神經環路產生不同的作用,其機制還需要進一步地深入研究。
大量的來自臨床的研究顯示,DEX和嗎啡具有協同作用,DEX與嗎啡同時使用可以降低嗎啡使用量,具有減少嗎啡成癮的作用[10]。為了研究DEX的鎮痛作用是否為嗎啡受體依賴,課題組給予小鼠鞘內注射納洛酮,顯示DEX對熱痛和機械痛的鎮痛作用均不受納絡酮影響,提示DEX的鎮痛作用并不依賴嗎啡受體。

