白細胞介素-11對膠質瘤細胞增殖、遷移和侵襲的影響
紀興虎,卞爾保,徐雅娣,程 夢,張正偉,孫立波,陳 杰,趙 兵
膠質瘤是最常見的成人中樞神經系統惡性腫瘤,手術是最常見的治療方法,術后常輔助放療和化療[1]。但是由于腫瘤浸潤生長的特點,手術不能完全切除,因此術后復發率和死亡率高[2]。
白細胞介素11(interleukin-11,IL-11)是系統發育相關細胞因子IL-6家族的一員。與該細胞因子家族的成員一樣,IL-11可以與廣泛表達的GP130亞基形成受體復合物,從而激活JAK信號轉導子和STAT3通路[3]。IL-11是由多種細胞在炎癥刺激下而產生,并參與刺激紅細胞生成、神經發生和血小板的成熟。近年來的研究[3-5]表明IL-11在多種腫瘤的生物學進展中發揮巨大作用,其在腫瘤中的過表達促進腫瘤的增殖及遷移與侵襲能力。IL-11在腫瘤中的作用受到許多學者的關注,然而IL-11在膠質瘤中是否發揮作用仍然沒有研究報道。該研究前期實驗顯示,與正常腦組織相比,IL-11在膠質瘤組織中表達升高。為了進一步探索IL-11在膠質瘤中的作用機制,該實驗以SF126細胞作為實驗對象,探究了IL-11對膠質瘤細胞的增殖、遷移和侵襲能力的影響。
1 材料與方法
1.1 試劑IL-11敲減質粒(shIL-11)由上海吉凱基因合成;IL-11引物由上海生工生物工程股份有限公司合成,重組人IL-11(rhIL-11)(美國Proteintech公司),LipofectamineTM2000及TRIzol(美國Invitrogen公司),PrimeScriptTMRT Master Mix 逆轉錄試劑盒及 SYBR Green PCR試劑盒(日本TaKaRa公司),胎牛血清FBS(美國Gbico公司),高糖培養基DMEM(美國Hyclone公司),胰蛋白酶(上海碧云天科技公司),基質膠(美國BD公司),Transwell小室(美國Corning公司)。
1.2 儀器恒溫培養箱(NAPCO-8800,美國SHELLAB公司),倒置顯微鏡(TS100,日本Nikon公司),超凈工作臺(SW-9800,蘇州凈化設備公司),逆轉錄儀(FlexCycler,德國ANALYTIKJENA公司),實時定量PCR儀(CFX ConnectTM,美國Bio-rad公司)。
1.3 細胞系及培養方法人膠質瘤細胞SF126和正常人腦星形膠質細胞HEB購自上海中國科學院。細胞培養于含10%胎牛血清的DMEM中(培養條件:37 ℃、5%CO2恒溫培養箱)。在倒置顯微鏡下觀察,當細胞匯合率達到80%以上時進行細胞傳代。
1.4 方法
1.4.1qRT-PCR實驗檢測細胞mRNA表達 用TRIzol法提取細胞總RNA,并按10 μl反應體系進行逆轉錄:PrimeScriptTMRT Master Mix 2 μl,總RNA量600 ng,加無酶水至10 μl,根據逆轉錄試劑盒說明書將RNA逆轉錄成cDNA。最后以cDNA為模板使用對應引物進行目的基因的擴增,反應體系為10 μl: cDNA 1.6 μl,特異性引物3.2 μl,SYBR 5.2 μl。以GAPDH作為內參。引物序列如下:IL-11,5′-GCTGCAAGGTCAAGATGGTT-3'(正向引物) 和5′-GCTGGGTGGCGTTCTATC-3'(反向引物);GAPDH, 5′-AGCAAGAGCACAAGAGGAAG-3′(正向引物) 和5′-GGTTGAGCACAGGGTACTTT -3′(反向引物)。qRT-PCR反應條件為:預變性95 ℃、10 min,變性95 ℃、15 s,退火60 ℃、60 s,循環40次。使用2-ΔΔCt法計算對應mRNA的表達。
1.4.2shIL-11質粒轉染SF126細胞 將處于對數期生長的細胞接種于6孔板中(1×106個/ml),于第2天細胞貼壁后按 Lip2000試劑說明書轉染shIL-11,于4 h后換液,PBS清洗6孔板2次,用含10%FBA的DMEM的培養基繼續培養48 h后收集細胞進行后續實驗。將shIL-11質粒轉染后的SF126細胞設為shIL-11組,并將轉染空載質粒的細胞作為對照組即NC組。
1.4.3克隆形成實驗檢測細胞增殖能力 取預處理的細胞胰酶消化,按1×103個/孔接種于6孔板中,37 ℃、5%CO2恒溫培養箱中繼續培養7 d(培養期間需更換培養基)。結束培養后,倒掉培養基用PBS清洗3次,4%多聚甲醛固定細胞20 min,再次用PBS清洗,之后用0.1%結晶紫染色30 min,計算克隆細胞數。使用ImageJ軟件計算克隆形成細胞數目,每組設置3個重復孔。
1.4.4Transwell實驗檢測細胞遷移及侵襲能力 將預處理的細胞用胰酶消化,并用無血清培養基制備成細胞懸液。將100 μl含5×104個細胞的懸液加到小室上層,在小室下層加入含30% FBS的培養基600 μl。于37℃、5%CO2恒溫培養箱中繼續培養24 h后,將小室取出,用棉簽擦去小室上層細胞,PBS清洗3次,加入4%多聚甲醛固定細胞30 min,再次用PBS清洗小室,用0.1%結晶紫染色15 min,清洗并晾干后于顯微鏡下觀察,統計穿膜細胞數目。細胞侵襲能力的檢測需要預先在小室上層加入1 ∶5稀釋后的基質膠(預先4 ℃過夜融化),并置于37 ℃培養箱干燥30 min,待膠凝固后加入1×105個細胞于小室內,培養48 h,之后的步驟與遷移實驗相同。使用ImageJ軟件計算穿膜細胞數目,每組設置3個重復小室。
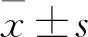
2 結果
2.1 IL-11在膠質瘤中的表達收集臨床膠質瘤樣本與正常腦組織樣本,通過qRT-PCR分析IL-11的表達。結果顯示IL-11在膠質瘤樣本中的表達高于正常腦組織,差異有統計學意義(t=4.77,P<0.01),見圖1A。在本研究中選取正常人腦星形膠質細胞HEB與人膠質瘤細胞SF126,并檢測了兩種細胞系中IL-11的mRNA表達水平,結果顯示SF126細胞的IL-11 mRNA相對表達水平高于HEB細胞,差異有統計學意義(t=13.43,P<0.001),見圖1B。
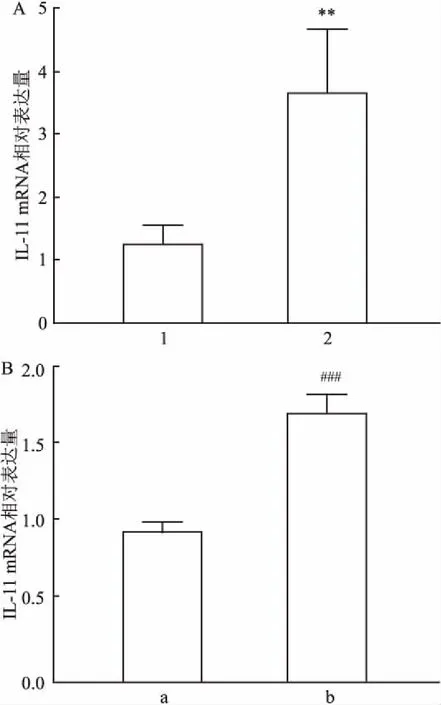
圖1 IL-11在膠質瘤中的表達
A:膠質瘤組織與正常腦組織中IL-11的相對表達量;B:IL-11在HEB與SF126 2種細胞系中mRNA的表達量;1:正常腦組織;2:膠質瘤組織;a:HEB細胞;b:SF126細胞;與正常腦組織比較:**P<0.01;與HEB細胞比較:###P<0.001
2.2 qRT-PCR法檢測shIL-11轉染膠質瘤細胞SF126后IL-11的表達qRT-PCR技術檢測細胞IL-11的mRNA表達情況。如圖2所示,與NC組相比,shIL-11組中IL-11的表達下調,差異有統計學意義(t=6.46,P<0.05)。表明shIL-11轉染SF126細胞可成功下調細胞中IL-11 表達水平。
2.3 IL-11促進SF126細胞的增殖克隆形成實驗檢測細胞的增殖能力。shIL-11轉染SF126細胞后將細胞培養于6孔板內,于第7天進行檢測。結果顯示:shIL-11組的克隆細胞數少于NC組,差異有統計學意義(t=4.40,P<0.05),見圖3A、C。此外,用rhIL-11(60 ng/ml)處理SF126細胞并于6孔板內培養7 d。克隆形成實驗結果表明:IL-11組克隆細胞數相對空白對照組增多,差異有統計學意義(t=8.38,P<0.01),見圖3B、D。上述結果提示,IL-11促進膠質瘤細胞的增殖能力。
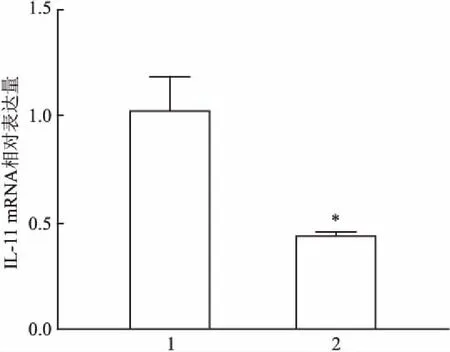
圖2 shIL-11轉染SF126細胞后IL-11的相對表達量
2.4 IL-11促進SF126細胞的遷移和侵襲能力Transwell實驗檢測細胞的遷移和侵襲能力。結果顯示,與NC組相比,shIL-11組細胞遷移能力受到抑制,差異有統計學意義(t=5.96,P<0.01),見圖4A、C。與此相似,敲減處理后的SF126細胞侵襲能力同樣被抑制,差異有統計學意義(t=10.51,P<0.001),見圖4B、C。之后的研究中用濃度為60 ng/ml 的IL-11處理SF126細胞。Transwell結果顯示,與空白對照組相比較,IL-11組細胞的遷移數增加,差異有統計學意義(t=8.38,P<0.01),見圖5A、C。相似的,與空白對照組比,IL-11處理后的細胞侵襲細胞數增加,差異有統計學意義(t=7.83,P<0.01),見圖5B、C。
3 討論
膠質瘤是成人最常見且具高度侵襲性的原發腫瘤[6]。盡管近些年膠質瘤在治療方面取得了不錯的進展,但是由于腫瘤本身生長迅速且呈浸潤性生長的特點,患者預后不理想且常規治療的中位生存期不足15個月[7]。腫瘤的高度浸潤性是惡性膠質瘤最突出的生物學特征,也是引起腫瘤頻繁復發和預后不佳的主要原因[8]。因此,探討膠質瘤增殖和侵襲的分子機制已成為膠質瘤診斷和治療的熱點。
IL-11是IL-6細胞因子家族的一員,與該家族細胞成員共享受體亞基gp130[9]。IL-11是在骨髓基質細胞培養基中首次發現,之后的研究[4]表明在成骨細胞、滑膜細胞、成纖維細胞、軟骨細胞、滋養細胞、肝細胞、胃腸道上皮細胞等細胞中也有表達,但IL-11分泌的主要來源仍不清楚。IL-11是一種多效性細胞因子,傳統上認為IL-11可以起到抗感染、抗凋亡的作用,也有促炎細胞因子的作用,提示其在免疫應答中的復雜功能[4,10]。但是在近幾年的研究[4]中發現,IL-11參與多種腫瘤的惡性進展,包括胃癌、肺癌、胰腺癌、前列腺癌、乳腺癌和子宮內膜癌等。IL-11在胃癌患者腫瘤組織中的表達水平升高是一種常見的現象,并與腫瘤的進展相關[11]。Yang et al[12]研究發現,IL-11在食管鱗癌中高表達且促進腫瘤的增殖和侵襲,而敲減IL-11可以抑制腫瘤的進展。在乳腺癌中IL-11的高表達將會促進乳腺癌的增殖與侵襲[13]。此外,Liang et al[14]研究證明抑制IL-11-STAT3信號軸將會減少乳腺癌的生長和轉移。然而IL-11是否參與膠質瘤增殖與侵襲過程仍未有研究報道。
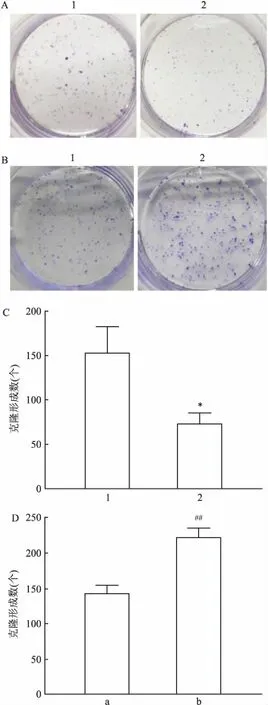
圖3 IL-11對SF126細胞增殖的影響
A、C:克隆形成實驗檢測shIL-11轉染SF126細胞對增殖的影響;B、D:克隆形成實驗檢測60 ng/ml IL-11處理SF126細胞后對增殖的影響;1:NC組;2:shIL-11組;a:空白對照組;b:IL-11組;與NC組比較:*P<0.05;與空白對照組比較:##P<0.01

圖4 shIL-11轉染SF126細胞對遷移和侵襲的影響 結晶紫染色×100
A:shIL-11轉染SF126細胞對遷移的影響;B:shIL-11轉染SF126細胞對侵襲的影響;C:遷移與侵襲實驗數據統計圖;1:NC組;2:shIL-11組;與NC組比較:**P<0.01,***P<0.001
在本研究中,qRT-PCR檢測膠質瘤樣本與正常腦組織樣本中IL-11的表達,結果顯示膠質瘤中IL-11的表達高于正常腦組織。同樣在膠質瘤細胞系中IL-11也呈現出高表達。為了探究IL-11在膠質瘤增殖、遷移與侵襲過程中所發揮的作用,本實驗構建了shIL-11質粒用于敲低膠質瘤細胞中IL-11的表達。qRT-PCR結果顯示,與NC組比,shIL-11組中mRNA表達下調。 后續研究證明敲低IL-11可抑制SF126細胞的增殖、遷移與侵襲能力。此外,用rhIL-11處理SF126細胞,實驗結果表明IL-11處理細胞后促進了膠質瘤細胞的增殖與侵襲性。
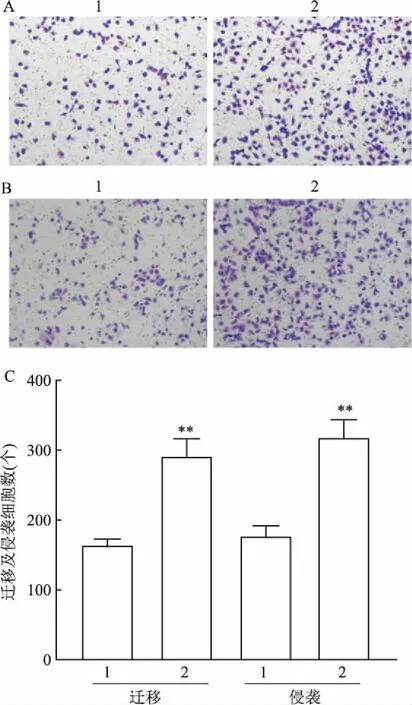
圖5 IL-11對SF126細胞遷移和侵襲的影響 結晶紫染色×100
A:60 ng/ml IL-11處理SF126細胞對遷移的影響;B:60 ng/ml IL-11處理SF126細胞后對侵襲的影響;C:遷移與侵襲實驗數據統計圖;1:空白對照組;2:IL-11組;與空白對照組比較:**P<0.01
綜上,本研究初步證明在膠質瘤中IL-11表達水平升高,而高表達的IL-11促進膠質瘤細胞的增殖、遷移和侵襲。但是IL-11是通過什么分子機制來促進膠質瘤的惡性進展仍沒有研究。在之前的研究中,Liang et al[14]證明IL-11通過調節STAT3的表達來改變乳腺癌的遷移侵襲能力。因此在之后的研究中,課題組將深入探討IL-11促進膠質瘤增殖和侵襲能力的具體分子機制,為探索以IL-11為靶點的分子免疫治療提供新的思路和方法。

