益生菌對蘇尼特羊胃腸道菌群、代謝物及肉品質(zhì)的影響
杜 瑞,靳 燁,王柏輝,羅玉龍,寶勒格,趙麗華,蘇 琳,*
(1.內(nèi)蒙古農(nóng)業(yè)大學(xué)食品科學(xué)與工程學(xué)院,內(nèi)蒙古 呼和浩特 010018;2.內(nèi)蒙古巴彥淖爾市烏拉特中旗農(nóng)牧和科技局,內(nèi)蒙古 巴彥淖爾 015300)
蘇尼特羊是內(nèi)蒙古獨(dú)特的優(yōu)良羊種,具有育肥能力強(qiáng)、脂肪率低、抗病性強(qiáng)、遺傳性能穩(wěn)定等優(yōu)點(diǎn),在我國得到了廣泛的推廣[1]。蘇尼特羊的優(yōu)良特性不僅與遺傳基因有關(guān),還與腸道中的微生物有關(guān)。目前,羊肉生產(chǎn)中存在抗生素濫用的現(xiàn)象,因此尋找安全、高效的綠色添加劑替代抗生素是畜牧業(yè)的研究熱點(diǎn)之一,而益生菌有著安全、高效、低成本的特點(diǎn),可作為抗生素潛在的替代品,其中嗜酸乳桿菌、鏈球菌、干酪乳桿菌和植物乳桿菌,能在宿主的消化系統(tǒng)中定植,改善菌群結(jié)構(gòu),抑制病原微生物,提高畜禽的產(chǎn)肉性能,因此添加益生菌可有效調(diào)節(jié)畜禽的胃腸道菌群,并在改善肉用品質(zhì)方面有巨大的潛力[2-3]。國內(nèi)外的一些學(xué)者已經(jīng)報道了益生菌改善畜禽肉品質(zhì)的研究,Wang Hesong等[4]將乳桿菌加入到肉雞的飼料中,發(fā)現(xiàn)雞腸道中的菌群多樣性增加,肉中的脂肪沉積降低,雞的生長性能得到改善。張?zhí)礻朳5]和趙秀英[6]等給豬飼喂乳酸菌發(fā)現(xiàn),乳酸菌能改善豬的腸道菌群結(jié)構(gòu),改變厚壁菌門與擬桿菌門的比例,改善肉的風(fēng)味及嫩度。Herdian等[7]在綿羊飼料中添加益生菌,發(fā)現(xiàn)羊肉品質(zhì)得到明顯的改善,肉的保水性提高,且膽固醇含量降低。Li Xiuliang等[8]將復(fù)合植物乳桿菌(Lactobacillus plantarum)和發(fā)酵乳桿菌(Lactobacillus fermentum)加入高脂小鼠的飼糧中,發(fā)現(xiàn)小鼠的腸道菌群發(fā)生改變,其中雙歧桿菌(Bifidobacterium)的數(shù)量增加,大腸桿菌(Enterobacterium)的數(shù)量降低。
胃腸道微生物群是一個信號樞紐,它能將飲食等環(huán)境輸入與影響宿主新陳代謝、免疫和感染反應(yīng)的遺傳和免疫信號結(jié)合起來,在飼糧中加入益生菌有助于在胃腸道中建立和維持合適的微生物區(qū)系[9-10]。因此,本實(shí)驗(yàn)通過飼糧中添加復(fù)合益生菌(植物乳桿菌和干酪乳桿菌)研究其對肉羊胃腸道菌群、代謝物及肉品質(zhì)的影響,以期改善舍飼羊的肉品質(zhì),并為益生菌在肉羊產(chǎn)業(yè)中的應(yīng)用提供理論依據(jù)。
1 材料與方法
1.1 動物、材料與試劑
3 月齡的蘇尼特羊12 只((16.72±1.32)kg)選自內(nèi)蒙古巴彥淖爾市烏拉特中旗川井蘇木哈拉圖嘎查順?biāo)燹r(nóng)牧專業(yè)合作社,分為對照組和益生菌組(每組6 只),經(jīng)過7 d的預(yù)飼期后,進(jìn)行90 d的飼喂實(shí)驗(yàn)。對照組飼喂基礎(chǔ)飼糧,飼糧成分為青貯飼料8 kg、葵花餅5 kg和育肥飼料10 kg,并且每月依次增加青貯飼料8 kg、葵花餅5 kg和育肥飼料1 kg;益生菌組則在基礎(chǔ)飼糧中加入60 g復(fù)合乳酸菌(1.50×109CFU/g復(fù)合益生菌);該動物程序由內(nèi)蒙古農(nóng)業(yè)大學(xué)動物保護(hù)和使用委員會批準(zhǔn),并按照科技部《實(shí)驗(yàn)動物指南》執(zhí)行,該研究不涉及任何瀕危或受保護(hù)物種。
肉羊屠宰放血后采集背最長肌,取500 g用于羊肉品質(zhì)分析;從直腸中收集糞便樣品置于50 mL無菌離心管中用于腸道微生物分析。取4 層紗布過濾瘤胃內(nèi)容物,收集瘤胃液于2 mL無菌無酶凍存管中,糞便和瘤胃液樣品均液氮運(yùn)輸,并保存在-80 ℃冰箱待測。
甘油三酯(triglyceride,TG)測定試劑盒、總膽固醇(total cholesterol,TC)測定試劑盒、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)測定試劑盒、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)測定試劑盒 南京建成生物工程研究所;乳酸菌(植物乳桿菌Lactobacillus plantarum HM-10)、干酪乳桿菌(Lactobacillus casei HM-09)的乳安邦復(fù)合微生態(tài)制劑 內(nèi)蒙古和美科盛生物技術(shù)有限公司。
1.2 儀器與設(shè)備
胴體直測型pH計、TC-P2A全自動色差計 北京奧依克光電儀器有限公司;CL-M嫰度儀 東北農(nóng)業(yè)大學(xué)工程學(xué)院;GRX-9053A型熱空氣干燥箱 上海一恒科技有限公司;5424R高速臺式冷凍離心機(jī) 德國Eppendorf公司;NanoDrop2000超微量分光光度計 美國Thermo Fisher Scientific公司。
1.3 方法
1.3.1 胃腸道微生物菌群的測定
1.3.1.1 總DNA提取
采用QIAamp DNA Stool Mini Kit試劑盒提取細(xì)菌總DNA,用核酸濃度測定儀測定總DNA濃度,于-20 ℃保存?zhèn)溆谩?/p>
1.3.1.2 菌群Illumina Miseq測序
選取16S rDNA的V4~V5區(qū)序列進(jìn)行高通量測序分析。進(jìn)一步對目的聚合酶鏈?zhǔn)椒磻?yīng)產(chǎn)物進(jìn)行文庫構(gòu)建,由上海美吉生物醫(yī)藥科技有限公司在Illumina MiSeq平臺上完成測序。
1.3.1.3 生物信息學(xué)分析
使用QIIME分析平臺開展序列的生物信息學(xué)分析[11-12]。PyNAST校準(zhǔn)排齊序列,以100%相似性進(jìn)行UCLUST歸并從而建立無重復(fù)的926R→515F序列集。采用兩步UCLUST歸并,在100%相似性歸并的基礎(chǔ)上進(jìn)一步進(jìn)行97%相似性的歸并,從而建立操作分類單元(operational taxonomic units,OTUs)。通過Chimera Slayer檢測充分去除屬于嵌合體的OTU。將OTU代表性序列通過RDP和Greengenes(Release13.8)數(shù)據(jù)庫進(jìn)行同源性比對,整合兩個數(shù)據(jù)庫的比對結(jié)果,確定每個OTU最終的分類學(xué)地位[13]。對樣品進(jìn)行VENN和主坐標(biāo)分析。Alpha多樣性計算對樣品菌群構(gòu)成的豐度和多樣性進(jìn)行評價。
1.3.2 血脂指標(biāo)測定
采用分光光度法,根據(jù)試劑盒的使用說明書測定血液中TG、TC、HDL-C和LDL-C的濃度。
1.3.3 短鏈脂肪酸含量測定
1.3.3.1 短鏈脂肪酸標(biāo)準(zhǔn)曲線的繪制
取短鏈脂肪酸標(biāo)準(zhǔn)品(純度為99%)1 mL用甲醇定容至10 mL容量瓶中,依次稀釋為6 個梯度(10-1、10-2、10-3、10-4、10-5、10-6)。
1.3.3.2 短鏈脂肪酸的提取
稱取糞便(0.1~0.2 g)與2 mL冰生理鹽水,1 mL體積分?jǐn)?shù)50%的硫酸溶液漩渦混勻后離心(10 000 r/ min,5 min),再加入2 mL乙醚充分混勻并離心(10 000 r/min,5 min),靜置后取上清液,用0.22 μm有機(jī)濾膜過濾后保存待用。
1.3.3.3 氣相色譜-質(zhì)譜條件
氣相色譜條件:TR-5色譜柱(30 m×0.25 mm,0.25 μm),載氣流速1.2 mL/min,進(jìn)樣口溫度250 ℃。程序升溫為:初始溫度為100 ℃,保持0.5 min,以8 ℃/min升至180 ℃,保持1 min;再以20 ℃/min升至200 ℃,保持5 min。進(jìn)樣量為1 μL,分流比10∶1。
質(zhì)譜條件:離子源溫度250 ℃,傳輸線溫度250 ℃,質(zhì)量掃描范圍m/z 40~450。
1.3.4 羊肉品質(zhì)測定
肉品質(zhì)測定參照羅玉龍等[14]的方法,包括肉色、pH值、嫩度和熟肉率。
1.3.4.1 pH值測定
肉羊屠宰后,使用胴體直插式pH計分別測定宰后45 min和24 h背最長肌的pH值,記作pH0和pH24。
1.3.4.2 色澤測定
將肌肉切成3 cm×3 cm×1 cm的肉塊,用TC-P2A全自動色差計測定肌肉色差。L*值表示亮度;a*值表示紅度;b*值表示黃度。
1.3.4.3 嫩度測定
沿羊肉的肌纖維方向進(jìn)行取樣,肉樣排酸24 h后,于水浴鍋中75 ℃蒸煮45 min,取出室溫冷卻后用濾紙擦干表面水分,沿肌纖維方向?qū)⑵淝谐? cm×1 cm×1 cm形狀的肉條,用嫩度儀測定剪切力值。
1.3.4.4 熟肉率測定
取50 g左右的肉樣記錄煮前質(zhì)量(m1/g),然后在水浴鍋中85 ℃煮制40 min,室溫冷卻后,擦干表面水分,記錄煮后質(zhì)量(m2/g),按照下式計算熟肉率。

1.4 數(shù)據(jù)統(tǒng)計分析
數(shù)據(jù)用SPSS 19.0統(tǒng)計軟件進(jìn)行單因素方差分析和相關(guān)性分析(Pearson系數(shù)),以P<0.05表示差異顯著,以P<0.01表示差異極顯著,采用Origin 8.0和Excel 2010軟件作圖。
2 結(jié)果與分析
2.1 益生菌對蘇尼特羊胃腸道菌群組成的影響
胃腸道微生物是“第二基因組”,在調(diào)節(jié)宿主代謝、營養(yǎng)和免疫中扮演著重要角色,而胃腸道菌群失調(diào)會引起一系列疾病。通過高通量測序技術(shù)對兩組羊瘤胃和糞便樣品進(jìn)行測序分析可知:門水平上,胃腸道菌群以擬桿菌門和厚壁菌門為主;在屬水平上,測序結(jié)果中豐度大于1%的主要包括擬桿菌屬、普雷沃菌屬和瘤胃球菌屬等。
2.1.1 益生菌對蘇尼特羊瘤胃菌群組成的影響

表1 益生菌對蘇尼特羊瘤胃微生物相對豐度的影響Table 1 Effect of probiotics on the relative abundance of rumen microflora in Sunit lambs%
由表1可知,在門水平上共檢測到25 種細(xì)菌微生物,主要包括厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)和變形菌門(Proteobacteria),這與Thoetkiattikul等[15]研究結(jié)果一致。其中益生菌組中擬桿菌門的相對豐度顯著高于對照組(P<0.05),厚壁菌門的相對豐度顯著低于對照組(P<0.05),而變形菌門沒有顯著差異(P>0.05)。厚壁菌門和擬桿菌門均有助于宿主代謝,調(diào)節(jié)脂質(zhì)代謝,從而提升能量效率,其中擬桿菌門是促進(jìn)動物利用碳水化合物的優(yōu)勢菌群,而厚壁菌門是促進(jìn)動物胃腸道微生物分解纖維素的優(yōu)勢菌群[16-17]。在本實(shí)驗(yàn)的結(jié)果中,瘤胃中的菌群結(jié)構(gòu)發(fā)生變化,這可能與益生菌進(jìn)入動物瘤胃后,擬桿菌門的數(shù)量增加,厚壁菌門的數(shù)量降低,厚壁菌門與擬桿菌門的比例改變,能抑制有害菌的生長,維持腸道菌群結(jié)構(gòu)的穩(wěn)態(tài)有關(guān)[18]。研究發(fā)現(xiàn),厚壁菌門與擬桿菌門的比值降低,有利于改善畜禽肉的風(fēng)味[19]。
在屬水平上共檢測到489 種細(xì)菌微生物,蘇尼特羊瘤胃中主要包括的微生物(相對豐度大于1%)有:普雷沃菌屬-1(Prevotella-1)、瘤胃球菌屬-1(Ruminococcus-1)、Erysipelotrichaceae-UCG-004、Saccharofermentans和擬桿菌屬(Bacteroides)等。在表1中,益生菌組中f-Bacteroidales-BS11-gut-group(P<0.05)、擬桿菌屬(P<0.05)、Erysipelotrichaceae-UCG-004(P<0.05)、密螺旋體屬-2(Treponema-2)(P<0.05)和Saccharofermentans(P<0.05)的相對豐度顯著高于對照組,而月形單胞菌屬-1(Selenomonas-1)(P<0.05)和瘤胃球菌屬(P<0.05)的相對豐度顯著低于對照組。擬桿菌屬(Bacteroides)在幫助宿主分解多糖用于提高營養(yǎng)利用率、加快腸黏膜的血管形成、免疫系統(tǒng)發(fā)育及提高宿主的免疫力、維持腸道微生態(tài)平衡等方面有著重要作用,在飼糧中添加益生菌能提高擬桿菌屬的數(shù)量[20-22]。對照組羊瘤胃中分布著大量的瘤胃球菌,能促進(jìn)瘤胃中不飽和脂肪酸的生物氫化,這不利于不飽和脂肪酸在肉中的沉積。整體上,添加益生菌可以增加羊瘤胃中擬桿菌屬和部分瘤胃球菌屬的數(shù)量,改善瘤胃菌群結(jié)構(gòu),這對機(jī)體多糖等營養(yǎng)物質(zhì)及纖維素酶分解有益[23]。
2.1.2 益生菌對蘇尼特羊腸道菌群組成的影響

表2 益生菌對蘇尼特羊腸道微生物相對豐度的影響Table 2 Effect of probiotics on the relative abundance of intestinal microflora in Sunit lambs%
腸道微生物的組成與多樣性有助于維持肌肉的正常生長和代謝[24]。表2中呈現(xiàn)了蘇尼特羊腸道中門和屬水平上相對豐度較高的微生物。在門水平上,蘇尼特羊腸道中共檢測到17 種細(xì)菌微生物,優(yōu)勢菌門為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)和變形菌門(Proteobacteria),這些微生物能夠有效降解纖維、提高碳水化合物的利用率,進(jìn)而促進(jìn)消化,這與瘤胃中的主要微生物呈現(xiàn)一致性,但對照組和益生菌組中的腸道微生物數(shù)量不顯著(P>0.05)。相比于瘤胃,益生菌組腸道中的擬桿菌門數(shù)量下降,而厚壁菌門數(shù)量增加,和對照組比較接近,說明益生菌對腸道菌群的影響低于瘤胃。
在屬水平上共檢測到249 種細(xì)菌微生物。蘇尼特羊腸道中主要包括的微生物(相對豐度大于1%):Ruminococcaceae-UCG-002、Ruminococcaceae-UCG-010、Ruminococcaceae-UCG-013和毛螺菌(f-Lachnospiraceae)等,這些優(yōu)勢菌不僅能維持腸道的健康穩(wěn)定水平,而且還能參與剩余營養(yǎng)物質(zhì)的消化吸收,防止養(yǎng)分的流失。益生菌組中毛螺菌(P<0.05)和Ruminococcaceae-UCG-002(P<0.05)的相對豐度顯著高于對照組,而Ruminococcaceae-UCG-010(P<0.05)和Ruminococcaceae-UCG-013(P<0.05)的相對豐度顯著低于對照組。Zhang Hao等[25]研究綿羊的腸道菌群發(fā)現(xiàn),菌群的優(yōu)勢菌屬為擬桿菌屬(Bacteroides)、瘤胃球菌屬(Ruminococcus)、乳酸菌屬(Lactobacillus)和梭菌屬(Clostridium),并且隨著腸道的后移(從空腸、盲腸到直腸)乳酸菌屬減少,擬桿菌屬逐漸增多,這使得乳酸菌屬對腸道菌群的影響減少。
2.2 益生菌對蘇尼特羊胃腸道微生物代謝物的影響
2.2.1 益生菌對蘇尼特羊瘤胃微生物代謝物的影響
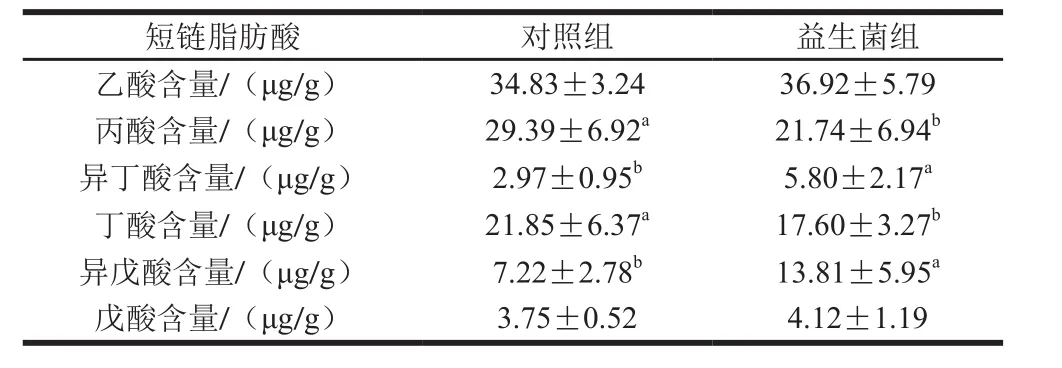
表3 益生菌對蘇尼特羊瘤胃微生物短鏈脂肪酸含量的影響Table 3 Effect of probiotics on contents of ruminal short chain fatty acids in Sunit lambs
由表3可知,益生菌對蘇尼特羊瘤胃微生物的短鏈脂肪酸代謝有顯著影響。益生菌組的丙酸和丁酸含量顯著低于對照組(P<0.05),而異丁酸和異戊酸含量顯著高于對照組(P<0.05),乙酸和戊酸在兩組之間沒有顯著差異(P>0.05)。動物攝食后先進(jìn)入瘤胃消化,瘤胃微生物參與大部分的代謝,代謝產(chǎn)物主要有短鏈脂肪酸,包括乙酸、丙酸、丁酸、戊酸和異戊酸等。短鏈脂肪酸可作為主要的能源物質(zhì),為脂肪代謝、蛋白質(zhì)代謝和碳水化合物代謝等提供能量[26]。
2.2.2 益生菌對蘇尼特羊腸道微生物代謝物的影響

表4 益生菌對蘇尼特羊腸道微生物短鏈脂肪酸含量的影響Table 4 Effect of probiotics on contents of intestinal short chain fatty acids in Sunit lambs
腸道菌群能分解營養(yǎng)物質(zhì),并代謝產(chǎn)生一些代謝產(chǎn)物,包括短鏈脂肪酸、多不飽脂肪酸和膽汁酸等,其中短鏈脂肪酸既可作為后腸的能量物質(zhì),又可以維持腸道屏障功能和調(diào)節(jié)腸道動力。由表4可知,在蘇尼特羊腸道微生物代謝物中,益生菌組的丁酸、異丁酸和戊酸含量顯著低于對照組(P<0.05),而乙酸、丙酸和異戊酸含量在兩組之間沒有顯著差異(P>0.05)。丙酸等短鏈脂肪酸可通過影響糖代謝參與機(jī)體的能量代謝,影響肌肉的生長發(fā)育。Walsh等[27]研究發(fā)現(xiàn),丁酸能增加肌肉的質(zhì)量及活性氧和線粒體水平,抑制肌肉萎縮。異丁酸主要來源于微生物對未消化蛋白質(zhì)的發(fā)酵,其濃度高低可反映腸道中未消化蛋白量,益生菌組中的異丁酸濃度低,說明乳酸菌能促進(jìn)蘇尼特羊?qū)Φ鞍踪|(zhì)的消化,因而腸道中未消化的蛋白質(zhì)相對較少。總之,飼糧中加入益生菌能夠調(diào)節(jié)腸道菌群的數(shù)量,進(jìn)而改變的菌群代謝物,并最終影響肌肉的生長和功能。
2.3 益生菌對蘇尼特羊血脂指標(biāo)的影響

表5 益生菌對蘇尼特羊血脂指標(biāo)的影響Table 5 Effect of probiotics on plasma lipid parameters of Sunit lambs
血液生化指標(biāo)能反映動物脂肪代謝和能量的利用情況,由表5可知,益生菌對蘇尼特羊血液中的代謝指標(biāo)有影響,其中益生菌組血液中HDL-C的濃度顯著高于對照組(P<0.05),LDL-C濃度顯著低于對照(P<0.05),說明飼糧添加益生菌可顯著增加血液中高密度脂蛋白含量,降低低密度脂蛋白含量。研究發(fā)現(xiàn):日糧能影響動物血液的代謝物,進(jìn)而影響機(jī)體脂肪沉積,其中低密度脂蛋白能將膽固醇和TG轉(zhuǎn)運(yùn)到肝外組織細(xì)胞中貯存和利用;而高密度脂蛋白則是將肝外組織中過多的膽固醇轉(zhuǎn)運(yùn)到肝臟代謝,防止膽固醇在這些組織中過多的聚集[28]。Huang Ying等[29]在飼糧中添加植物乳桿菌可降低高膽固醇血癥小鼠的TG和LDL含量進(jìn)而促進(jìn)小鼠機(jī)體健康,這與本實(shí)驗(yàn)的研究結(jié)果一致。因此,飼糧添加益生菌可通過調(diào)節(jié)高低密度脂蛋白含量改善機(jī)體血液脂質(zhì)代謝水平。
2.4 益生菌對蘇尼特羊肉品質(zhì)的影響
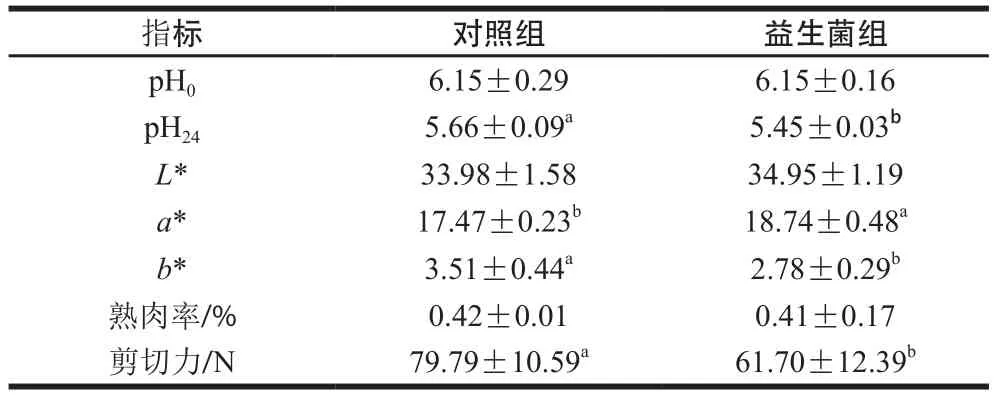
表6 益生菌對蘇尼特羊肉品質(zhì)的影響Table 6 Effect of probiotics on meat quality of Sunit lambs
肉的pH值是決定肉品質(zhì)的重要因素,實(shí)驗(yàn)中兩組羊肉的pH值均在正常范圍內(nèi)。如表6所示,益生菌組羊肉pH24值顯著低于對照組(P<0.05),飼糧中添加益生菌后可改變宰后羊肉機(jī)體內(nèi)糖酵解速率,使肉中的乳酸增多,進(jìn)而降低了肉的pH值。色澤能直觀評價衡量肉質(zhì)的好壞,益生菌組羊肉的a*值顯著高于對照組(P<0.05),而b*值顯著低于對照組(P<0.05),說明益生菌可以提高羊肉的紅度值,降低肉的黃度值,從而改善肉的色澤,這與朱愛文等[30]的研究結(jié)果一致。研究發(fā)現(xiàn)給家禽飼喂乳桿菌也能提高肉的紅度值[31]。
嫩度是反映肉質(zhì)地的重要指標(biāo)之一,益生菌組的剪切力值顯著低于對照組(P<0.05),說明益生菌組的肉較嫩,乳酸菌能改善肉的嫩度,這與張?zhí)礻朳5]的研究結(jié)果一致。分析其原因可能是益生菌改善了蘇尼特羊的菌群結(jié)構(gòu),促進(jìn)了肉中脂肪的沉積,肌內(nèi)脂肪增加可使肌纖維的密度降低,并減少肌纖維間的聯(lián)結(jié)組織,進(jìn)而改善了嫩度[32-33]。本實(shí)驗(yàn)中益生菌對羊肉的熟肉率沒有顯著影響,這驗(yàn)證了Alfaig等[34]的研究結(jié)果。但有研究表明,益生菌的添加可降低肉的滴水損失,提高肉的保水力,從而降低熟肉率[35]。
2.5 蘇尼特羊胃腸道菌群與代謝產(chǎn)物之間的相關(guān)性
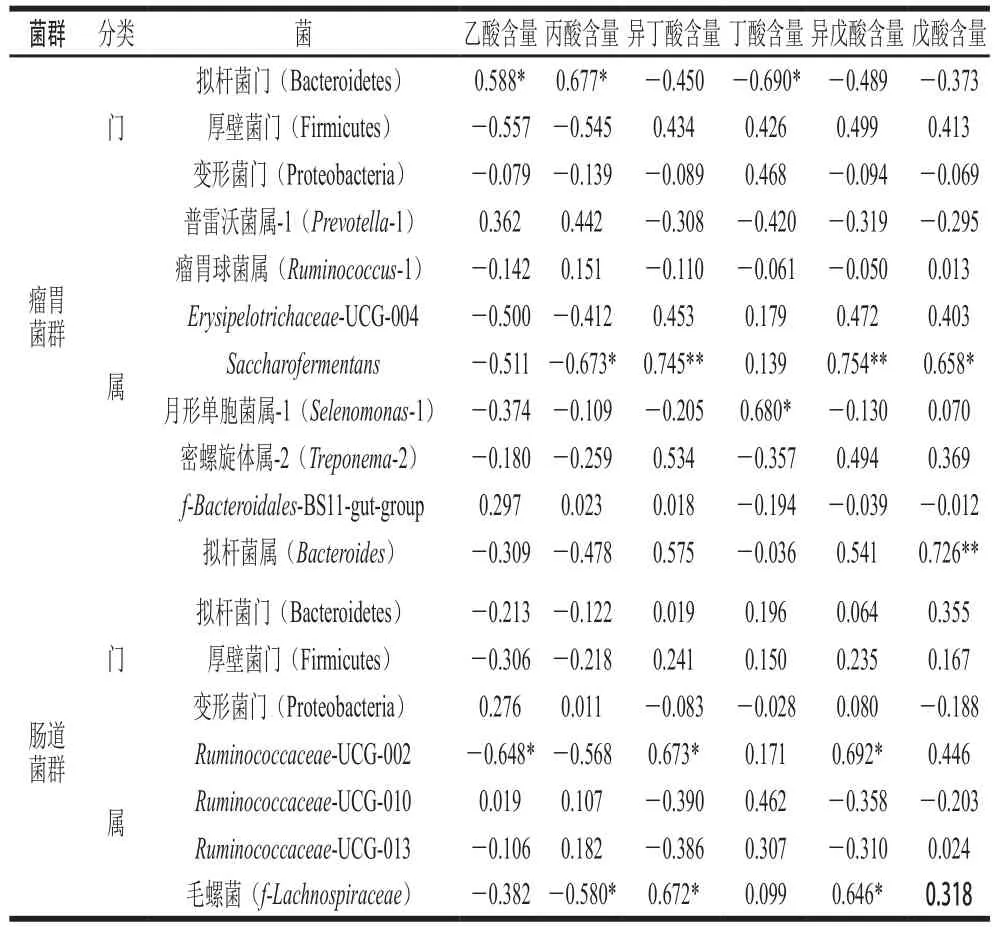
表7 胃腸道菌群與代謝產(chǎn)物的相關(guān)性分析Table 7 Correlation coefficients between rumen and gut microbiota and metabolites
由表7可知,瘤胃菌群中的擬桿菌門相對豐度與乙酸、丙酸含量呈顯著正相關(guān)(P<0.05),與丁酸含量呈顯著負(fù)相關(guān)(P<0.05),這表明擬桿菌門能促進(jìn)乙酸、丙酸的生成,但能抑制丁酸的產(chǎn)生;Saccharofermentans相對豐度與異丁酸(P<0.01)、異戊酸(P<0.01)和戊酸含量(P<0.05)呈顯著正相關(guān),與丙酸呈顯著負(fù)相關(guān)(P<0.05);月形單胞菌屬-1相對豐度與丁酸含量呈顯著正相關(guān)(P<0.05);擬桿菌屬相對豐度與戊酸含量呈極顯著正相關(guān)(P<0.01)。瘤胃微生物可分解可溶性的膳食纖維產(chǎn)生短鏈脂肪酸,主要包括乙酸、丙酸和丁酸。在本研究中,益生菌組中的異丁酸和異戊酸含量顯著高于對照組,說明益生菌能夠調(diào)節(jié)瘤胃菌群,進(jìn)而促進(jìn)丙酸和丁酸的生成。
在腸道菌群中,Ruminococcaceae-UCG-002相對豐度與異丁酸、異戊酸含量呈顯著正相關(guān)(P<0.05),與乙酸含量呈顯著負(fù)相關(guān)(P<0.05);毛螺菌相對豐度與異丁酸、異戊酸含量呈顯著正相關(guān)(P<0.05),與丙酸含量呈顯著負(fù)相關(guān)(P<0.05);這說明Ruminococcaceae-UCG-002和毛螺菌均能促進(jìn)異丁酸和異戊酸的生成;在本研究中發(fā)現(xiàn)攝入益生菌可對肉羊糞便短鏈脂肪酸中的乙酸和丙酸含量有上調(diào)作用;這兩種脂肪酸對機(jī)體有促進(jìn)細(xì)胞代謝、影響肌肉生長等積極作用[36]。
2.6 蘇尼特羊胃腸道菌群與血脂指標(biāo)之間的相關(guān)性
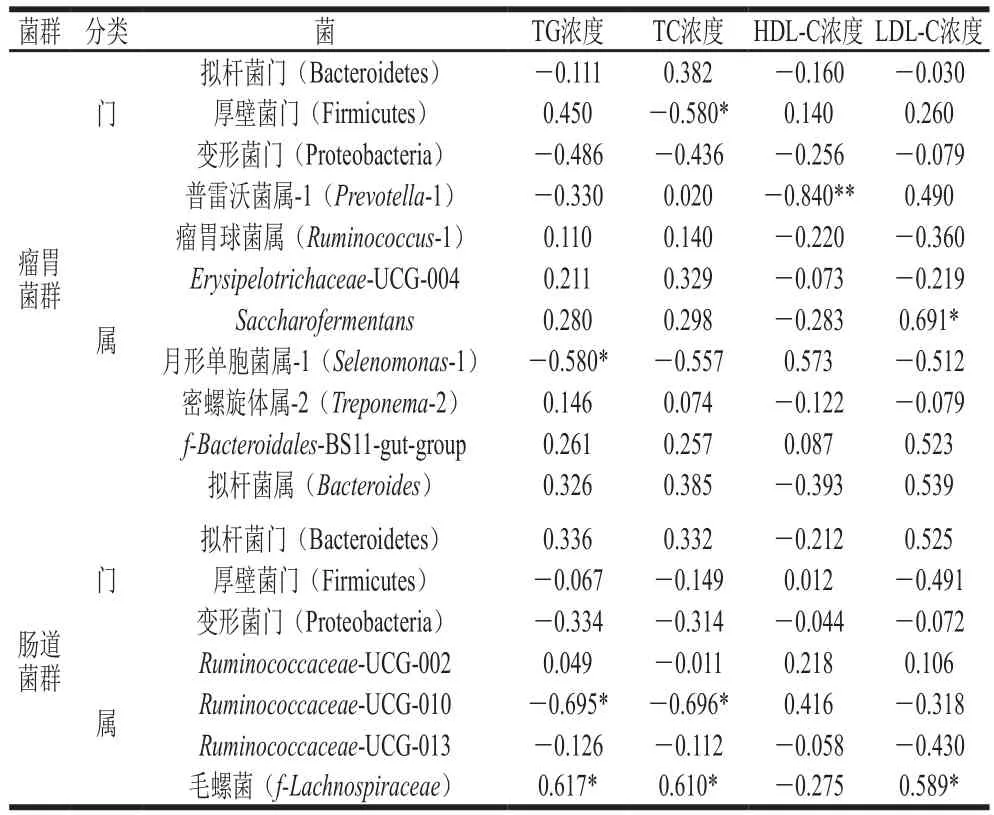
表8 胃腸道菌群與血脂指標(biāo)之間的相關(guān)性分析Table 8 Correlation coefficients between rumen and gut microbiota and plasma lipid parameters
通過分析胃腸道微生物與血脂指標(biāo)的關(guān)系可知(表8),在瘤胃菌群中,Saccharofermentans相對豐度與LDL-C濃度呈顯著正相關(guān)(P<0.05);厚壁菌門相對豐度與TC濃度呈顯著負(fù)相關(guān)(P<0.05);月形單胞菌屬-1相對豐度與TG濃度呈顯著負(fù)相關(guān)(P<0.05);普雷沃菌屬-1相對豐度與HDL-C濃度呈極顯著負(fù)相關(guān)(P<0.01);說明瘤胃菌群中Saccharofermentans能促進(jìn)LDL-C的產(chǎn)生,而厚壁菌門能抑制TC的生成,月形單胞菌屬-1能抑制TG的生成,普雷沃菌屬-1則能抑制HDL-C生成。
在腸道菌群中,Ruminococcaceae-UCG-010相對豐度與TG、TC濃度呈顯著負(fù)相關(guān)(P<0.05),說明Ruminococcaceae-UCG-010能抑制TG和TC的生成;毛螺菌相對豐度與TG、TC、LDL-C濃度呈顯著正相關(guān)(P<0.05)。有研究發(fā)現(xiàn)毛螺菌豐度與動脈粥樣硬化患者血漿中TC和LDL-C的濃度呈正相關(guān)(P<0.05),其原因是NPC1L1蛋白是介導(dǎo)小腸對膽固醇吸收的關(guān)鍵蛋白質(zhì),益生菌能夠抑制腸道NPC1L1蛋白的表達(dá),從而降低血液中的TC和LDL-C濃度[37]。
2.7 蘇尼特羊胃腸道菌群與肉品質(zhì)之間的相關(guān)性

表9 胃腸道菌群與肉品質(zhì)的相關(guān)性分析Table 9 Correlation coefficients between rumen and gut microbiota and meat quality
胃腸道菌群與肉品質(zhì)的相關(guān)性分析結(jié)果見表9,在瘤胃菌群中,Saccharofermentans相對豐度與pH0值呈極顯著負(fù)相關(guān)(P<0.01),厚壁菌門相對豐度與熟肉率呈極顯著負(fù)相關(guān)(P<0.01),月形單胞菌屬-1與熟肉率呈顯著負(fù)相關(guān)(P<0.05),密螺旋體屬-2與pH0值、剪切力呈顯著負(fù)相關(guān)(P<0.05);研究發(fā)現(xiàn)Saccharofermentans增多能促進(jìn)腸道中短鏈脂肪酸的生成,其中60%~70%被用于能源物質(zhì),其余的進(jìn)入肌肉組織并引起了肉pH值的降低[38-39]。
在腸道菌群中,厚壁菌門相對豐度與a*值呈顯著正相關(guān)(P<0.05),本研究發(fā)現(xiàn)益生菌能夠提高肉的紅度,這可能是益生菌改變了腸道中厚壁菌門和擬桿菌門的比例,促進(jìn)了肉中肌紅蛋白的合成,進(jìn)而調(diào)控肉色。Ruminococcaceae-UCG-002與pH0、pH24值呈極顯著負(fù)相關(guān)(P<0.01),Ruminococcaceae-UCG-013與pH24值呈極顯著負(fù)相關(guān)(P<0.01),說明腸道中的一些菌屬能降低pH值,使肉的pH值保持在正常的范圍內(nèi)。毛螺菌相對豐度與熟肉率呈顯著正相關(guān)(P<0.05),目前關(guān)于毛螺菌影響肉保水性的機(jī)理仍不明確,這可能與細(xì)胞因子的變化有關(guān)[40]。
3 結(jié) 論
飼糧中添加益生菌能影響胃腸道菌群的組成,其中益生菌組羊瘤胃菌群中擬桿菌門、擬桿菌屬和f-Bacteroidales-BS11-gut-group的相對豐度增加;腸道菌群中毛螺菌和Ruminococcaceae-UCG-002的相對豐度增加。在胃腸道代謝物中,益生菌組瘤胃中的丙酸和丁酸含量降低;益生菌組的腸道中的丁酸、異丁酸和戊酸含量降低;血脂指標(biāo)中,益生菌組的HDL-C濃度增加,LDL-C濃度降低;肉品質(zhì)中,益生菌組羊肉的pH24值和剪切力值降低,而a*值增加。蘇尼特羊胃腸道菌群相對豐度與代謝物、血脂指標(biāo)、肉品質(zhì)的相關(guān)性分析中,瘤胃菌群中的擬桿菌門相對豐度與乙酸、丙酸含量呈顯著正相關(guān)(P<0.05);腸道菌群的Ruminococcaceae-UCG-002相對豐度與異丁酸、異戊酸含量呈顯著正相關(guān)(P<0.05);腸道菌群的毛螺菌相對豐度與TG、TC、LDL-C濃度呈顯著正相關(guān)(P<0.05);腸道菌群的厚壁菌門相對豐度與a*值呈顯著正相關(guān)(P<0.05)。

