預冷方式對紅瑪瑙櫻桃果實冷藏期間真菌多樣性的影響
馮雅蓉
(山西農業大學信息學院,山西 太谷 030800)
甜櫻桃果實酸甜鮮香、色澤艷麗、營養豐富,深受消費者喜愛。然而甜櫻桃成熟期集中,貯藏期短,極易軟化腐爛,采后損失嚴重,這限制了櫻桃產業的健康發展。據報道,引發甜櫻桃采后霉變的病原菌包括青霉、鏈核盤菌屬、鏈格孢屬、根霉、灰霉等[1]。采后預冷處理可快速降低櫻桃果實生理活性,延長冷藏期。然而不同的冷藏方式可能改變微生物菌群結構,最終呈現出不同程度或類型的霉爛。風冷處理是目前應用較為廣泛的預冷方式,成本低,較易實現,但其降溫速率慢,果實保質期短。冰水預冷的冷卻速率快,可以延長果蔬保藏期[2-3]。臭氧具有殺菌作用,在堿性溶液中有高的氧化還原電位(2.07 V),是一種有效的抗菌物質[4]。臭氧在溶液中不穩定,會持續緩慢地分解為O2和水,不產生其他殘留物質,安全性高。因此臭氧水廣泛用于果蔬的防腐保鮮[5]。高通量測序可以分析一個生物樣本中所有真菌組成。因此學術界廣泛應用該技術鑒定果蔬種植及貯藏過程中的腐敗菌,并分析菌群演替規律[6-7]。
本實驗擬通過高通量測序法解析經過風冷、冰水預冷以及臭氧化冰水預冷的紅瑪瑙櫻桃,在冷藏前期、中期和后期果實表面的真菌組成,包括真菌的豐富度、多樣性以及優勢菌的動態變化。以揭示3 種冷卻方式在控制真菌方面的優劣勢,為實際生產中櫻桃預冷方式的選擇提供參考,也為進一步引入其他抗菌技術、綜合延長櫻桃采后貯藏期提供思路。
1 材料與方法
1.1 材料與試劑
紅瑪瑙櫻桃(山西省農科院果樹研究所研發的新品種)采自山西省太谷縣。采收時果實成熟度為8~9成,為一級果,選擇單果質量(5.0±0.5)g、果個均勻、色澤一致、無病蟲害及物理損傷的果實進行實驗。
高保真DNA聚合酶 北京全式金生物技術有限公司;xyPrepDNA凝膠回收試劑盒 美國AXYGEN公司。
1.2 儀器與設備
QuantiFluorTM-ST藍色熒光定量系統 美國Promega公司;便攜式臭氧發生器 青島藝博凈化設備有限公司。
1.3 方法
1.3.1 紅瑪瑙櫻桃預冷處理
櫻桃采用4 種預處理方式,處理方法分別如下。
風冷:櫻桃果實于0 ℃冷庫中進行通風冷卻,至果品溫度下降到(1.0±0.5)℃時停止冷卻,包裝后置于(0.0±0.5)℃冷庫貯藏。
冰水預冷:將櫻桃果實放入(1.0±0.5)℃冰水中。冰水的制備采用山西省太谷縣自來水(pH 7.28),部分存入冷庫(0.0±0.5)℃降溫為冷水,部分凍為邊緣光滑的冰塊,二者混合制得(1.0±0.5)℃的冰水。冷卻櫻桃過程中,當冰水溫度上升超過5 ℃時,將櫻桃轉入新的冰水中,直至果實內部溫度下降到(1.0±0.5)℃時停止冷卻。
臭氧化冰水預冷:依照冰水預冷方法制得冰水(1.0±0.5)℃,以便攜式臭氧發生器通入冰水,使得臭氧質量濃度達到2.1 mg/L,預冷策略與冰水預冷相同。
冰水預冷以及臭氧化冰水預冷處理后的櫻桃均以無菌吸水紙吸去表面水分,包裝后與風冷組櫻桃置于相同冷庫(溫度(0.0±0.5)℃、相對濕度(93±2)%)貯藏。每種預冷處理分別設置3 個生物學重復。
1.3.2 真菌基因組提取及ITS序列測定
分別在貯藏的第0(即為預冷處理后,送入冷庫達到平衡溫度后的樣品)、15天和第30天收集風冷、冰水預冷和臭氧化冰水預冷處理組的紅瑪瑙櫻桃果實,每組從3 個生物學重復樣品中分別取30 顆果實,立即置于無菌容器中,液氮速凍后置于-80 ℃冷凍保存,于1 個月內送樣測試。
對于0、15、30 d的樣品編號,風冷組分別為:A0、A15、A30;冰水預冷組分別為:I0、I15、I30;臭氧化冰水預冷組分別為:OI0、OI15、OI30。
樣品處理過程:1)以氯化鈉-三羥甲基氨基甲烷-乙二胺四乙酸緩沖液洗滌果實表面,DNA提取試劑盒提取表面真菌總DNA,以質量分數1%瓊脂糖凝膠電泳檢測基因組DNA長度。2)聚合酶鏈式反應(polymerase chain reaction,PCR)擴增真菌內部轉錄間隔子(the internal transcribed spacer,ITS)序列。3)使用xyPrepDNA凝膠回收試劑盒切膠回收PCR產物,用QuantiFluorTM-ST藍色熒光定量系統進行定量檢測。4)MiSeq文庫構建。5)MiSeq上機測序。
1.4 數據處理與分析
測序原始數據下機后,首先進行數據質控,通過序列拼接、過濾和去嵌合體后得到優化序列,然后進行可操作分類單元(operational taxonomic unit,OTU)聚類及注釋。基于聚類結果,進行Alpha多樣性分析;基于注釋結果,得到各水平的分類信息,進行樣本組成及樣本間群落結構差異相關分析。
2 結果與分析
2.1 真菌組數據質控及OTU基礎分析
27 個樣品的下機數據(raw data、PE file)在去除barcode和primer并拼接后得到raw_tags共計664 077 個,raw_tags經進一步去除嵌合體、短序列后得到優質序列clean_tags共計661 881 個。所獲得的優質序列長度主要分布在200~260 bp之間,還有少部分分布在260~480 bp之間。真菌ITS組測序共產生334 個OTU,從3 個處理組的整體水平而言(不考慮貯藏時間),3 種預冷處理組樣品OTU分類有明顯的區別(圖1a)。3 個處理組共有的OTU數量為124,風冷處理組獨有的OTU數量為63 個,冰水處理組獨有的OTU數量為26 個,臭氧化冰水處理組獨有的OTU數量為35 個。除三組共有序列外,對于兩組共有的OTU數量,冰水處理組與風冷處理組共有29 個,臭氧化冰水與風冷處理組共有46 個,冰水處理和臭氧化冰水處理組共有11 個。考慮貯藏時間對群落結構多樣性的影響(圖1b),各處理各取樣時間樣品共有的OTU 25 個,特有的OTU數量分別為A0 178 個、A15 133 個、A30 138 個、I0 92 個、I15 111 個、I30 109 個、OI0 166 個、OI15 103 個、OI30 103 個。
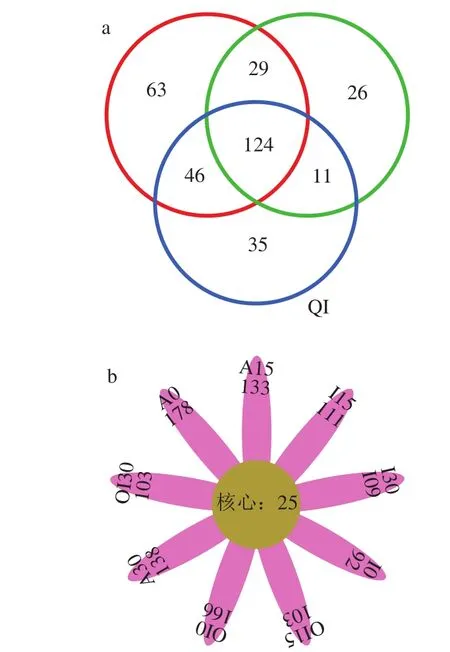
圖1 不同預冷處理的紅瑪瑙櫻桃表皮真菌組群落結構(a)及貯藏過程中OTU分布(b)Fig. 1 Venn map (a) of fungal community structure on Red Agate cherry fruit treated with different pre-cooling methods and Petal map of OTU distribution (b) during storage
2.2 不同預冷處理對紅瑪瑙櫻桃表面真菌組Alpha多樣性的影響

表1 不同預冷處理的紅瑪瑙櫻桃貯藏期間表皮真菌組Alpha多樣性指數Table 1 Alpha diversity indices of fungal communities on Red Agate cherry fruit treated with different pre-cooling methods during storage
表1顯示了各處理組在不同取樣時間的Alpha多樣性指數。各組樣品的觀測深度(goods_coverage)均在0.999以上,說明本次測序結果能代表樣本中微生物的真實情況。Chao1指數可用于評估菌群豐度,其數值越高代表豐富度越高,風冷處理組在貯藏過程中物種豐富度(Chao1指數)先下降,之后到30 d(170.64)又恢復到與初始(174.94)相近的水平。相對于風冷處理組,冰水處理組初始時物種豐富度較低(Chao1指數為97.58),隨著貯藏時間延長而升高,但仍低于風冷處理組。臭氧化冰水處理組初始物種豐富度(Chao1指數為165.48)略低于風冷處理組,在貯藏過程中Chao1指數一直下降。Shannon指數可用來評估菌群多樣性,Shannon指數越大,說明群落多樣性越高。貯藏初始的各組Shannon指數由大到小依次為風冷處理組(2.85)>臭氧化冰水處理組(2.74)>冰水處理組(2.67)。貯藏過程中,風冷處理組中多樣性先增加后降低,到30 d時Shannon指數為2.34。冰水處理組Shannon指數變化幅度較小,臭氧化冰水處理組先小幅下降,后略有上升,但30 d時仍低于最初水平。
2.3 不同預冷處理對紅瑪瑙櫻桃表面真菌組成的影響


圖2 不同預冷處理的紅瑪瑙櫻桃貯藏期間表皮真菌群落結構組分比例Fig. 2 Fungal community structure on Red Agate cherry fruit treated with different pre-cooling methods during storage
不同預冷處理組紅瑪瑙櫻桃表面的真菌組成發生了顯著變化,在初始和貯藏過程中真菌菌群組成存在差異。如圖2a所示,在門水平上,冰水處理組在貯藏的第15天(I15),優勢的子囊菌門(Ascomycota)比例明顯下降,貯藏到第30天(I30)又上升。而臭氧化冰水處理組在貯藏的初期(OI0)子囊菌門(Ascomycota)比例低于其他兩種處理(A0、I0),但貯藏的第15天和第30天時,子囊菌門(Ascomycota)比例相對0 d時上升。
如圖2b所示,在綱水平上,風冷處理組隨著貯藏時間的延長,比例占優勢的座囊菌綱(Dothideomycetes)所占比例持續下降,酵母綱(Saccharomycetes)和糞殼菌綱(Sordariomycetes)在0~15 d比例增加,酵母綱的比例在第30天時最高。對于冰水處理組,初始菌落構成與風冷組類似,貯藏到15 d時座囊菌綱所占比例降低,而銀耳綱(Tremellomycetes)和酵母綱(Saccharomycetes)的比例增加,但在貯藏30 d時,座囊菌綱比例又回升至初始狀態。臭氧化冰水處理組貯藏初期座囊菌綱依然為優勢菌綱,但比例低于風冷組和冰水處理組低,銀耳綱所占比例較高,隨著貯藏的進行,座囊菌綱占據絕對優勢。
如圖2c所示,在目水平上,各處理組初始優勢菌為座囊菌目(Dothideales)、格孢腔菌目(Pleosporales)和煤炱目(Capnodiales)3 類。風冷組這3 類菌初始相對含量由大到小為:格孢腔菌目(Pleosporales)>座囊菌目(Dothideales)>煤炱目(Capnodiales);冰水預冷組初始真菌組成中座囊菌目(Dothideales)>格孢腔菌目(Pleosporales)>煤炱目(Capnodiales);臭氧化冰水預冷組初始真菌組成比例與風冷和冰水處理組有較大差別,座囊菌目和格孢腔菌目比例較高,煤炱目比例相對較低,這3 種目總體比例顯著低于它們在其他兩種處理中的初始比例。隨著貯藏時間的延長,風冷處理組格孢腔菌目比例先上升后大幅度降低,座囊菌目比例先下降后上升至與初始比例相近,煤炱目比例在前15 d變化不大,之后大幅增加,到第30天成為優勢菌,酵母菌目比例持續增加;同時,其他菌所占的比例在30 d內也有所增加。對于冰水預冷處理組,座囊菌目比例先上升后下降,格孢腔菌目和煤炱目比例先下降后增加,但這兩個目的比例都低于對應組的初始水平;酵母菌目在15 d時比例最高,另有一類未鑒定出的菌比例較高。對于臭氧化冰水處理組,貯藏第15天,座囊菌目比例上升成為比例最高的優勢菌,格孢腔菌目比例下降,煤炱目比例上升到與格孢腔菌目比例相當,其他菌比例降低。貯藏到第30天,格孢腔菌目比例大幅度上升,成為最主要的優勢菌,座囊菌目和煤炱目比例均降低,但三者仍然是合計占比95%以上的優勢菌。
如圖2d所示,在科水平上,各處理組初始優勢菌科一致,均含小穴殼菌科(Dothioraceae)、分類位置未定菌(Incertae-sedis)、小戴衛霉科(Davidiellaceae)、孢腔菌科(Pleosporaceae),以及一類未知的菌。風冷處理組初始這4 類菌比例相當。冰水處理組初始小穴殼菌科(Dothioraceae)比例最高,臭氧化冰水處理組初始小穴殼菌科(Dothioraceae)和分類位置未定菌(Incertae-sedis)比例相當,占據了75%以上。與貯藏開始相比,風冷處理組第15天時小穴殼菌科比例降低,孢腔菌科比例增加,到第30天時小戴衛霉科比例明顯增加,成為優勢菌,酵母科比例也明顯增加。冰水處理組貯藏第15天,小穴殼菌科、未知菌以及酵母科比例增加,孢腔菌科比例降低,貯藏30 d,孢腔菌科比例增加,小穴殼菌科比例降低。臭氧化冰水處理組貯藏15 d后小穴殼菌科和小戴衛霉科比例上升,分類位置未定菌比例下降,貯藏30 d時,分類位置未定菌比例大幅度上升,成為比例最高的菌。
如圖2e所示,就屬水平而言,各處理組的初始優勢菌均包括未知菌(unidentified)和短梗霉屬(Aureobasidium)。風冷處理組和冰水處理組的初始優勢菌還有鏈格孢屬(Alternaria)、Davidiella和附球(真)菌屬(Epicoccum);而臭氧化冰水處理組初始真菌組中這3 類菌的比例顯著低于其他兩種處理組。隨著貯藏過程的進行,風冷處理組在15 d時,鏈格孢屬比例小幅增加,未知菌和短梗霉屬比例略降低,其他非優勢菌比例略有增加,貯藏第30天,未知菌比例大幅上升,短梗霉屬比例也有一定程度的上升,鏈格孢屬比例明顯降低。冰水處理組貯藏15 d后,短梗霉屬比例增加,未知菌和鏈格孢屬比例降低,貯藏30 d后,未知菌和Davidiella比例增加。臭氧化冰水處理組在貯藏15 d時,鏈格孢屬比例下降,貯藏第30天,短梗霉屬比例降低,未知菌和鏈格孢屬比例增加。
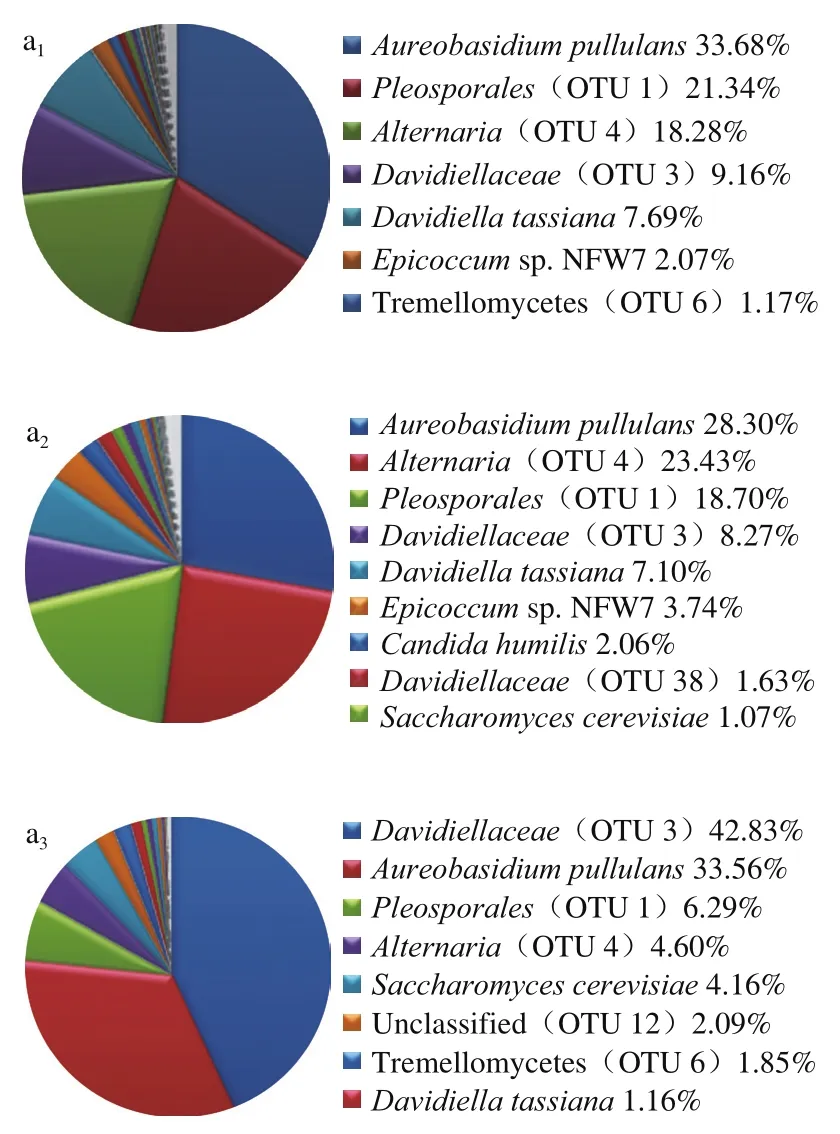

圖3 不同預冷處理的紅瑪瑙櫻桃貯藏期間表皮優勢真菌(OTU)餅形圖Fig. 3 Global percentage of dominant fungi on Red Agate cherry fruit treated with different pre-cooling methods during storage
圖3 和圖4分別展現了不同預冷處理后紅瑪瑙櫻桃表面優勢真菌OTU的分布和比例變化趨勢。3 種預冷處理櫻桃表面初始共有的優勢菌均包括出芽短梗霉菌(Aureobasidium pullulans)、格孢腔菌目(OTU 1)、鏈格孢屬(OTU 4)和小戴衛霉科(OTU 3)。與風冷相比,冰水預冷顯著降低了初始菌中OTU 1和OTU 4的比例,使得出芽短梗霉菌成為最主要的優勢菌,占據總菌的40.23%。與其他兩個預冷處理相比,臭氧化冰水預冷則顯著降低了初始菌中OTU 4和OTU 3的比例,使得出芽短梗霉菌成為最主要的優勢菌,占據總菌的40.49%。隨著貯藏的進行,風冷組出芽短梗霉菌比例先下降,到30 d又上升至33.56%,格孢腔菌目(OTU 1)比例一直下降至5.29%,鏈格孢屬(OTU 4)先小幅度上升,后期大幅下降到4.6%,小戴衛霉科(OTU 3)前期略有下降,后期大幅度上升至42.83%,成為比例最高的菌。冰水預冷組在貯藏的整個過程中,出芽短梗霉菌都占據數量上的絕對優勢,15 d時比例達到54.64%,30 d時達到48.29%,鏈格孢屬(OTU 4)和小戴衛霉科(OTU 3)的比例在貯藏過程中持續緩慢下降到10%以下,而格孢腔菌目(OTU 1)在第15 天時快速降低至3.29%,在第30天又恢復至15.28%。臭氧化冰水預冷組的出芽短梗霉菌在0 d和15 d占據絕對優勢,15 d時比例超過50%,但30 d時卻大幅下降到18.45%,而初始占比29.86%的格孢腔菌目(OTU 1),雖然在15 d時下降到了15.04%,卻在30 d時上升到48.27%,成為優勢菌,致腐菌鏈格孢屬(OTU 4)雖然在第0天和15天占比不高于6%,卻在30 d時達到了14.26%,也可能參與臭氧化冰水預冷紅瑪瑙櫻桃的腐敗,小戴衛霉科(OTU 3)比例在第15 天大幅度上升,但30 d時下降到了低于4%的水平,可能不是主要的腐敗菌。
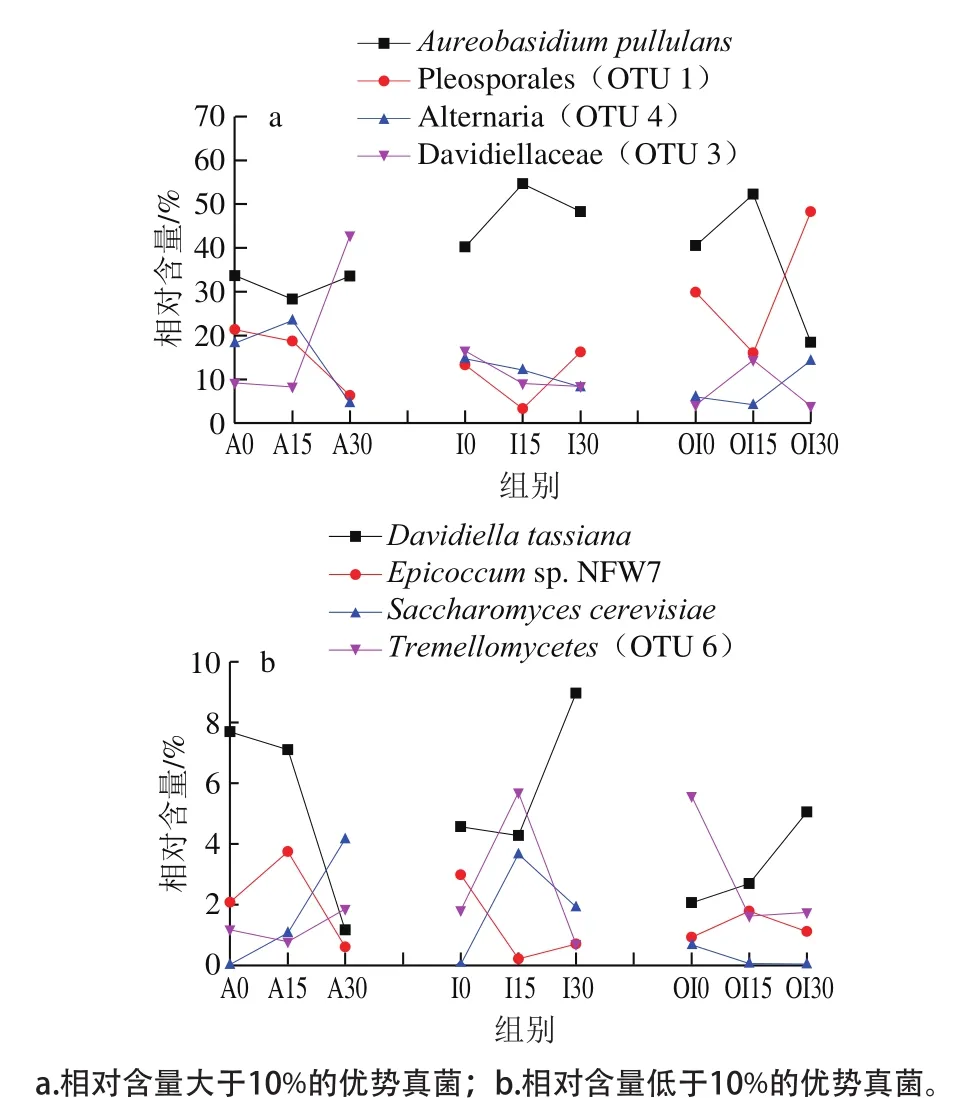
圖4 不同預冷處理的紅瑪瑙櫻桃貯藏期間表皮優勢真菌(OTU)變化趨勢Fig. 4 Development of dominant fungal components (OTU) on Red Agate cherry fruit treated with different pre-cooling methods during storage
3 討 論
新鮮果蔬在貯藏過程中非常容易腐敗,從而產生嚴重的經濟損失,其中由微生物所帶來的損傷可能達到30%[8]。預冷能快速降低果實溫度,降低果實自身代謝,同時對果蔬表面真菌組也有一定影響,從而影響后續貯藏過程中的霉變。本研究通過高通量測序技術分析證明,與風冷相比,冰水預冷以及臭氧冰水預冷對于紅瑪瑙櫻桃表面初始真菌組具有明顯的影響,兩種處理均提高了出芽短梗霉菌在初始菌群中所占的比例,降低了格孢腔菌目、鏈格孢屬和小戴衛霉科的比例。據報道,出芽短梗霉菌可以作為生防菌,拮抗引起桃子褐腐病的核果鏈核盤菌[9]以及導致番茄晚疫病的致病疫霉[10],可用于防治蘋果采后由灰葡萄孢和擴展青霉引起的霉變[11]。格孢腔菌目包含許多屬種[12],包含一些可引起果蔬疾病的病原菌,如黑星菌屬中的蘋果黑星菌(引起蘋果黑星病)[13]、梨黑星菌(引起梨黑星病)[14]、格孢腔菌屬中的枯葉格孢腔菌(危害蔥、蒜、辣椒等,引起黑斑病、葉枯病)等[15]。鏈格孢屬,屬半知菌亞門,是櫻桃樹的重要內生菌[16],也能夠引起櫻桃果實的腐敗[17]。小戴衛霉科含7 個屬,其中包含一種重要的病原真菌臘葉芽枝霉(Cladosporium herbarum s. str.(Davidiella tassiana))[18]。可見,本研究中冰水預冷和臭氧冰水預冷可提高紅瑪瑙櫻桃表面初始真菌群中的益生菌比例,而降低病原菌比例,有利于櫻桃的貯藏。
據報道甜櫻桃果實采后的常見病原真菌有擴展青霉(Penicillium expansum)、葡枝根霉(Rhizopus stolonifer)、鏈核盤菌(Monilinia sp.)[19]、灰葡萄孢菌(Botrytis cinerea)[20]、炭疽菌(Colletotrichum acutatum)[21]、鏈格孢菌(Alternaria alternata)等[22]。本研究中的紅瑪瑙櫻桃無論以哪種方式預冷,在貯藏30 d時均出現少量的霉腐果實。風冷預冷櫻桃表面的小戴衛霉科是最主要的腐敗菌。冰水預冷櫻桃表面,生防菌出芽短梗霉菌占據絕對優勢,格孢腔菌目(OTU 1)、鏈格孢屬(OTU 4)、小戴衛霉科(OTU 3)和臘葉芽枝霉在第30天比例分別上升到16.28%、8.23%、8.40%和8.96%,它們可能是主要病原菌。貯藏的第30天,臭氧化冰水預冷櫻桃表面格孢腔菌目占據絕對優勢,是最主要的腐敗菌。
除以上絕對優勢菌外,一些比例不高于10%的真菌也可能影響紅瑪瑙櫻桃的貯藏。如附球菌屬中Epicoccum sp. NFW7在風冷櫻桃表面的比例先升后降,在冰水預冷組初始比例略高于風冷組,在貯藏中先降低后輕微上升,但仍然較低。而臭氧化冰水預冷組該菌比例一直較低。附球菌屬是櫻桃樹的重要內生菌[16],但其與紅瑪瑙櫻桃的采后腐敗關系不明。研究發現附球菌屬(Epicoccum)中的黑附球菌可用作生防菌,防治桃子采后褐腐病[23];但也會引起中國西南琵琶葉斑病[24]。Epicoccum sorghinum能造成芋頭葉斑病[25]。釀酒酵母(Saccharomyces cerevisiae)可以作為生物防治菌,防治采前炭疽病菌[26]及蘋果的青霉病[27]等。本研究中風冷處理組釀酒酵母的比例在貯藏過程中持續上升,冰水處理組先升后降,而臭氧化冰水處理組中比例一直較低。臭氧及其氧化物可以攻擊細菌的許多成分,包括與細胞膜脂肪酸反應生成酸類或者過氧化物[28],從而增強細菌細胞膜的通透性[29-31]。臭氧還可以攻擊細胞的膜結合酶類的巰基、細胞內酶類[32-34]、電子傳遞鏈物質[35],以及細胞內的DNA[36]。臭氧也能攻擊細菌芽孢及真菌孢子的外殼、病毒衣殼中的蛋白質和糖蛋白,因此對芽孢、孢子和病毒有抑殺作用[37-39]。
可見3 種預冷方式對紅瑪瑙櫻桃表面的初始真菌組有明顯的影響,而貯藏過程中真菌組的變化除了與初始真菌組成以及貯藏條件相關外,也受到櫻桃本身生理狀態的影響。風冷組櫻桃果實在預冷過程中呼吸消耗較大,而冰水和臭氧冰水預冷雖然以較快速度降低了櫻桃的代謝,但難以避免的對櫻桃表皮造成了一定損傷。研究3 種預冷處理后櫻桃的代謝水平,將有利于揭示各種預冷方式的優缺點。
4 結 論
相比于風冷處理,冰水處理和臭氧化冰水處理明顯改變了紅瑪瑙櫻桃初始表面真菌組的群落組成,并且改變了冷藏期間真菌組的發展變化。冰水處理最有利于提高櫻桃表面出芽短梗霉菌等生防菌的比例,臭氧化冰水處理樣品在冷藏前期芽短梗霉菌等生防菌比例較高。然而,冷藏過程中,3 種預冷方式處理的櫻桃,病原微生物依然占據一定比例,并最終導致霉變。建議將預冷與其他抑菌方式相結合,利用柵欄技術控制櫻桃冷藏過程中的真菌腐敗。

