武威市涼州區住院患者血流感染主要分離病原菌及耐藥性分析
于同德,李艷萍,王 偉
(武威市涼州醫院,甘肅 武威 733000)
近年來,因患者廣泛或者頻繁更換使用抗菌藥物,臨床多種侵入性操作增加,導致患者發生血流感染的機率不斷增高。發生血流感染時多表現為敗血癥和菌血癥,發病較急,嚴重者會危及生命。血液培養作為患者發生血流感染的重要監測手段,對明確感染源,為臨床提供合理的抗菌藥物使用參考具有重要的意義。本研究通過對武威市涼州區涼州醫院及涼州三院血培養陽性結果進行病原菌及其耐藥趨勢變化進行回顧性分析,以期為臨床使用抗菌藥物提供參考。
1 材料與方法
1.1 菌株來源
選擇2014年1月至2018年12月,在武威市涼州醫院、涼州三院住院患者首次血培養陽性分離菌株,不包括重復菌株。
1.2 試劑與儀器
湖南長沙天地人微生物分析系統TDR-300B及細菌藥敏鑒定卡,美國BD-9120血培養儀及血培養瓶。
1.3 方法
嚴格無菌操作,抽取靜脈血,成人8~10mL,兒童3~5mL。血培養儀培養5d,將期間儀器報警陽性的血培養瓶分離轉種。同時與臨床醫生溝通,將考慮為患者病原菌的細菌進行鑒定和藥敏分析,根據美國臨床實驗室標準化研究所(CLSI)標準進行藥敏結果判讀。
1.4 質控菌株
金黃色葡萄球菌(ATCC 25923)、糞腸球菌(ATCC 29212)、大腸埃希菌(ATCC 25922)、銅綠假單胞菌(ATCC 27853),均來自衛生部臨床檢驗中心。
1.5 統計學處理
采用WHONET5.6軟件對病原菌的分布和藥敏試驗結果進行分析。
2 結果
2.1 病原體分布
2014年1月-2018年12月年從患者血液標本中共分離病原菌463株,其中革蘭陰性桿菌占57.88%,革蘭陽性球菌41.69%,革蘭陽性桿菌0.43%;居前3位的細菌分別是大腸埃希菌、表皮葡萄球菌、肺炎克雷伯菌。見表1。
2.2 分離的主要腸桿菌科細菌對抗菌藥物的耐藥率
大部分腸桿菌科細菌對一、二代頭孢菌素耐藥率高,頭孢他啶敏感性優于頭孢曲松,對哌拉西林/他唑巴坦、頭孢西丁、阿米卡星敏感性較好,未檢出美羅培南耐藥的腸桿菌科細菌,見表2。

表1 血培養陽性標本分離病原菌構成(%)
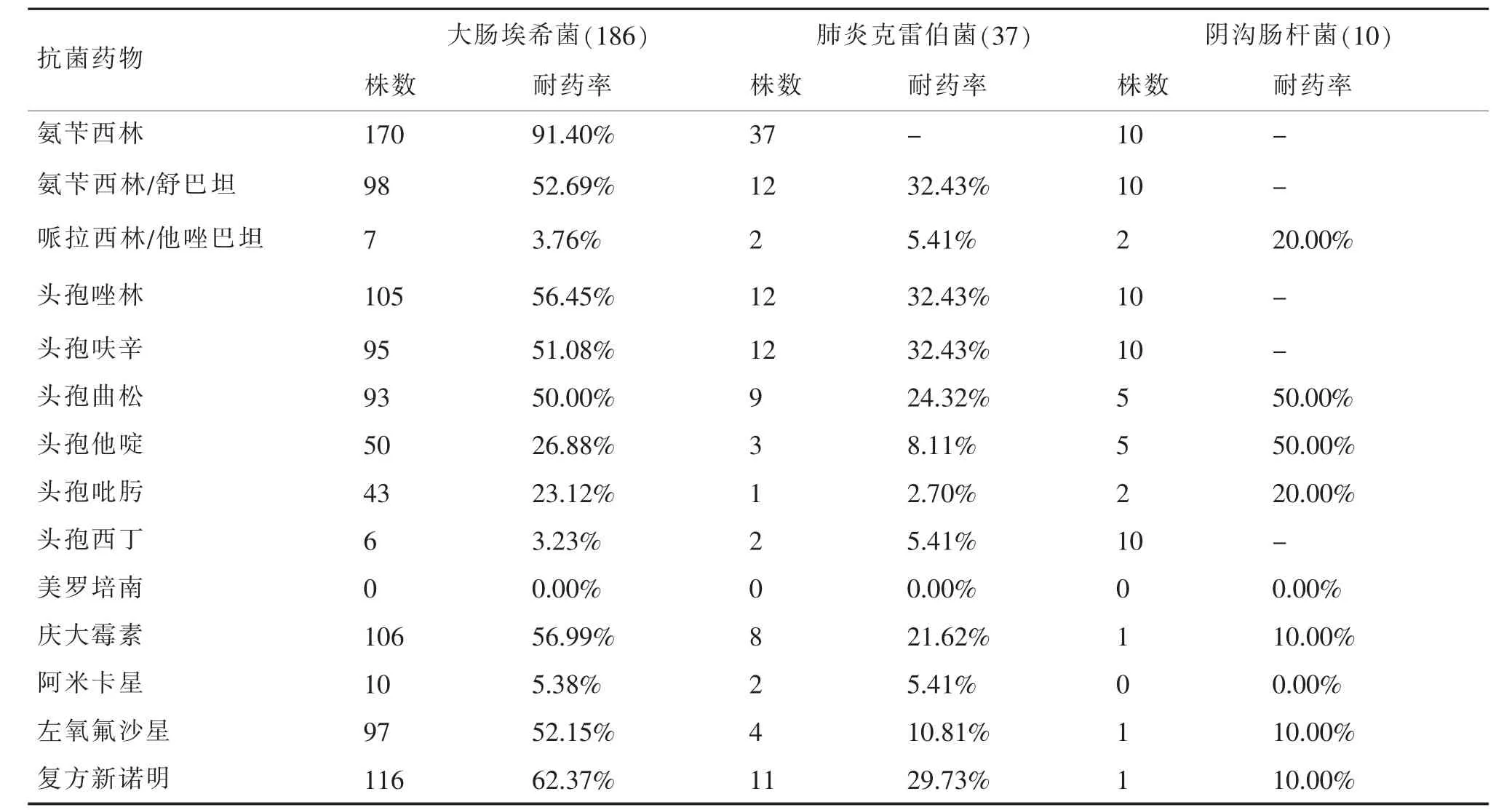
表2 主要腸桿菌科細菌對抗菌藥物的耐藥率(%)
2.3 近5年產超廣譜β內酰胺酶大腸埃希菌檢出率對比
大腸埃希菌為本地區血培養陽性菌株中分離率最高的腸桿菌科細菌,產超廣譜β內酰胺酶(ESBLs)陽性檢出率自2015年開始呈下降趨勢,見表3。

表3 近5年產超廣譜β內酰胺酶大腸埃希菌檢出率對比(%)
2.4 分離主要陽性球菌對抗菌藥物的耐藥率對比(%)
本地區近年來血培養分離的葡萄球菌對青霉素、紅霉素耐藥率較嚴重,耐甲氧西林金黃色葡萄球菌(MRSA)占35.71%,耐甲氧西林凝固酶陰性葡萄球菌(MRCNS)占33.09%,;屎腸球菌耐藥水平總體較高;未檢出對利奈唑胺、萬古霉素耐藥的革蘭陽性球菌,見表4。

表4 主要陽性球菌對抗菌藥物的耐藥率對比(%)
2.5 非發酵菌檢測
非發酵菌檢出主要以鮑曼不動桿菌(5株)、銅綠假單胞菌(4株)為主,但總體檢出率低,其中檢出美羅培南耐藥鮑曼不動桿菌1株。對頭孢他啶、頭孢吡肟、哌拉西林/他唑巴坦、慶大霉素耐藥率均小于50%。
3 討論
3.1 病原菌的菌群分布
通過將血培養陽性結果歸納分析,可以明確患者發生血流感染時的主要病原菌及其耐藥性,有利于臨床醫生能早期采取積極有效治療手段,具有重要的臨床指導價值。本次研究結果顯示,武威市涼州區住院患者2014-2018年引起血流感染的主要病原菌以腸桿菌科細菌為主,占53.13%,其中排名前三位的是大腸埃希菌、肺炎克雷伯菌、陰溝腸桿菌。其次是革蘭陽性球菌,占41.68%,分離最多的是以表皮葡萄球菌為主的凝固酶陰性葡萄球菌,占30.03%,金黃色葡萄球菌檢出率低,占3.02%,說明在本地區金黃色葡萄球菌引起血流感染的機會較小。凝固酶陰性葡萄球菌是人體皮膚、粘膜的正常菌群之一,因大多數能與人體共生,采血時皮膚消毒不嚴格容易引起污染而被微生物工作人員和臨床醫生視為非致病菌,認定培養結果假陽性。正是在這樣一種觀念的影響下,武威市涼州區凝固酶陰性的葡萄球菌檢出數量呈下降趨勢。但早在1985年Anday等人的研究[1]中就已經報到了凝固酶陰性葡萄球菌極易在新生兒中引起感染,在美國重癥加強治療病房患兒中,凝固酶陰性葡萄球菌在菌血癥中的比例可高達71%。本地區凝固酶陰性葡萄球菌重點分布科室在小兒重癥科,共分離69株,占該科室血流感染病原菌的79.31%,略高于上述報道。所以,想要更加準確的判斷凝固酶陰性葡萄球菌是否為致病菌,需在實驗室角度增加血培養次數,最好是2~3套血培養瓶,多瓶檢出同一種菌,報陽時間長短等多方因素考慮為病原菌;另一方面,加強與臨床醫生溝通,結合臨床醫生對住院患者實際情況進行綜合分析。非發酵菌占3.46%,以鮑曼不動桿菌、銅綠假單胞菌為主。同時,檢出副流感嗜血桿菌1株,表明基層醫院微生物工作人員在常規轉種陽性血培養瓶時,也需要注重苛養菌培養基的選擇,不能因為考慮成本或陽性率低而忽略對少見苛養菌的分離,延誤患者治療。檢出布魯氏菌5株,該病原菌為國家法定乙類傳染病布魯氏菌病的病原菌,采用BD血培養儀培養,培養周期一般≥3d,甚至存在培養至10d之后才能分離出布魯氏菌的標本,所以對于某些臨床遇到的可疑布魯氏菌病患者,應適當延長培養周期,提升鑒定手段,為臨床提供更加可靠的結果。
3.2 病原菌的耐藥性
主要腸桿菌科細菌藥敏統計結果顯示,大腸埃希菌對氨芐西林的耐藥率已經達到了91.40%,對1、2代頭孢菌素、頭孢曲松、慶大霉素、左氧氟沙星、復方新諾明的耐藥率均已大于50%,這可能與患者住院就診前和臨床治療初期大量使用上述藥物有關。對哌拉西林/他唑巴坦、頭孢西丁、頭孢他定、頭孢吡肟敏感性較高、美羅培南尚處于高度敏感狀態,在本地區,此類藥物均不是臨床醫生所首選。對產超廣譜β-內酰胺酶大腸埃希菌檢出率進行五年的數據對比分析,發現近年來有逐年下降的趨勢,這可能與近年來嚴格院感防控、強化床旁隔離、加強醫護人員手衛生,減少院內不同科室、不同病區攜帶耐藥基因的病原菌的交叉傳播有關。肺炎克雷伯菌、陰溝腸桿菌的藥物敏感性明顯優于大腸埃希菌,對美羅培南的敏感性也是100%,說明就目前在本地區針對腸桿菌科細菌的用藥方式不足以誘導產生更多超廣譜β-內酰胺酶的肺炎克雷伯菌和陰溝腸桿菌產生,更沒有肺炎克雷伯菌碳青霉烯酶的產生。這與陶運娟等人的研究[2]碳青霉烯類對大腸埃希菌和陰溝腸桿菌的敏感性較高,對肺炎克雷伯菌的耐藥率已達到13.30%有較大差異。說明不同地域,雖然檢出的病原菌報道大致相同,但抗菌藥物敏感性卻有一定差異,臨床醫生需要根據本地區自己的抗菌譜有效選擇藥物。
革蘭陽性球菌中,分離率最高的為凝固酶陰性的葡萄球菌,其次為金黃色葡萄球菌和屎腸球菌。三種菌對青霉素G、紅霉素均表現為高度耐藥。MRSA檢出率為35.71%,MRCNS檢出率33.09%,兩者無明顯差別。MRSA的耐藥基因是mecA,位于葡萄球菌的核染色體上,可介導mecA基因在菌株之間游離傳播,使不耐藥的葡萄球菌屬獲得耐藥性[3]。臨床血培養標本中檢出MRSA,表示對現有β內酰胺類抗微生物類藥物耐藥,但較新的抗-MRSA頭孢菌素除外,所以患者一般病情較重,治療相對困難。目前,本地區尚未發現對萬古霉素、利奈唑胺耐藥的葡萄球菌,但利奈唑胺在本地區很少使用,所以面對嚴重的葡萄球菌血流感染患者,萬古霉素仍然是首選藥物,同時萬古霉素所引起的藥物不良反應大,用藥時考慮其耳毒性和腎毒性,面對嬰幼兒檢出的MRSA,一定要結合臨床患者實際情況進行判斷分析是否為真正的致病菌。對氟喹諾酮類藥物的耐藥性,凝固酶陰性葡萄球菌比金黃色葡萄球菌高出一倍,說明前者更容易發生耐藥,這與一項關于假體關節葡萄球菌感染的研究[4]相一致。藥敏分析數據顯示屎腸球菌對常規藥物耐藥率高,可選藥物較少,判定為血流感染時選擇萬古霉素是最佳選擇。
非發酵菌主要為鮑曼不動桿菌和銅綠假單胞菌,在長期臥床、有基礎性疾病、免疫抑制劑治療患者中多見,且在本地區已經出現美羅培南耐藥菌株,因在本地區血流感染患者中檢出的非發酵菌數量較少,無法做出較為準確的統計,所以,當檢出考慮非發酵菌為病原菌時,需及時按照微生物實驗室所提供的藥敏結果,合理更換藥物。
總之,血流感染屬嚴重感染性疾病,為病死的主要原因之一,而由多重耐藥菌所致的醫院獲得性敗血癥病死率更高。因此, 早期有效的治療顯得非常重要,而細菌耐藥性監測是指導臨床合理用藥的重要依據[5-6]。血培養作為血流感染的主要檢測手段,需要臨床醫生提升認識,注重血培養標本送檢,尤其需要在經驗使用抗菌藥物之前優先送檢血培養標本,這樣才能有效提高病原菌檢出率,更加合理的根據微生物實驗室藥敏結果選擇藥物,減少耐藥菌的產生。

