考馬斯亮藍G250法測定蛋白質含量的教學實踐及方法學探討
祝連彩 唐士金 周麗
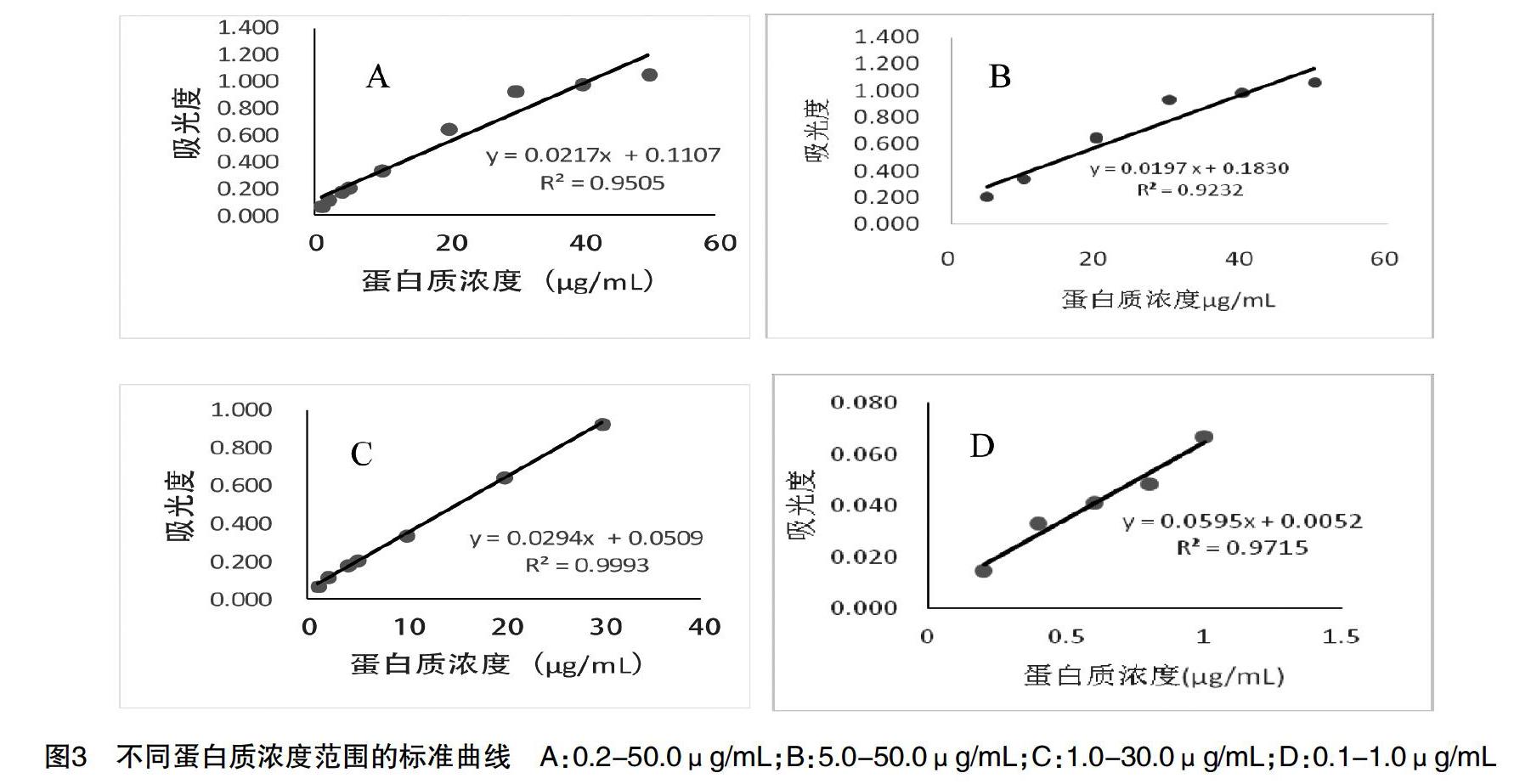
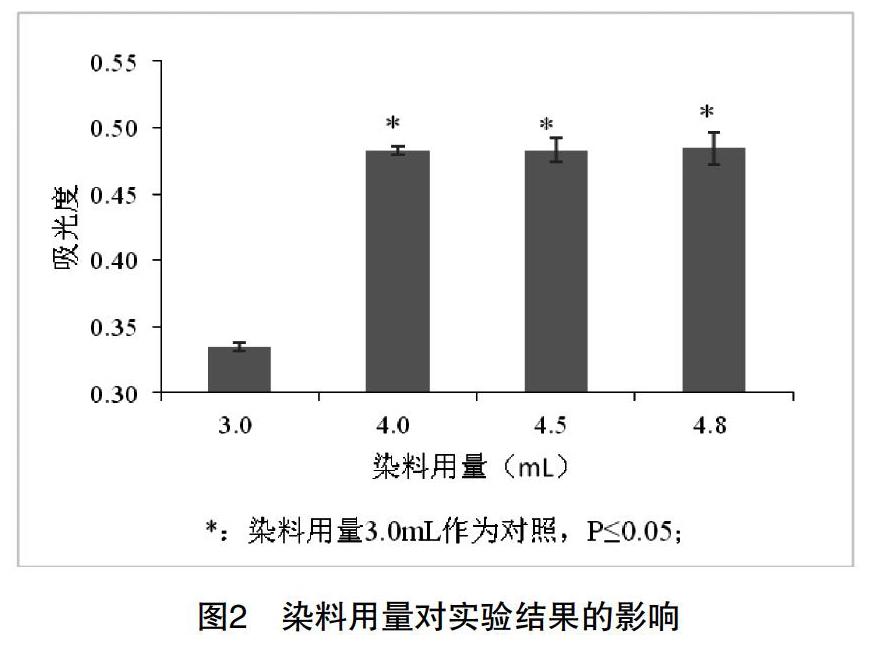
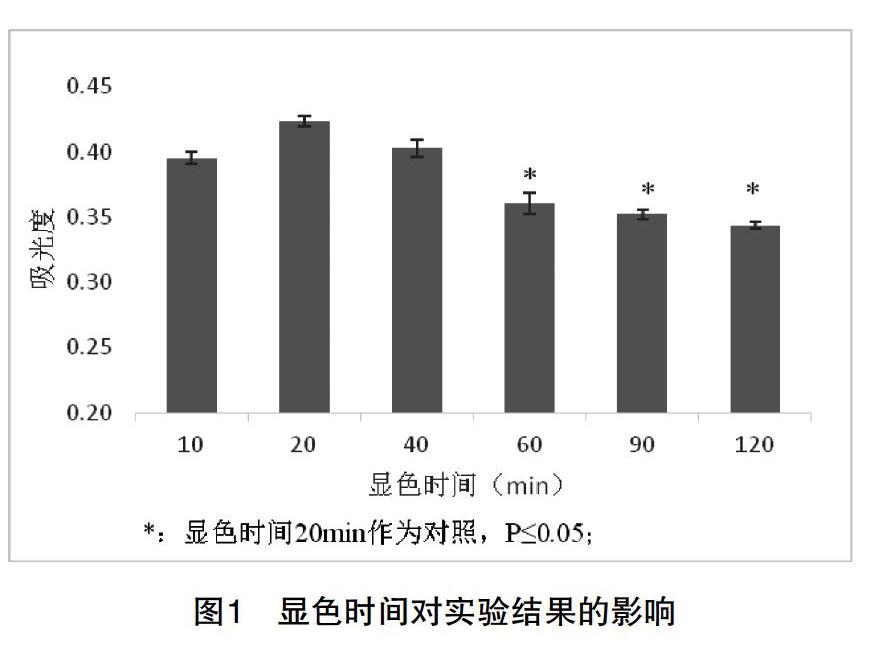
[摘 要] 該文研究之目的:考馬斯亮藍G250法測定蛋白質含量是生物化學實驗教學的基本實驗之一。為了更好地開展實驗教學,對實際教學中發現的該方法組間穩定性及線性相關性存在的問題進行研究和探討。之方法:在對問題出現原因進行解析的基礎上,對影響實驗穩定性的因素和線性范圍進行了實驗研究。之結果:發現該方法的顯色穩定時間為60min,線性范圍為1.0-30.0μg/mL。之結論:將研究成果引入實驗教學,將有利于學生對于實驗原理的理解,并消除學生對組間實驗結果差異大的疑慮,提高實驗教學效果。
[關鍵詞] 蛋白質含量;考馬斯亮藍G250;顯色穩定性;Lambert—Beer定律;線性范圍
[作者簡介] 祝連彩(1975—),女,山東費縣人,工學博士,重慶大學生物工程學院、現代實驗教學中心高級實驗師,主要從事生物化學實
驗、生物制藥工程領域教學與研究。
[中圖分類號] G642? ? [文獻標識碼] A? ? [文章編號] 1674-9324(2020)23-0266-04? ? [收稿日期] 2019-10-16
蛋白質是生命的物質基礎,是構成細胞的基本有機物,是生命活動的主要承擔者。蛋白質含量測定法,是生物科學研究中最常用、最基本的分析方法之一,也是“生物化學實驗”的重要教學內容之一。目前,常用蛋白質含量測定方法有凱氏定氮法、雙縮脲法、Folin-酚試劑法、紫外吸收法和考馬斯亮藍法(Bradford法)[1-3]。其中考馬斯亮藍法是由Bradford于1977年根據蛋白質與染料相結合的原理設計的[4]。這一方法是目前靈敏度最高的蛋白質測定法,因而得到了廣泛的應用[5-7]。考馬斯亮蘭G-250染料,在酸性溶液中通過氫鍵和范德華力與蛋白質結合,染料蛋白質復合物的最大吸收峰的波長由染料的465nm變為595nm,溶液的顏色也由棕黑色變為亮蘭色[4]。……

