熱休克蛋白HSPA2 對精子發生及其功能成熟的作用研究進展*
李 銳 曹全富 綜述 張慶華 劉 威 審校
1. 陸軍軍醫大學大坪醫院生殖醫學中心(重慶 400042)2. 陸軍軍醫大學基礎醫學院免疫學教研室(重慶 400038)
熱休克蛋白是一類非常保守的蛋白質,其主要功能是緩沖各種環境有害因素可能對細胞造成的不利影響。它們主要行使分子伴侶或伴侶輔助分子的功能,負責輔助完成細胞內蛋白質的合成、穩定、折疊、轉運和降解,以及蛋白復合體的組裝與維系。分子量70 kDa 的熱休克蛋白(heat shock protein 70,HSP70)是數量最豐富、進化最保守的熱休克蛋白家族之一,在人類基因組中至少含有13 個編碼基因[1,2]。
精子發生是從精原細胞到精子的發育過程,此過程得以正常進行,部分歸功于熱休克蛋白。精子發生完成時,精子在結構上已發育成熟,但此時尚不具備完整的生物學功能,還需進行功能轉化,其主要體現為精子結構重塑及其功能改變,這種功能轉化不僅發生于男性生殖道中(主要是附睪),還發生于精子在女性生殖道內獲能的過程中,最終產生功能成熟的精子,而此過程也與HSP 有關。本文重點講述HSPA2,這是一種在睪丸中大量表達的HSP70 家族成員,以前的名稱為HSP70.2。它的功能就是促進胞內蛋白質的折疊和運輸,以及蛋白復合體的組裝,其表達水平與體外受精能力呈正相關。本文從HSPA2 的分子特征和活性機制、HSPA2 在男性精子發生和功能成熟中的作用、 以及HSPA2 在氧化壓力下發生4- 羥基壬烯醛(4-hydroxynonenal,4HNE) 修飾等幾個方面進行綜述,以期為HSPA2 的進一步研究提供理論指導。
一、HSPA2 的分子特征和活性機制
HSP70 家族成員具有一個共同的、 高度保守的模塊化結構,包括一個N 端的核苷酸結合結構域(nucleotide binding domain,NBD),也稱ATP 酶結構域,一個位于中心的連接區域,以及位于C 端內的底物結合結構域(substrate-binding domain,SBD)。與所有HSP70一樣,HSPA2 內的NBD 和SBD 通過一段保守的疏水序列連接(圖1A)。在結構上,NBD 包括兩個亞結構域,核苷酸即結合于兩者之間的縫隙中。該結構域與ATP有很強的親和力,一旦結合,就可以通過水解ATP 所提供的能量來驅動其構象改變(圖1B)。SBD 由一個β 夾心子域SBD-(β)和一個α 螺旋蓋區SBD-(α)組成。(圖1A)。SBD 是結合底物的關鍵區域,其能夠與5-7 個疏水氨基酸所組成的肽段相結合。
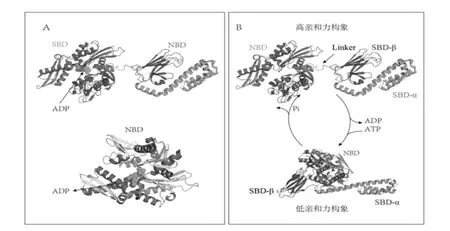
圖1 HSPA2 的結構和反應周期
HSPA2 依賴NBD 的ATP 酶活性來調節底物的結合和釋放。當ATP 與NBD 結合時,HSP70 的構象呈現“開放狀態”,表現出低底物親和力(圖1B 下),此構象可穩定新生或變性蛋白,防止這些未折疊多肽的聚集。當ATP水解成ADP 時,會形成“封閉狀態”的高親和力構象(圖1B 上),此構象可引發蛋白質折疊(與伴侶輔助分子一起),多聚體復合物的形成,以及目標蛋白跨膜轉運。整個反應周期在HSP70 家族的大多數成員中以類似方式進行。
二、HSPA2 在男性精子發生中的作用
基于小鼠的研究發現,HSPA2 最早出現于生精細胞第一次減數分裂早期(細線期-偶線期)。被選擇性敲除hspa2 基因的雄性小鼠其生精細胞在第一次減數分裂的G2-M 階段受阻,在粗線期經凋亡被清除,最終引發不育。目前認為HSPA2 在小鼠生精細胞中有兩個主要功能,第一HSPA2 似乎促進細胞周期蛋白依賴性激酶2 與細胞周期調控蛋白B1 之間的相互作用,第二其作為聯會復合體的“調節器”在同源染色體之間介導染色體配對、聯會和減數分裂重組事件。除了支持減數分裂外,HSPA2 還在減數分裂后輔助過渡蛋白完成特定的功能[3]。一項基于大鼠的研究表明,在精子頂體形成過程中胞質中的HSPA2 被募集到高爾基體中[4],但其功能尚不明確,有待進一步研究。
HSPA2 在人類精子發生過程中似乎以雙相模式進行表達。該蛋白第一次表達始于精母細胞,推測其支持減數分裂。盡管沒有足夠證據支持人類HSPA2 如小鼠研究中所報道的即在調節聯會復合體或輔助細胞周期蛋白- 周期蛋白依賴性激酶復合體的過程中發揮類似作用,但大量數據顯示HSPA2 在睪丸中的表達水平與射精精子濃度之間存在著很強的相關性。據報道,在患有少精子癥、 精母細胞發育停滯或唯支持細胞綜合征所導致的完全非梗阻性無精子癥 (即射精時沒有可檢測的精子)的不育患者中,HSPA2 表達水平顯著降低[5]。此外,人類和小鼠HSPA2 同源物的氨基酸序列保守程度超過98%,有研究指出HSPA2 在精子發生方面很可能具有保守的功能。其第二次表達在長形精子細胞形成過程中開始[6],既往研究表明HSPA2 在此階段參與細胞質擠壓和質膜重構[7,8],HSPA2 表達水平下降會導致精子細胞質保留過多[7]。
總之,HSPA2 可以依賴其分子伴侶活性在精子發生的不同階段發揮特定功能,是精子發生得以正常進行的必要因素。
三、HSPA2 在男性精子成熟中的作用
大量研究表明HSPA2 對精子的功能轉化 (成熟)至關重要,一個直接證據是,HSPA2 被發現定位于人類成熟精子頂體表面,這一位置與精卵相互識別、相互作用的位置一致[9]。另有研究指出,弱精子癥患者精子中HSPA2 表達水平升高[10],精漿中游離的HSPA2 也與正常人群存在顯著差異,并且與精子活力呈負相關[11]。目前認為HSPA2 可促進并維系精子表面卵透明帶(zona pellucida,ZP)識別復合物(也稱ZP 受體)的組裝、重定位和暴露[9,12,13]。
在正常精子中HSPA2 與一些蛋白多聚體存在穩定的相互作用[9,14-16],目前已發現人類精子蛋白質組中有幾個潛在的HSPA2 結合底物[9,14,15],其中研究最深入的是精子粘附分子1 (sperm adhesion molecule 1,SPAM1)和芳香基硫酸酯酶A(arylsulfatase A,ARSA)。HSPA2 與SPAM1 和ARSA組成的復合物似乎經歷了一個與精子獲能相關的結構重塑過程。ARSA 發生重定位而易于被精子細胞膜表面抗體所標記,與之相反SPAM1 重定位后在精子細胞膜表面含量下降。ARSA與SPAM1 的這種結構重塑還與精子在獲能晚期失去結合透明質酸的能力相一致[17]。值得注意的是,重定位后ARSA 所在位置正好與卵透明帶相互作用相適應,而SPAM1 主要在精卵識別之前參與精子穿越卵丘基質的過程[9]。HSPA2 也能與血管緊張素轉換酶(angiotensin converting enzyme,ACE) 和蛋白二硫鍵異構酶A6 (protein disulphide isomerase A6 ,PDIA6)形成穩定復合物[15]。只有當精子處于獲能狀態時,PDIA6 才能在精子表面被標記,而ACE 卻無法被標記。另一方面,通過藥物抑制ACE 后,精子誘發頂體反應的能力顯著降低,說明HSPA2 所介導的PDIA6-ACE 復合物對于受精能力極其重要[15]。最近研究發現,HSPA2 與伴侶輔助蛋白(BCL2-associated athanogene 6,BAG6)及解整合素樣金屬蛋白酶 (A Disintegrin And Metalloproteinase Domain 30,ADAM30)也可形成穩定的復合物,該復合物位于精子頭部頂端區域。推測BAG6 對于由HSPA2所介導的精子ZP 受體復合物的裝配有所幫助,可防止發生蛋白質錯誤折疊或錯誤定位。在因精卵結合障礙而導致不育的患者中,不僅HSPA2 表達水平下降,BAG6 的蛋白表達也嚴重降低[14]。
盡管當前精子表面發生結構重塑的分子機制還知之甚少,但已發現HSPA2 復合體似乎與膜筏的結構標記物共定位,而膜筏是精子頭部獲能過程中重定位的微區(microdomain)[12]。研究顯示,由精子獲能驅動的HSPA2 翻譯后修飾對于這種結構重塑至關重要,成熟精子經過廣譜酪氨酸激酶抑制之后,與HSPA2 相關的重定位將不再發生[13]。另有研究報導,成熟精子暴露于氧化應激環境也會破壞HSPA2 所介導的精子表面結構重塑[18]。
此外,HSPA2 表達水平下降可導致不成熟精子產生[19],主要表現為精子在受精過程中結合ZP 的能力明顯降低,最終導致受精失敗[8,19]。最近一項比較蛋白質組學研究也證實,在精卵識別障礙的不育患者精子中,HSPA2 表達水平明顯不足[9]。盡管此項研究未能將HSPA2 缺陷與精子活力或形態方面的缺陷聯系起來,但這一證據顯示HSPA2 對精子發生完成后的功能成熟極其重要[20]。
總之,這些實驗結果表明HSPA2 很可能通過與多種ZP 受體關鍵蛋白分子形成復合物,穩定它們在精子表面的取向與定位,從而在精子獲能、精卵識別、及精子穿越卵丘基質與透明帶等過程中發揮關鍵作用。
四、 HSPA2 功能障礙與4- 羥基壬烯醛(4HNE)修飾
一個值得關注的問題是,部分男性不育患者精子中HSPA2 的功能障礙是如何發生的? 盡管與此相關的研究有很多,但目前主流的研究模型集中在氧化應激的影響上。氧化應激可通過誘導脂質過氧化級聯反應,形成一系列小分子量的醛類化合物,4- 羥基壬烯醛(4-hydroxynonenal,4HNE)是其中常見的一種。研究表明,4HNE 所造成的HSPA2 化學修飾可能損害其分子伴侶活性,并進一步造成精子質膜重構異常[18]。此外,這種修飾不僅會影響HSPA2/SPAM1/ARSA 受體復合物的組裝與維系,也會影響上述HSPA2/PDIA6/ACE 復合物[15,18]。另有研究表明,4HNE 加合會優先靶向半胱氨酸、賴氨酸和組氨酸殘基,從而引發一系列結構和功能變化,包括底物識別能力的喪失或重折疊能力的喪失[21-25]。已有明確生化實驗證實,4HNE 可以共價修飾HSPA2 分子NBD 內的Cys267 殘基[26],從而減弱HSPA2的ATP 酶活性,并阻止其在蛋白質運輸和重折疊事件中發揮作用[26,27]。共價修飾的HSPA2 很可能通過蛋白酶體途徑降解[28],此外,4HNE 還可能通過增強細胞蛋白酶體活性而加速細胞內蛋白質的水解[29]。但有爭議的是,較高濃度的4HNE 可以極大促使蛋白質交聯,從而導致蛋白酶體失活[30,31]。另有報道稱,4HNE 修飾可經溶酶體途徑介導蛋白降解[32]。總之,基于這些實驗數據可以推測患病群體精子發育過程中HSPA2 水平下降很可能與4HNE 修飾所致的蛋白質降解有關。此外,在BAG6 缺失的轉基因小鼠睪丸中,HSPA2 的保護性伴侶分子BAG6 被敲除后,HSPA2 蛋白水解速度也隨之加快[33],這可以作為上述推測的一個佐證。
五、總結
HSPA2 表達水平、 結構完整性與功能狀態直接關系到精子發生、成熟、獲能及精卵識別等過程,從而決定最終能否成功受精。從此意義來說,HSPA2 很有可能成為臨床上評判男性生育力的生物標志物。然而,目前關于HSPA2 的表達調控、作用機制與環境壓力下活性喪失的研究還很不充分。綜合已有研究成果來看,HSPA2 可在兩個階段發揮重要作用,一是精子發生過程中維系減數分裂復合物,二是精子功能轉化(成熟)過程中促進精子頂體表面ZP 受體復合物的組裝、定位與穩定,從而保證精卵的正確識別。與此相應,HSPA2的表達也經歷了兩次高潮。另一方面,環境因素如氧化壓力既可通過影響DNA 甲基化而造成HSPA2 的轉錄抑制,從而造成HSPA2 表達水平下降,也可通過共價修飾造成HSPA2 三維結構改變,進而導致其活性喪失。但目前為止還有很多問題尚不明確,解決這些問題將對不育癥的診斷、治療和預防具有重要意義。

