MRSA耐藥性檢測及SCCmec基因分型分析
屠雷鈞 葉永志 林 婭 邊保華
自1961年英國學者Jevons首先發現了耐甲氧西林金黃色葡萄球菌(MRSA),隨后在世界各國陸續發現,已成為醫院內感染的重要病原菌之一[1-3]。2012年中國醫院細菌監測網監測結果顯示,在我國MRSA感染在SA中所占比例達47.9%[4]。MRSA具有致病力強、傳播速度快、耐藥性強、耐藥譜廣的特點,對人類健康構成嚴重威脅,其造成的感染與乙型肝炎、艾滋病并列成為世界三大難解決的感染性疾病之一[5]。MRSA的耐藥主要是因為葡萄球菌染色體mec基因盒(CSSmec)中攜帶甲氧西林耐藥決定子A(mecA)。且SCCmec型別較多,不同地區MRSA的SCCmec流行型別不同,其耐藥特性也有所不同。為了解本院住院患者MRSA感染、SCCmec流行型別及耐藥特征,將臨床住院患者各類標本中分離的金黃色葡萄球菌(SA)作MRSA檢測、基因分型及耐藥性分析,報道如下。
1 材料與方法
1.1 菌株來源 157株SA為臺州市中西醫結合醫院2018年1月至12月住院患者痰液、膿汁、血液、尿液等各種標本分離所得,排除同一部位重復的菌株。
1.2 質控菌株 金黃色葡萄球菌ATCC43300(MRSA菌株)、金黃色葡萄球菌ATCC25923(MSSA菌株)均購自中國菌種保藏中心。
1.3 主要試劑與儀器 血平板、MH平板、5%羊血哥倫比亞瓊脂平板、MH肉湯等均為杭州天和微生物試劑公司產品;各種藥敏紙片均為英國Oxoid產品;細菌基因組提取試劑盒為上海生工生物工程(股份)有限公司產品;VITEK-2Compact全自動微生物分析儀和革蘭陽性細菌鑒定片為法國梅里埃公司產品;PCR擴增儀BIO-RAD S1000 Thermal cycle、凝膠電泳儀和成像系統均為美國BIO-RAD公司產品。
1.4 方法 (1)SA的培養與鑒定:以《全國臨床檢驗操作規程》為標準進行分離培養[6],并經法國梅里埃VITEK-2Compact型全自動細菌分析儀進行鑒定。(2)MRSA表型檢測:采用頭孢西丁瓊脂擴散法,操作方法及結果判斷按美國臨床實驗室標準化委員會(CLSI)推薦的標準[7]。以金黃色葡萄球菌ATCC25923和金黃色葡萄球菌ATCC43300作質控。(3)MRSA基因檢測:①MRSA基因組DNA提取:采用上海生工生物工程(股份)有限公司生產的細菌基因組提取試劑盒提取細菌DNA。嚴格按試劑盒說明書操作。提取液質量的檢測用1%瓊脂糖凝膠電泳鑒定。②mecA及SCCmec基因分型檢測:引物設計:mecA及SCCmec基因擴增引物委托上海生工生物工程(股份)有限公司合成。見表1和表2。聚合酶鏈反應(PCR)擴增體系及條件:PCR擴增總體系均為50μl:dNTPs混合液(2.5mmol/L)4μl,10× 緩沖液 5μl,上下游引物(25μmmol/L)各1μl,Taq酶0.5μl,鎂離子0.5μl,DNA模板1μl,雙蒸餾水補足至50μl。擴增條件:94℃預變性2min,94℃變性 60s,55℃退火 60s,72℃延伸 60s,循環35個周期,最后72℃延長至10min。取PCR產物5 μl在1.5%瓊脂糖凝膠電泳,EB染色紫外燈下成像,觀察分析結果。

表1 PCR擴增mecA基因引物序列

表2 PCR擴增SCCmec基因引物序列
1.5 基因測序及分析 將PCR產物送上海生工生物工程(股份)有限公司純化測序。測序結果經Gen Bank序列數據庫中采用BLAST程序進行核苷酸序列比對,確定基因型。
1.6 藥敏試驗 采用K-B紙片擴散法,以CLSI標準進行操作和結果判斷[7],采用金黃色葡萄球菌ATCC25923和金黃色葡萄球菌ATCC43300作質控菌株。
2 結果
2.1 MRSA菌株表型檢測結果 157株分離自臨床各類標本的SA經表型檢測有76株陽性,初篩陽性率為48.41%。
2.2 MRSA菌株基因檢測及SCCmec分型結果 76初篩陽性的菌株,再經PCR檢測mesA基因,電泳結果在147bp處有73株出現DNA陽性條帶,MRSA確證試驗陽性率為46.50%。PCR電泳結果見圖1。73株確證為MRSA菌株經PCR檢測SCCmec基因型,結果在280bp處出現41條DNA陽性條帶,在398bp處出現27條DNA陽性條帶,在200bp處出現2條DNA陽性條帶,尚有3株無法分型。PCR電泳結果見圖2。
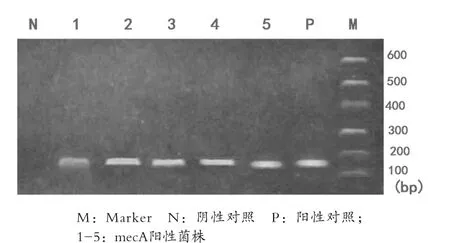
圖1 mecA基因PCR擴增電泳圖
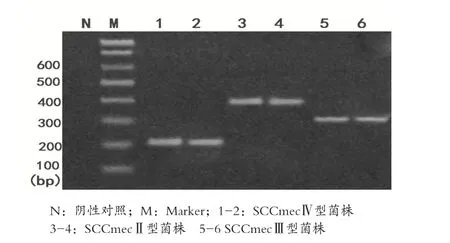
圖2 SCCmec分型PCR基因擴增電泳圖
2.3 基因序列測序結果 PCR陽性產物經純化測序,并與Gen Bank序列數據庫提供的SCCmec序列比對,結果確定200bp處陽性條帶為SCCmecⅣ型,280bp處為SCCmec型,398bp處為SCCmecⅡ型。
2.4 藥敏試驗結果 SCCmecⅡ型與Ⅲ型對萬古霉素、替考拉寧具有極高敏感性,相反對β-內酰胺類抗菌藥物100%耐藥,對其他常用抗菌藥物也有較高耐藥性,但SCCmecⅡ菌株耐藥率顯著低于SCCmecⅢ菌株,差異有統計學意義(P<0.05)。見表2。
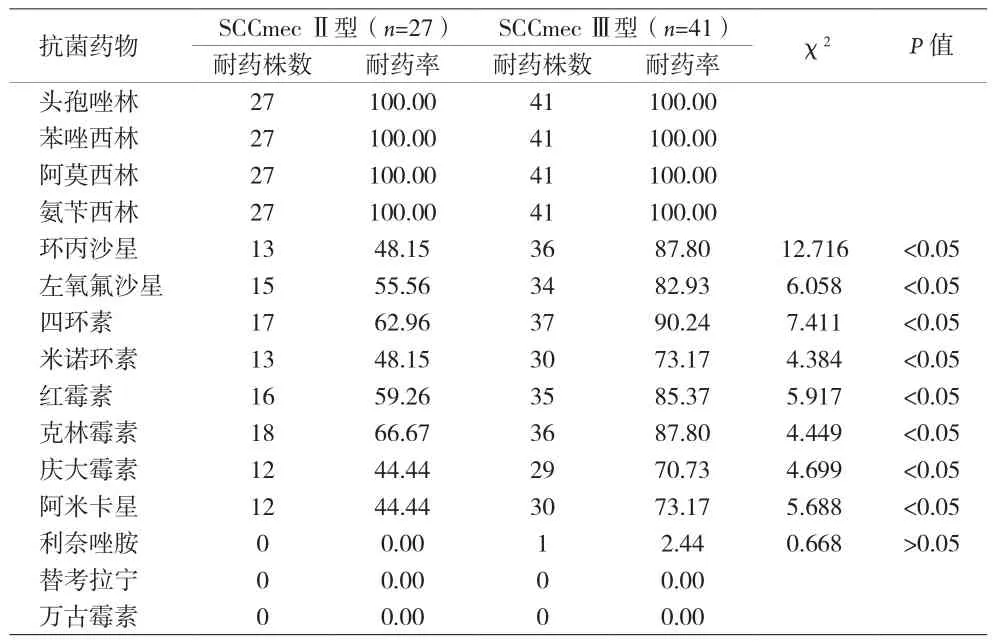
表2 主要MRSA菌株不同SCCmec基因型的耐藥結果(%)
3 討論
MRSA具有較強的致病力,且具有多重耐藥性的特點,備受臨床醫師高度關注。本資料結果顯示,MRSA表型檢測有76株陽性,初篩陽性率48.41%。由于MRSA產生的耐藥是因MRSA獲得mesA基因,mecA基因能編碼產生新的青霉素結合蛋白2a(PBP2a),造成對β-內酰胺類藥物耐藥,CLSI明確指出一旦在金黃色葡萄球菌中檢測到mecA基因,即可認定MRSA[8]。據此,采用PCR技術將76株表型陽性菌株經mecA特異性檢測,結果有73株PCR反應擴增到147bpDNA片段,MRSA確證陽性率為46.50%,該結果與2012年中國細菌耐藥性監測網所監測的全國MRSA平均檢出率47.9%基本相一致[5],高于應建飛報道的37.28%[9],表型與基因型檢測符合率為96.05%。另3株表型檢測雖然陽性,能表達β-內酰胺酶,但菌株未攜帶mecA基因,其原因據學者報道認為一旦SA細胞壁增厚變粗也能導致表型陽性而對β-內酰胺類藥物耐藥[10]。
SCCmec是一個能移動的遺傳基因元件,由mecA等多種基因構成,還攜帶有多種質粒和轉座子,編碼除對β-內酰胺類藥物耐藥外,還能編碼產生對多種抗菌藥物耐藥。依據SCCmec盒上基因復合體的組成不同,SCCmec有多種型別,SCCmecⅠ、Ⅱ、Ⅲ型主要見于醫院感染獲得性MRSA(HA-MRSA),SCCmecⅣ、Ⅴ型主要見于社區獲得性MRSA(CAMRSA)。這幾年又陸續發現其他新的型別SCCmec。SCCmecⅠ型是最早發現,所帶耐藥基因少,大多數對非β-內酰胺類藥物敏感。SCCmecⅡ、Ⅲ型含耐藥基因比Ⅰ型要多,且多種耐藥基因整合在一起,表現為對多種抗菌藥物耐藥。相對SCCmecⅢ型要比Ⅱ型攜帶耐藥基因更多,故其耐藥性更強更廣些。SCCmecⅣ、Ⅴ型分子較小,且基因較穩定,僅攜帶mecA基因,不帶有其他耐藥基因[11],因此,對非β-內酰胺抗生素大多敏感。不同型別SCCmec在不同國家和不同地區流行也不相同,亞洲地區MRSA流行型別以SCCmecⅡ型為主,在我國南北地區流行菌株的基因型也有差異,北方對SCCmecⅡ型為主,而南方則以SCCmecⅢ型為主[12]。本資料結果顯示,本組MRSA流行菌株主要是SCCmecⅢ型,由于SCCmecⅢ型攜帶有更多的耐藥基因整合在一起,還可通過質粒等途徑在葡萄球菌間傳播而造成多重耐藥,應引起臨床醫師高度關注。
SCCmecⅡ型與Ⅲ型對萬古霉素、替考拉寧具有極高敏感性,未見耐藥菌株,對β-內酰胺類藥物100%耐藥,對其他抗菌藥物也有較高耐藥性,但SCCmecⅡ型菌株對氨基糖苷類、大環內酯類、喹諾酮類、四環素類和林可霉素類的耐藥性顯著低于SCCmecⅢ型菌株。表明SCCmecⅢ型菌株比Ⅱ型菌株攜帶有更多的耐藥基因整合在一起,且mecA基因與其耐藥基因緊密相鄰而連鎖,造成更為嚴重耐藥。利奈唑胺對MRSA具有很高敏感性,極少見到耐藥報道,但在本資料中尚有1株SCCmecⅢ型菌株產生耐藥,據報道可能與23S核糖體RNA 突變或cfr基因介導的2503位腺嘌呤甲基化有關[13],有待今后工作中進一步加以研究。
了解MRSA在臨床感染率及SCCmec基因型在當地的流行情況,對防控MRSA菌株在院內流行及耐藥性分析具有重要意義。

