促紅細胞生成素在視網膜新生血管形成中的作用
江海波,鄧婭青,熊思齊*
(1.中南大學湘雅醫院眼科中心,湖南 長沙 410008; 2.眼科學湖南省重點實驗室,湖南 長沙 410008)
視網膜新生血管作為糖尿病視網膜病變、視網膜靜脈阻塞、早產兒視網膜病變和視網膜血管炎等疾病的共同病理過程,受到眾多促血管生成因子的調節。促紅細胞生成素(erythropoietin,EPO)的主要生物學功能是刺激幼紅細胞前體的分化和增殖,刺激網織紅細胞釋放進入血液循環,并刺激細胞內蛋白質合成而起到調節紅細胞生成的作用。同時,EPO作為血管內皮細胞的分裂原與血管內皮細胞生長因子(Vascular Endothelial Growth Factor,VEGF)具有相當的促血管生成潛力。EFO被證實參與了女性生殖器官血管形成[1]、炎癥性血管形成[2]、傷口愈合過程中血管新生[3]及腫瘤新生血管形成[4]。因此,本研究擬以氧誘導的大鼠增殖性視網膜病變(OIR)為模型,揭示EPO的表達與視網膜新生血管形成的對應關系。
1 材料與方法
1.1 實驗材料
清潔級C57BL/6J小鼠(中國科學院上海實驗動物中心);Trizol裂解液及微量總RNA提取試劑盒(美國Invitrogen公司);反轉錄及cDNA合成試劑盒(美國Fermentas Life Science公司);山羊抗鼠EPO多克隆抗體(美國Santa Cruz公司);羊抗鼠β-actin單克隆抗體(美國Sigma公司);BCA Protein Assay Reagen Kit(美國Pierce公司);ECL試劑盒(美國Pierce公司)
1.2 實驗方法
1.2.1 小鼠視網膜新生血管動物模型的建立 采用Smith等的方法建立氧誘導增殖性視網膜病變模型[5]。將鼠齡為出生后7天(P7)的C57BL/6J小鼠連同母鼠及測氧儀一起放入密閉的氧艙中,保持氧艙中的壓力為常壓(每天2~3次),控制氧濃度為75%±2%,溫度23±2 ℃,每隔2天替換母鼠。室內采用日光燈照明,光照周期為12 h/12 h。5天(P12)后將小鼠放回到正常環境中繼續飼養。
1.2.2 OIR模型鼠的鑒定 過量麻醉處死出生后第17天的正常組小鼠(5只)及模型鼠(5只),摘除眼球并4%多聚甲醛固定過夜。顯微鏡下沿角膜緣剪除角膜,去除晶狀體和虹膜組織后,取出視網膜組織,采用內皮細胞特異性標記物isolectin4(IB4)-Alexa594抗體4度孵育過夜,PBS洗滌后,視網膜鋪片,熒光顯微鏡下拍照觀察視網膜組織的血管結構。
1.2.3 RT-PCR測定EPO mRNA的表達 采用Trizol一步法提取出氧艙后(P12)0天、出氧艙后半天(P12.5)、1天(P13)、一天半(P13.5)、2天(P14)、5天(P17)、1周(P19)及2周(P26)等8個時間點模型小鼠的視網膜總蛋白(每個時間點4只小鼠),提取總RNA并逆轉錄成cDNA,PCR儀擴增目的基因。EPO引物序列:上游-5′TGGAGGTGGAAGAACAGG3′;下游5′GCAGTGAAGTGAGGCTA CG 3′,PCR產物大小為165 bp。β-actin引物序列:5′CTGGGACGACATGGAGAAGA 3′;下游5′AAGGAAGGCTGGAAAAGAGC 3′ PCR產物大小為564 bp。PCR反應條件:94 ℃預變性5 min,94 ℃變性1 min,55 ℃退火1 min,72 ℃延伸1 min,共進行30個循環,72 ℃再延伸10 min。所有標本檢測均重復3次。PCR擴增產物用1.5%瓊脂糖凝膠電泳,電壓為100 V,通電時間為20~30 min。采用Eagle eyeⅡ圖像分析儀對電泳條帶進行灰度值分析。結果以EPO與內參照β-actin mRNA擴增產物的灰度相對比值表示。
1.2.4 Western blot測定EPO蛋白質的表達 提取P12、P12.5、P13、P13.5、P14、P17、P19及P26模型鼠視網膜組織(每個時間點4只小鼠),視網膜組織研磨后加入蛋白抽提液裂解,離心提取蛋白后測定蛋白質濃度。取蛋白樣品于SDS-PAGE凝膠中電泳,待目的蛋白接近凝膠底部時停止電泳,120V恒壓電轉移至PVDF濾膜上,5%脫脂奶粉室溫封閉1 h,加入一抗羊抗鼠EPO抗體和羊抗鼠β-actin抗體,4 ℃過夜。再加入二抗(生物素化的兔抗羊IgG),室溫孵育2 h,加入辣根過氧化物酶標記的兔抗羊IgG室溫孵育30 min后,ECL化學發光法檢測,以β-actin作為內對照。
1.3 統計學分析
采用SPSS 11.0軟件包對數據進行統計分析。多組間比較采用ANOVA方差分析,兩組間的比較采用LSD-t檢驗,以P<0.05認為差異具有統計學意義。
2 結 果
2.1 熒光造影視網膜鋪片觀察視網膜血管形態
正常P17小鼠視網膜鋪片可見整個視網膜血管分布呈均勻的網狀結構,視盤中央發出的血管規則地呈放射狀向周邊部走行,視網膜血管間的毛細血管交織成網狀(圖1A)。模型組小鼠視盤周圍毛細血管閉塞,可見大片無灌注區。視網膜大血管不規則擴張,走行紆曲。中周部正常毛細血管網消失,血管密度增高且分布紊亂,可見新生血管叢和熒光滲漏(圖1B)。
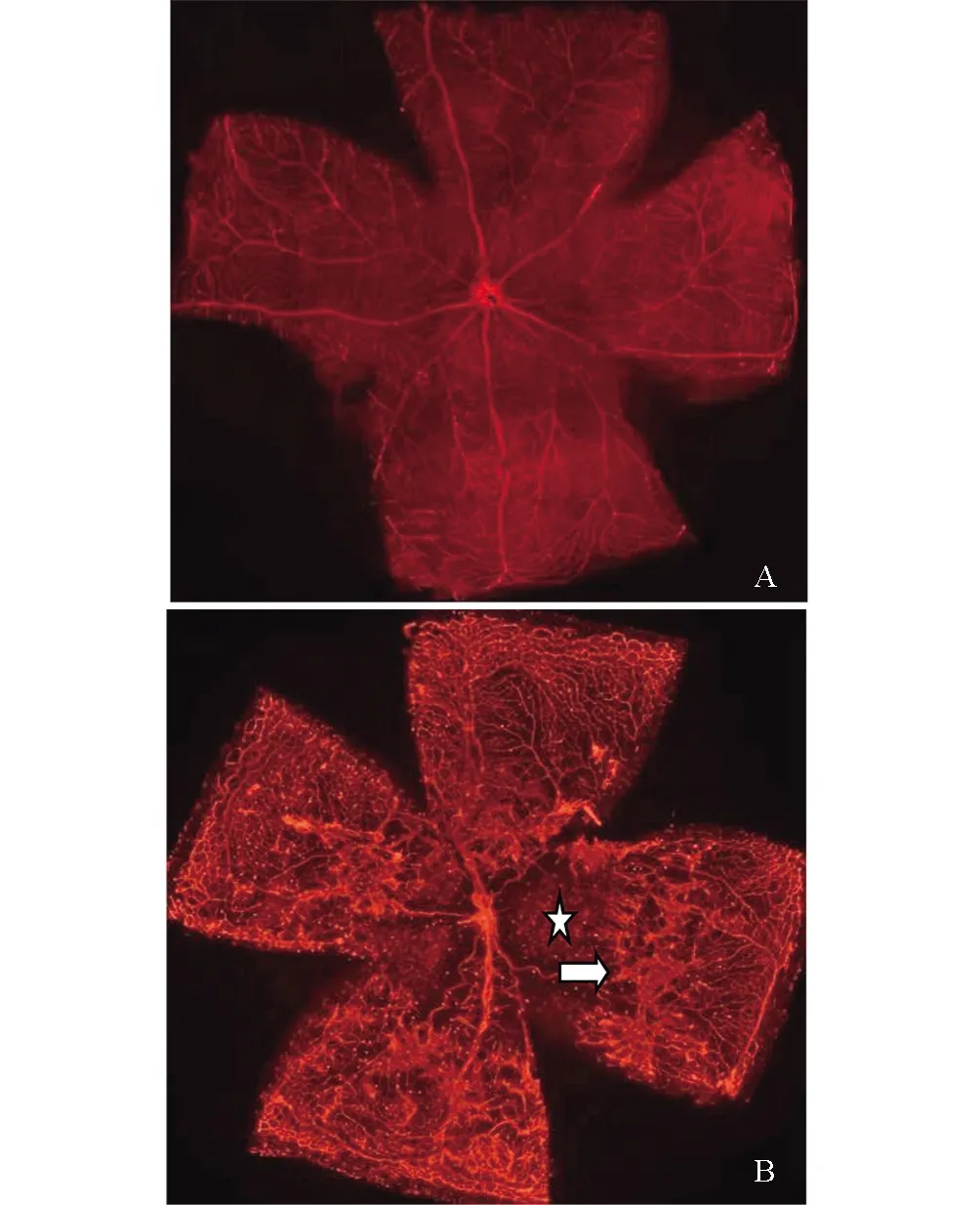
圖1 OIR模型鼠視網膜鋪片A:正常鼠視網膜血管分布呈均勻的網狀結構;B:模型鼠視網膜中央區可見大片無灌注區(☆所示),大血管迂曲擴張,視網膜中周邊部有大量新生血管(箭頭所示)
2.2 視網膜組織中EPO mRNA表達的動態變化
為了探討OIR模型鼠視網膜新生血管發生過程中,EPO mRNA表達變化的動態趨勢。我們選取出氧艙后0天(P12)、半天(P12.5)、1天(P13)、一天半(P13.5)、2天(P14)、5天(P17,此時視網膜新生血管形成數目最多)、1周(P19)及2周(P26,此時視網膜新生血管已完全消退)等8個時間點的視網膜組織,采用RT-PCR技術來檢測OIR模型鼠視網膜組織中EPO mRNA的表達水平。視網膜組織中EPO mRNA表達水平如圖2A所示:EPO mRNA擴增產物大小為165bp,β-actin擴增產物大小564bp。圖2B為圖3A相對應的電泳條帶中EPO與內參照β-actin mRNA擴增產物的灰度相對比值。結果表明:出氧艙后半天(P12.5)視網膜組織中EPO mRNA表達開始升高。隨著視網膜組織中缺血、缺氧的加重,出氧艙后2天(P14)視網膜組織中EPO mRNA表達到達高峰,與P12天模型鼠視網膜組織中EPO mRNA表達水平比較有統計學差異(P<0.05)。出氧艙后5天的模型鼠,此時視網膜新生血管形成數目最多,視網膜組織EPO mRNA表達仍維持在較高水平,但較P14天時EPO mRNA表達水平已有所下降。出氧艙后2周的模型鼠視網膜新生血管已完全消退,此時網膜組織EPO mRNA表達明顯下調,與P12天EPO mRNA表達水平比較無統計學差異(P>0.05)。

圖2 OIR模型鼠視網膜新生血管形成中EPO mRNA的表達A:RT-PCR法檢測不同時間點OIR模型鼠視網膜組織中EPO mRNA表達電泳圖;B:各泳道EPO與內參照β-actin mRNA擴增產物的灰度相對比值,與P12模型鼠視網膜組織中EPO mRNA表達水平比較,*P<0.05
2.3 OIR模型鼠視網膜組織中EPO蛋白質表達的動態變化
為探討OIR模型鼠視網膜新生血管形成中EPO蛋白質表達變化的動態趨勢,我們取P12、P12.5、P13、P13.5、P14、P17、P19及P26天的OIR模型鼠視網膜組織,運用Western blot技術來檢測模型鼠視網膜組織中EPO蛋白質的表達水平(如圖3)。圖3B為圖3A相對應的電泳條帶中EPO與內參照β-actin蛋白條帶的灰度相對比值。與視網膜組織中EPO mRNA表達變化趨勢相一致,隨著模型鼠視網膜組織中缺血、缺氧狀態的出現,視網膜組織中EPO蛋白表達于出氧艙后半天(P12.5)開始升高,于出氧艙后2天(P14)視網膜組織中EPO蛋白表達到達高峰,與P12天模型鼠視網膜組織中EPO蛋白表達水平比較有統計學差異(P<0.05)。然后緩慢開始下降,出氧艙后2周時視網膜組織中EPO蛋白表達水平已明顯下調,與P12天模型鼠視網膜組織中EPO蛋白表達水平比較無統計學差異(P>0.05)。
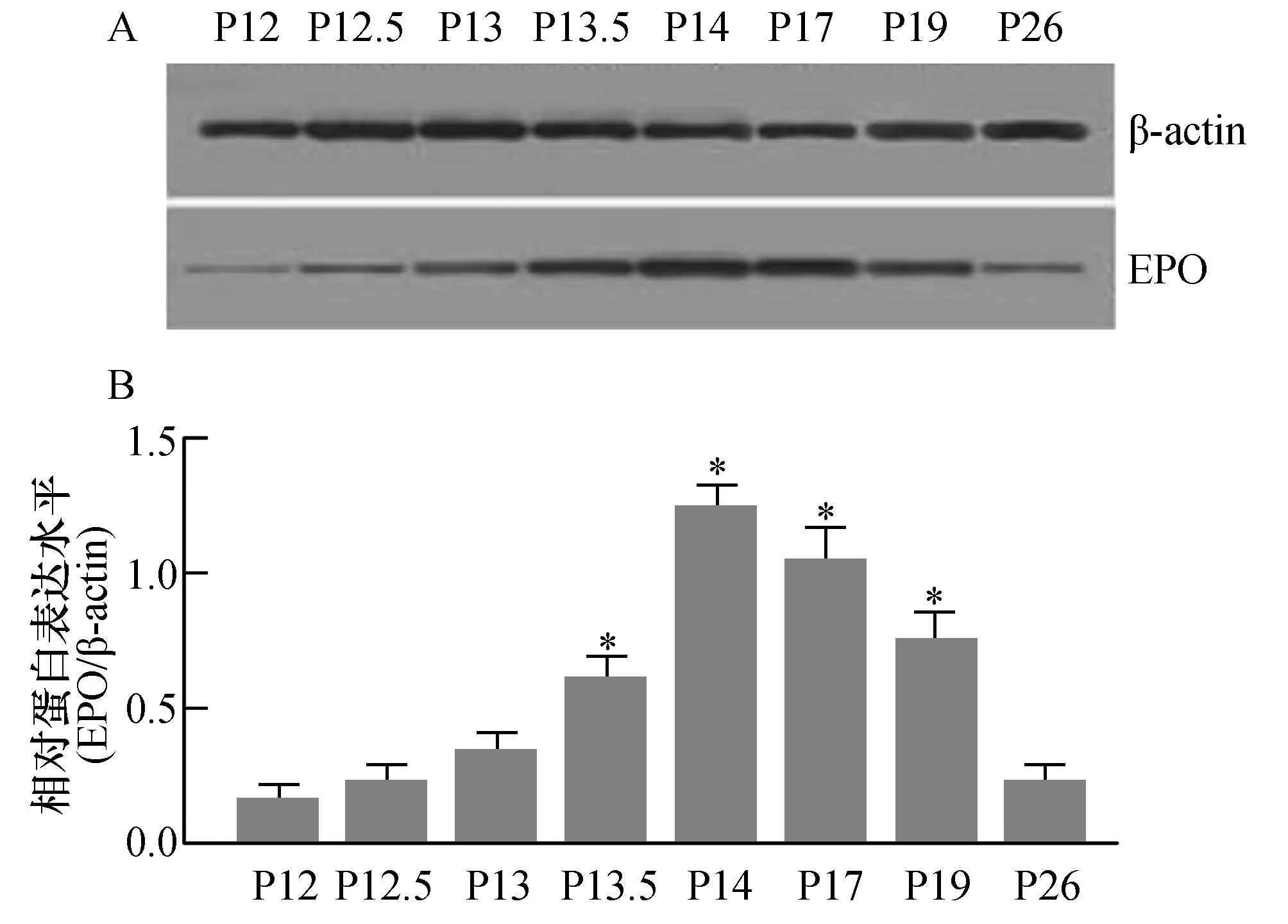
圖3 OIR模型鼠視網膜新生血管形成中EPO蛋白質的表達A:Western blot技術檢測不同時間點OIR模型鼠視網膜組織中EPO蛋白表達電泳圖;B:各泳道EPO與內參照β-actin蛋白條帶的灰度相對比值,與P12模型鼠視網膜組織中EPO蛋白質表達水平比較,*P<0.05
3 討 論
VEGF被認為是視網膜新生血管關鍵性的因子,抗VEGF藥物在臨床上展現出對于視網膜血管新生性疾病的良好療效[6]。近年來,有文獻報道,EPO在體外促進血管內皮細胞增生、遷移和成管作用與VEGF相當[7]。另外,EPO可以上調細胞基質金屬蛋白酶2(matrixm-etalloproteinases2,MMP2)表達,破壞毛細血管基底膜,協助血管內皮細胞遷移,促進新生血管的形成[8]。在體實驗顯示,EPO可誘導雞卵囊胚形成新生血管,其作用與VEGF相當[8]。這說明,EPO還參與體內生理及病理性新生血管血管形成過程。在創傷修復過程中,給予重組的EPO可通過增加創面微血管生成密度,改善創面血流灌注縮短愈合時間。EPO還參與腫瘤新生血管的形成。中樞神經系統腫瘤、乳腺癌、胃癌的腫瘤細胞和毛細血管內皮細胞都發現了EPOR的表達,且EPO的表達水平與腫瘤血管形成和病情進展密切相關,給予EPO拮抗劑可以通過減少腫瘤血管形成而抑制腫瘤生長[9]。由此可見,EPO是一種重要的促血管生成因子,在視網膜新生血管形成中起重要的調控作用。
視網膜新生血管關系最為密切的病理改變是缺血、缺氧[10-11]。缺氧的視網膜組織內HIF-1α蛋白降解受到抑制,HIF-1α蛋白在細胞內沉積與HIF-1β蛋白二聚化形成HIF-1復合物[12]。HIF-1復合物作為轉錄因子能與啟動子上游含有低氧反應元件(Hypoxia response element,HRE)的靶基因相結合,與協同轉錄激活因子CBP/p300共同促進下游靶基因的轉錄。HIF-1的靶基因中包括血管內皮細胞生長因子及受體、誘導性一氧化氮合酶、內皮素-1、表皮生長因子[13]、血小板源性生長因子-B[14]等促進血管生成的因子,它們在血管生成過程的不同環節發揮著作用。而促紅細胞生成素基因中含有低氧反應元件HRE[15]。本研究表明,氧誘導的增殖性視網膜病變模型小鼠出現視網膜新生血管形成,視網膜組織出現缺血缺氧狀態,并于缺氧后12小時EPO表達逐漸增高,缺氧后48小時到達高峰并維持在較高的水平。視網膜組織合成并分泌的EPO蛋白質能通過在視網膜內擴散最終與視網膜血管內皮細胞上的EPO受體結合,通過細胞內信號傳導途徑引起血管內皮細胞增生、遷移、視網膜毛細血管出芽,參與誘導視網膜新生血管的形成。同時我們還發現,隨著視網膜組織內新生血管的出現及缺血、缺氧狀態的改善,視網膜組織中EPO表達逐步下調,在視網膜新生血管消退期,視網膜組織中EPO的表達水平逐步恢復到基線水平。由此可見,EPO表達水平的改變與視網膜新生血管的形成具有時間上的對應關系。這種現象的最好解釋是缺血缺氧的視網膜組織通過HIF-1從轉錄水平上調EPO的表達,EPO通過促新生血管形成作用與VEGF等因子協同誘導視網膜新生血管的形成。
綜上所述,EPO參與了氧誘導的增殖性視網膜病變模型鼠視網膜新生血管的形成,針對EPO的治療可能為臨床視網膜新生血管性疾病開辟新的治療途徑。

