鐵氧化物固定重金屬的綜述與展望
曹勇 胡龍龍 張威 張雪 范玉超
摘 要:該文概述了鐵氧化物的來源和其在地球的分布運移情況,闡述了鐵氧化物轉換特征和鐵氧化物對重金屬的吸附機理,分析了影響鐵氧化物固定重金屬的環境因子。并就鐵氧化物對重金屬固定的研究進行了展望,以期為鐵氧化物在重金屬污染土染修復中的應用提供理論參考。
關鍵詞:鐵氧化物;固定;重金屬
中圖分類號 X53文獻標識碼 A文章編號 1007-7731(2020)09-0147-04
Review and Prospect on Immobilization Heavy Metals by Iron Oxides
Cao Yong et al.
(School of Earth and Environment, Anhui University of Science and Technology, Huainan 232001, China)
Abstract: This paper summarized the sources and the distribution and migration of iron oxides in the earth,and stated the characteristics of easy conversion of iron oxides and the adsorption mechanism of iron oxides to heavy metals. At the same time,the environmental factors that affect the immobilization of heavy metals by iron oxides were analyzed. On this basis,the research prospect of iron oxide on heavy metal immobilization was put forward. The purpose of this paper is to provide reference for the research of iron oxide immobilization of heavy metals.
Key words: Iron oxide; Immobilization; Heavy metals
重金屬是可以影響人類健康的單一金屬或金屬化合物,這些物質通常在自然界中以較低的濃度存在,常見的重金屬有砷(As)、鎘(Cd)、鉻(Cr)、鉛(Pb)、汞(Hg)、銀(Ag)等,當其濃度超過一定限值時,會對人類和其他生物有危險性[1]。而近年來,隨著我國工業化快速發展,金屬冶煉及化肥農藥的使用等工農業生產活動,致使我國部分地區的重金屬污染形勢已非常嚴峻[2-4]。目前固定重金屬常用方法有沉淀、吸附和離子交換等[5-6],鐵氧化物作為一種用途廣泛且有吸附性的化合物,在環境領域常用于工業廢水治理和重金屬污染土壤修復。本文闡述了鐵氧化物的性質和鐵氧化物吸附重金屬的機理,以期為鐵氧化物應用于環境修復提供參考。
1 鐵氧化物
1.1 鐵氧化物的形成 鐵氧化物是一種在自然界廣泛存在的化合物,幾乎分布于地球的各個圈層(大氣圈,生物圈,水圈,巖石圈)[7]。最初地球表面巖石風化,在海洋和陸地環境中形成三價鐵氧化物,介于風和水的運動,鐵氧化物從巖石圈轉移到大氣圈和水圈,并且土壤中鐵氧化物通過生物鏈和工業生產活動遷移分布于生物群落中。生物群落中發現的多種鐵礦石和鐵氧化物沉積現象證實了自然環境遷移過程中伴隨著三價鐵氧化物的還原溶解以及二價鐵氧化物再次氧化[8]。
1.2 鐵氧化物的性質 目前已知的鐵氧化物共有16種,是由鐵元素與氧元素或氫氧組成的[9]。自然界和工業界的鐵氧化物大都是以微小晶體形式存在,具有很高的比表面積(一般大于100m2/g)。這種特性使鐵氧化物作為廣泛吸附劑而使用,能夠吸附溶解離子,分子和氣體[10-11]。大多數鐵氧化物中的鐵元素是三價狀態,只有FeO,Fe(OH)2和Fe3O4 3種鐵氧化物中鐵元素是二價或含有二價。三價鐵氧化物的穩定性較高,溶解性較低,色彩明亮,鐵元素容易被其他陽離子置換。鐵氧化物的廣泛分布和吸附等特性使其在環境領域被廣泛研究。
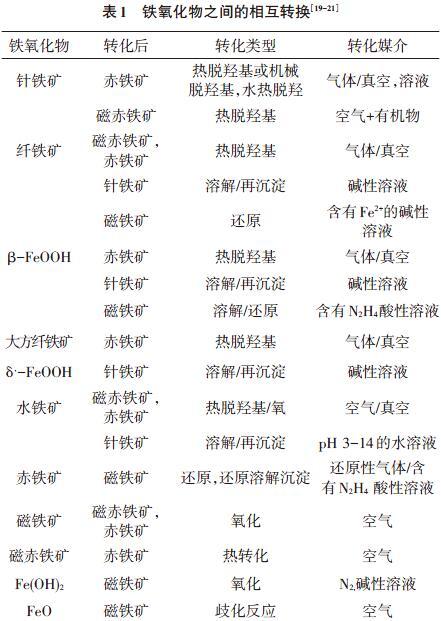
2 鐵氧化物間的轉化
在合適的環境條件下,每種鐵氧化物至少可以轉化成另外2種鐵氧化物(表1例舉部分轉換形式),這已經成為鐵氧化物的特征之一。鐵氧化物的轉化在巖石,土壤,湖泊等自然環境中的演化過程起到一個重要的作用,例如鐵氧化物的轉換會影響其吸附或固定金屬離子或無機離子的能力[12-13]。
2.1 分類 鐵氧化物轉化根據其發生的反應過程和結構特征可分為2類。
2.1.1 反應過程 鐵氧化物在相互轉化中有2種方式,一是鐵氧化物成分保持恒定;另一種是轉化過程中會涉及化學變化,如脫除1個水分子或脫除1個羥基。
2.1.2 結構特征 從結構特征上鐵氧化物的轉化又分為局部結構變化和晶體結構重構[14-15]。局部結構變化在固態相中出現,具體表現為內部原子以單晶的形式重新排列,或通過晶軸聯系初始鐵氧化物與轉化后的鐵氧化物,后者轉化過程需要高溫提供反應能量[16-17]。
晶體結構重構包括鐵氧化物溶解而完全分離和溶解離子再次沉淀形成新的形態2個過程。這種轉化致使初始鐵氧化物與轉化后的形態不存在結構關聯,并且轉化效果取決于初始鐵氧化物形態的溶解度和溶解速率[18]。因此,晶體結構重構在自然環境中更容易發生。
3 鐵氧化物對重金屬的吸附及其影響因素
3.1 吸附機理 鐵氧化物對金屬離子的吸附可以改變離子在自然系統中的遷移過程,從而影響其環境行為。近些年來,國內外學者使用紅外光譜(IR)、X射線電子能譜(XPS)、電子順子共振(EPR)等多種光譜技術揭示鐵氧化物表面官能團對重金屬的吸附機理,結果發現是鐵氧化物表面的羥基官能團與重金屬陽離子或與重金屬含氧酸根的相互作用[14,18,19]。對重金屬陽離子(Cd2+,Pb2+,Cr3+,As5+等)而言:這種吸附主要是由于重金屬陽離子與去質子化的表面羥基官能團相互作用,形成單核或雙核絡合物。對重金屬含氧酸根(AsO43-,CrO24-)而言: 起先由于靜電作用被鐵氧化物吸附,其次它們具有一個或多個帶有一對孤電子的原子,可以在配位鍵中充當供體,與鐵氧化物OH官能團中的氧原子成鍵形成絡合物。
3.2 環境影響因子 影響鐵氧化物吸附重金屬的環境因子眾多,包括環境溫度,反應時間、離子強度、環境pH值、有機質、重金屬初始濃度等。本文選擇從離子強度、pH值、磷酸鹽、有機質4個方面闡述其對鐵氧化物吸附重金屬的影響。
3.2.1 離子強度 離子強度對鐵氧化物吸附重金屬影響取決于形成的配合物類型。若形成內層配合物,電解質溶液中離子幾乎不參與吸附競爭,因此離子強度對鐵氧化物吸附重金屬影響很小。例如Antelo(2005)研究中表明離子強度對針鐵礦吸附砷酸鹽影響不明顯[22]。此外在較多內層配合物情況下,溶液中離子強度越大,鐵氧化物帶電表面與陰離子的靜電斥力越低,從而有利于鐵氧化物對重金屬的吸附[23-24]。對重金屬陽離子而言,鐵氧化物與其形成外層配合物。隨著溶液中離子強度的增加,其他陽離子會與重金屬陽離子產生競爭吸附行為,抑制了鐵氧化物對重金屬陽離子的吸附作用[25]。但也有研究顯示溶液中離子強度的增加會促進鐵氧化物對重金屬陽離子的吸附,例如在NaClO4溶液中這種現象成立,但在NaNO3溶液中發現,離子強度的變化對鐵氧化物對重金屬陽離子的吸附量沒有影響[26-27]。
3.2.2 pH值 環境pH值對鐵氧化物吸附重金屬含氧酸根和重金屬陽離子有著不同機理。對重金屬含氧酸根而言,pH的增加會造成鐵氧化物對其吸附有相互對立的2方面影響。一方面體系pH臨近酸根pKa時,重金屬含氧酸根濃度增大,促進鐵氧化物對重金屬含氧酸根的吸附;另一方面,鐵氧化物表面的羥基官能團數目隨著溶液pH的增加而下降,從而抑制了其對重金屬含氧酸根的吸附[22,28]。對重金屬陽離子而言,隨著環境pH的增加,鐵氧化物對重金屬陽離子的吸附量也增加。并且針鐵礦、水鐵礦等鐵氧化物吸附重金屬濃度與pH(pH值在2~8之間)都呈上升的S型曲線,起初增加速率緩慢,在溶液pH值為5左右時,達到速率最快[29-30]。Swedlund(2009)研究表明,環境pH較低時針鐵礦表面羥基官能團是質子化的,抑制了對Cu2+吸附[25]。
3.2.3 磷酸鹽 磷酸根是一種多元酸根,鐵氧化物與磷酸鹽的吸附可以在較大幅度的溶液pH范圍下發生。鐵氧化物對磷酸鹽吸附基于配體交換的機制,吸附磷酸鹽的初始速度快,然后進入吸附平衡階段,被吸附在鐵氧化物的磷酸鹽以雙核雙齒配合物形式存在[31]。對于鐵氧化物表面的同一吸附位點,當系統中存在磷酸鹽時,會與其他重金屬離子(Cd2+,As5+,AsO43-等)存在吸附競爭行為[32-33],重金屬陽離子的吸附位點被磷酸鹽占據后,致使鐵氧化物對重金屬離子的吸附量減少。例如Li(2006)在含有赤鐵礦溶液中添加磷酸鹽,赤鐵礦對Cd2+和Cu2+的相等吸附最大量往pH增大方向偏移[34]。
3.2.4 有機質 有機質與鐵氧化物相互作用的研究眾多,土壤肥沃程度與土壤中鐵氧化物吸附有機質的能力具有很大關聯,鐵氧化物吸附有機質的機制主要是靜電作用,但配體交換和氫鍵也起到部分作用[35]。因此,有機質也與重金屬離子競爭鐵氧化物表面的吸附位點。Alba(2017)關于天然有機物對砷酸鹽和銅在針鐵礦上結合的研究中表明,針鐵礦對砷酸鹽的吸附量明顯下降,一方面是添加有機質后,針鐵礦表面負電荷增多,與砷酸鹽的靜電斥力增大,另一方面是被吸附的有機質會占據針鐵礦表面大量的吸附位點,導致對砷酸鹽的活性吸附位點減少,但研究中也指出有機質被吸附后,也會生成部分新的活性位點(羧基和酚基),從而對Cu2+的吸附量有所增加[36]。
4 問題與展望
近年來,無論是我國水體重金屬污染事件頻發,還是2014年《全國土壤污染狀況調查公報》中數據顯示西南、中南地區土壤重金屬超標范圍較大,都表明目前我國重金屬污染防治仍有較大的挑戰。由于從土壤、水體等環境中直接去除重金屬的成本太大,已有很多學者研究降低重金屬在環境中的遷移能力和生物有效性,鐵氧化物也因其對重金屬離子較強固定能力受到廣泛的關注。
但是當前鐵氧化物應用于固定重金屬存在鐵氧化物本身性質易受環境影響、固定效果差異性較大以及固定重金屬機制尚有不明確等不足。鐵氧化物在不同的pH、Eh和溫度條件下會轉換成不同的鐵氧化物,眾多的鐵氧化物理化性質各有不同,從而影響固定重金屬的效果。此外,不同的鐵氧化物對不同的重金屬固定能力有所差異,如針鐵礦對Cu和Pb固定能力遠大于Ni,而水鐵礦對Pb的固定能力最強。因此應根據具體污染狀況選取合適的鐵氧化物或與其他固定劑復合使用。并且,大多數學者關注鐵氧化物的應用效益,較少關注鐵氧化物應用于環境后所帶來的生態改變。
今后鐵氧化物對重金屬固定應用應加強以下幾個方面的研究:(1)固定不同重金屬中所需的最適宜鐵氧化物添加量,降低鐵氧化物固定重金屬的經濟成本(2)探究不同土壤和水體環境中鐵氧化物應用的可行性(3)監測添加鐵氧化物之后的土壤和水體長期的理化性質,是否會對環境帶來二次污染的風險。
參考文獻
[1]Martin S,Griswold W. Human health effects of heavy metals[J]. Environmental Science and Technology briefs for citizens,2009,15:1-6.
[2]周建軍,周桔,馮仁國.我國土壤重金屬污染現狀及治理戰略[J].中國科學院院刊,2014(3):315-320.
[3]傅國偉.中國水土重金屬污染的防治對策[J].中國環境科學,2012,32(2):373-376.
[4]Hu H,Jin Q,Kavan P. A study of heavy metal pollution in China:Current status,pollution-control policies and countermeasures[J].Sustainability,2014,6(9):5820-5838.
[5]Fu F,Wang Q. Removal of heavy metal ions from wastewaters:a review[J]. Journal of environmental management,2011,92(3):407-418.
[6]Lakherwal D. Adsorption of heavy metals: a review[J]. International journal of environmental research and development,2014,4(1):41-48.
[7]Lowenstam H A. Minerals formed by organisms[J]. Science,1981,211(4487):1126-1131.
[8]Hedges J,Oades J. Comparative organic geochemistries of soils and marine sediments[J]. Organic geochemistry,1997,27(7-8): 319-361.
[9]Bigham J,Fitzpatrick R W,Schulze D. Iron oxides[J]. Soil mineralogy with environmental applications,2002:323-366.
[10]Caruthers S D,Wickline S A,Lanza G M. Nanotechnological applications in medicine[J]. Current opinion in Biotechnology,2007,18(1):26-30.
[11]Houben G. Iron oxide incrustations in wells. Part 1:genesis,mineralogy and geochemistry[J]. Applied Geochemistry,2003,18(6):927-939.
[12]樊建新.土壤中鐵氧化物形態對As、Sb固定與轉化的影響機制研究[D].北京:中國科學院大學,2013.
[13]章永松,林咸永.淹水對兩種水稻土氧化層和還原層鐵氧化物轉化和磷吸附的影響(英文)[J].浙江大學學報(農業與生命科學版),2002,28(5):485-491.
[14]Bernal J,Dasgupta D,Mackay A. The oxides and hydroxides of iron and their structural inter-relationships[J]. Clay Minerals Bulletin,1959,4(21):15-30.
[15]Bernal J,Mackay A. Topotaxy[J]. Tschermaks mineralogische und petrographische Mitteilungen,1965,10(1-4):331-340.
[16]Francombe M,Rooksby H. Structure transformations effected by the dehydration of diaspore,goethite and delta ferric oxide[J]. Clay Minerals Bulletin,1959,4(21): 1-14.
[17]Jiménez-Mateos J M,Morales J,Tirado J. Textural evolution of α-Fe2O3 obtained by thermal and mechanochemical decomposition of δ-FeOOH[J]. Journal of colloid and interface science,1988,122(2):507-513.
[18]Blesa M A,Matijevic' E. Phase transformations of iron oxides,oxohydroxides,and hydrous oxides in aqueous media[J]. Advances in Colloid and Interface Science,1989,29(3-4):173-221.
[19]Blesa M A,Weisz A D,Morando P J,et al. The interaction of metal oxide surfaces with complexing agents dissolved in water[J]. Coordination Chemistry Reviews,2000,196(1):31-63.
[20]Cornell R M,Schwertmann U. The iron oxides: structure,properties,reactions,occurrences and uses[M]. John Wiley & Sons,2003.
[21]Schwertmann U,Taylor R. The influence of silicate on the transformation of lepidocrocite to goethite[J]. Clays and Clay Minerals,1972,20(3):159-164.
[22]Antelo J,Avena M,Fiol S,et al. Effects of pH and ionic strength on the adsorption of phosphate and arsenate at the goethite-water interface[J]. Journal of colloid and interface science,2005,285(2):476-486.
(上接149頁)
[23]Fuller C C,Davis J A,Waychunas G A. Surface chemistry of ferrihydrite:Part 2. Kinetics of arsenate adsorption and coprecipitation[J].Geochimica et Cosmochimica Acta,1993,57(10):2271-2282.
[24]Willett I,Chartres C,Nguyen T. Migration of phosphate into aggregated particles of ferrihydrite[J]. Journal of Soil Science,1988,39(2):275-282.
[25]Swedlund P J,Webster J G,Miskelly G M. Goethite adsorption of Cu (II),Pb (II),Cd (II),and Zn (II) in the presence of sulfate: properties of the ternary complex[J]. Geochimica et Cosmochimica Acta,2009,73(6):1548-1562.
[26]Lützenkirchen J. Ionic strength effects on cation sorption to oxides: macroscopic observations and their significance in microscopic interpretation[J]. Journal of colloid and interface science,1997,195(1):149-155.
[27]Venema P,Hiemstra T,van Riemsduk W H. Comparison of different site binding models for cation sorption:description of pH dependency,salt dependency,and cation-proton exchange[J]. Journal of Colloid and Interface Science,1996,181(1):45-59.
[28]Nelson H,Sj?berg S,L?vgren L. Surface complexation modelling of arsenate and copper adsorbed at the goethite/water interface[J]. Applied geochemistry,2013,35:64-74.
[29]Weerasooriya R,Tobschall H. Mechanistic modeling of chromate adsorption onto goethite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2000,162(1-3):167-175.
[30]Brown Jr G,Parks G,Oday P. Sorption at mineral-water interfaces:macroscopic and microscopic perspectives[J]. Mineral Surfaces,1995,5:129-183.
[31]Guzman G,Alcantara E,Barron V,et al. Phytoavailability of phosphate adsorbed on ferrihydrite,hematite,and goethite[J]. Plant and soil,1994,159(2):219-225.
[32]Collins C R,Ragnarsdottir K V,Sherman D M. Effect of inorganic and organic ligands on the mechanism of cadmium sorption to goethite[J]. Geochimica et Cosmochimica Acta,1999,63(19-20):2989-3002.
[33]Hingston F,Posner A,Quirk J. Competitive adsorption of negatively charged ligands on oxide surfaces[J]. Discussions of the Faraday Society,1971,52:334-342.
[34]Li W,Zhang S,Jiang W,et al. Effect of phosphate on the adsorption of Cu and Cd on natural hematite[J]. Chemosphere,2006,63(8):1235-1241.
[35]Schindler P. Co-adsorption of metal ions and organic ligands; formation of ternary surface complexes[J]. Reviews in Mineralogy and Geochemistry,1990,23(1):281-307.
[36]Otero-Fari?a A,Fiol S,Arce F,et al. Effects of natural organic matter on the binding of arsenate and copper onto goethite[J]. Chemical Geology,2017,459:119-128. (責編:王慧晴)

