用于Escherichia coli O157∶H7直接快速檢測的倏逝波熒光核酸適配體傳感器研究
方順燕 宋丹 劉艷萍 徐文娟 劉佳瑤 韓向峙 龍峰
(中國人民大學環境學院,北京 100872)
病原菌引起的各種傳染病是當今危害人類健康與生命安全最為嚴重的一類疾病[1-2]。病原菌傳統培養檢測法是一個金標準方法,但檢測周期長、程序復雜[1-3]。同時,由于病原菌種類日益增多,且不少病原菌尚無可行的分離培養方法。而對于臨床檢驗和環境污染應急檢測來說,最為關鍵的要求之一是盡可能簡化分析處理過程、盡快獲得檢測結果和減少所需樣品量。傳統培養法顯然難以這樣要求。隨著分子生物學、免疫學等現代生物學的飛速發展,分子生物學技術及免疫分析技術被廣泛應用于病原菌的檢測,如PCR技術、酶聯免疫分析技術等。理論上,這些方法可以檢測幾乎所有病原菌,并且可有效提高病原菌檢測的時效性及靈敏度,但是這些分析技術仍然需要較長時間(>2 h)、前處理過程繁雜、易受雜質干擾、所需的樣品量較大及存在假陽/陰性結果等不足之處[1-4]。因此,發展適用于病原菌現場即時高靈敏、高特異性及快速經濟的新技術已成為當前的研究熱點和前沿[5]。
在融合現代光學、分子生物學和微流控等優勢技術的基礎上發展起來光學生物傳感技術是病原菌現場快速檢測領域最為耀眼的明珠[5]。光學生物傳感器可大致分為比色生物傳感器、基于表面等離子共振的生物傳感器和基于激光誘導熒光的生物傳感器。其中,基于激光誘導熒光的生物傳感器已成為研究最為深入和應用最為廣泛的一種光學生物傳感器。基于夾心法原理,利用納米信號增強技術,該類傳感器檢測細菌和病毒污染的靈敏度可達到10 CFU/mL[5-6]。但要實現光學生物傳感器真正的實用化還存在幾大挑戰。第一個挑戰是使用現有的生物傳感器要實現病原菌檢測的關鍵步驟需將生物識別分子(如抗體、核酸適體等)固定到傳感元件上,以實現病原菌的特異性識別和捕獲。但修飾過程會造成生物分子活性的降低,且由于位阻效應,生物分子的固定會影響其對病原菌的捕獲,從而影響檢測靈敏度[7]。另一方面,生物傳感器的優勢在于其可重復使用,但當固定抗體或核酸適配體等生物識別分子時,由于再生條件(強酸或強堿)苛刻,使得生物分子的活性快速下降,導致生物傳感器再生次數非常有限(<10次)。第二個挑戰是如何簡化病原菌檢測方式以實現其現場快速分析。現有的病原菌生物傳感器一般采用夾心法,這就使得檢測過程需要進行多個反應步驟,增加了檢測時間。同時,使用試劑種類多,造成檢測成本比較高。更為重要的是,為提高檢測靈敏度,通常需要使用過濾或免疫磁珠來對病原菌進行富集分離,這進一步延長了檢測時間并使得檢測過程復雜化。
為此,本研究提出一種新的倏逝波熒光生物傳感分析策略來實現病原菌直接快速檢測。根據我們前期的研究成果和經驗,倏逝波光纖生物傳感器是利用光在光纖進行全反射傳播時,在光纖表面產生倏逝波,其強度隨滲入深度呈指數衰減,有效深度在100 nm以內,當熒光標記的生物分子探針進入倏逝波有效范圍內,熒光分子被激發光激發發出熒光,通過檢測熒光強度來實現目標物的檢測[8-9]。而病原菌(如大腸桿菌、沙門氏菌等)的尺寸約為幾百nm到μm級。因此,我們提出基于倏逝波熒光原理及其與病原菌的尺寸效應來實現病原菌的直接快速檢測。本研究以E.coliO157∶H7為靶標物,結合特異性的核酸適配體來實現其直接快速檢測。基本原理是當一定濃度熒光標記核酸適配體加入樣品檢測池時,倏逝波激發熒光分子發出熒光,利用課題組前期研發的倏逝波全光纖生物傳感器即可實現熒光信號的定量檢測。而當熒光標記的核酸適配體與E.coliO157∶H7混合后加入樣品檢測池,由于部分核酸適配體結合到E.coliO157∶H7表面,其標記熒光分子不能被激發,故導致檢測熒光信號降低,利用熒光信號強度與E.coliO157∶H7濃度的比例關系即可實現其定量檢測。
1 材料與方法
1.1 材料
1.1.1 試劑、緩沖溶液及適配體等 濃硫酸、過氧化氫、氫氟酸、氯化鉀、磷酸二氫鉀、磷酸氫二鈉及鹽酸等化學試劑均購于北京化學試劑公司,所有試劑均為分析純或更高。十二烷基硫酸鈉(SDS)購自Sigma-aldrich公司(上海,中國)。自配PBS緩沖溶液(pH 7.4,137 mmol/L NaCl+2.7 mmol/L KCl+4.3 mmol/L Na2HPO4+1.4 mmol/L KH2PO4)、Tris-HCl緩沖液、SDS溶液(0.5% SDS,pH 1.9)。
與大腸桿菌特異性結合的核酸適配體序列結構為5'- GCGGGAATAGGATGCGGCTGG AAGGAGAGGTGTTGGTGGGTGGTG -3',其5'-端標記熒光分子Cy5.5,該核酸適配體由生工生物工程(上海)股份公司合成。E.coliO157∶H7、發光細菌、沙門氏菌使用LB培養基培養。不同濃度的菌液由10 mmol/L PBS溶液稀釋而成。
1.1.2 倏逝波熒光光纖生物傳感器 使用的倏逝波熒光光纖生物傳感器如圖1所示。其原理是,激發光(635 nm,10 mW)經過單多模光纖耦合器進入光纖傳感探頭,在光纖傳感探頭內以全反射方式傳播,并在探頭表面形成倏逝波。當熒光分子進入倏逝波激發的有效范圍內時,倏逝波激發熒光分子發出熒光,部分熒光耦合回光纖傳感探頭,由單多模光纖耦合器進行收集與傳輸,經濾光片濾除雜散光后被硅光電探測器進行檢測。檢測到的熒光信號值實時顯示在用戶界面上。
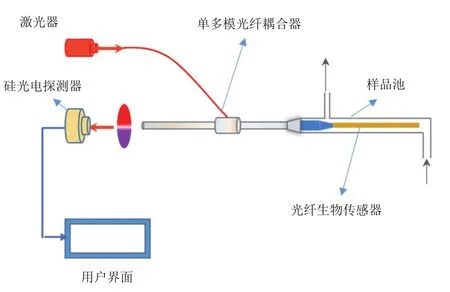
圖1 倏逝波熒光光纖生物傳感器原理示意圖
1.2 方法
1.2.1 光纖傳感探頭制備 將 5.5 cm長的石英光纖(數值孔徑為0.22,南京春暉科技發展有限公司)去除2.5 cm長的涂覆層,將無涂覆層的光纖浸入50%HF溶液中進行腐蝕,光纖芯徑腐蝕至225 μm即可。
1.2.2 病原菌的培養E.coliO157∶H7的菌落用灼燒后冷卻的接種環接種于1 mL LB液體培養基中,將其在置于37℃恒溫水浴震蕩12 h,然后將震蕩好的菌液加入到100 mL LB液體培養基中,37℃水浴恒溫震蕩24 h。為保證實驗的準確性,每次實驗均使用新鮮菌液。
1.2.3E.coliO157∶H7的檢測 為獲得E.coliO157∶H7檢測標準曲線,將500 nmol/L的E.coliO157∶H7核酸適體分別與不同濃度的E.coliO157∶H7混合,在25℃下預反應15 min,然后輸入到樣品檢測池進行熒光信號檢測。每個濃度進行3次平行實驗。為繪制標準曲線,對不同濃度E.coliO157∶H7所得到熒光信號檢測值進行歸一化處理,即:

式中,I為加入不同濃度的E.coliO157∶H7時,傳感器檢測到的熒光信號值;I0為未加E.coliO157∶H7的空白樣品熒光信號值。利用Logistics四參數模型進行標準曲線的擬合,即:
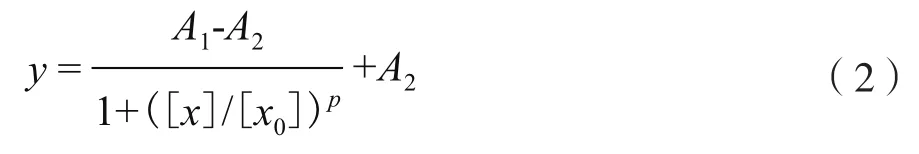
式中,[x]為E.coliO157∶H7的濃度;y為x對應的熒光信號歸一化值;A1為上端漸近線(x=0),常數;A2為下端漸近線(x→∞),常數;[x0]為曲線的拐點,常數;p為拐點處曲線的斜率,常數。根據Sinibaldi等[10]和 Chiavaioli等[11],傳感器的檢測限一般定義為空白樣檢測的平均信號值加上其3倍標準偏差,依據該定義對該傳感器的檢測限進行計算。
1.2.4 實際水樣的加標檢測 以校園景觀水、自來水、污水處理廠出水為例進行加標分析,考察水體基質對傳感分析性能的影響。由于實際樣品中所含細菌種類多樣,如果不進行滅菌操作,實驗樣品的各種細菌均可在LB培養基上生長,導致無法使用傳統培養法進行比對。因此,首先運用高溫滅菌鍋對實際水樣進行高溫滅菌(121℃),以便考察實際樣品對傳感器的影響并于傳統培養法進行比對。然后,將擴增培養的菌液使用離心機在10 000 r/min下離心8 min,清洗3次后,加入各種實際水樣中,并配成3種不同濃度。各種加標水樣與500 nmol/L熒光標記E.coliO157∶H7核酸適配體混合,在25℃下預反應15 min,然后輸入樣品檢測池進行檢測。微生物培養計數法將各種加標水樣分別稀釋后,取100 μL稀釋液在LB固體培養基上涂布,在37℃恒溫培養24 h后計數。
2 結果
2.1 基于倏逝波熒光原理的E.coli O157∶H7傳感分析機制與驗證
基于倏逝波熒光原理的E.coliO157∶H7傳感分析機制如圖2所示。由菲涅爾公式可知,當光束由折射率n大的介質進入n小的介質時,若入射角θ大于臨界角θc,入射光將全部反射回n大的介質中。在全反射的條件下,由于橫向電場與橫向磁場的Fresnel傳遞系數不為零,這意味著雖然光能全部被反射,但電磁場卻可從兩種介質的界面延伸至n小的介質中,即所謂的“倏逝波”,并遵循式(3)呈指數衰減[12]:
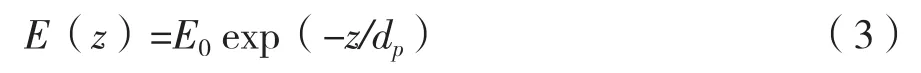
式中,z為距光纖探頭界面的距離,E(z)為z處倏逝波振幅,E0為界面處電磁場振幅,dp為滲入深度。對于多模光纖探頭,滲入深度dp(定義為電磁場為界面處電磁強度1/e的距離),為折射率、入射角和波長的函數:
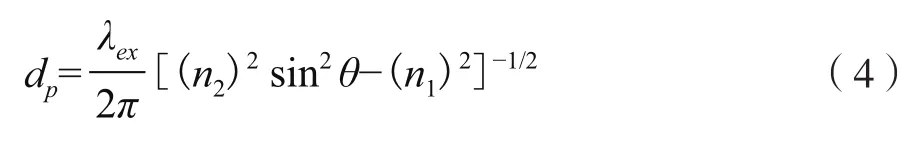
式中:λex是激發光的波長;θ是激發光與法線間夾角。本試驗中激發光波長為635 nm,光纖探頭折射率為1.456,PBS溶液的折射率為1.33,因此,倏逝波的有效深度約為100 nm。
當500 nmol/L熒光標記核酸適配體輸入到樣品檢測池時,從圖3可以看出,倏逝波熒光光纖生物傳感器檢測到突然上升的熒光信號,這是由于倏逝波激發溶液中游離的核酸適配體標記熒光所致。由于倏逝波的強度有限,熒光漂白不明顯,因此傳感器檢測熒光信號值保持基本不變。當500 nmol/L熒光標記核酸適配體與1×105CFU/mL大腸桿菌混合反應一段時間后輸入到樣品檢測池時,傳感器檢測到熒光信號也突然上升,但是熒光信號值明顯低于未加入大腸桿菌時的熒光信號值。這說明部分核酸適配體特異性結合到大腸桿菌表面,由于大腸桿菌的尺寸在微米級,倏逝波很難激發結合到大腸桿菌表面的熒光標記核酸適配體,從而導致檢測到的熒光信號值下降。為進一步驗證該結論,我們將500 nmol/L熒光標記的大腸桿菌核酸適配體分別與1×109CFU/mL沙門氏菌和發光細菌混合并輸入到樣品檢測池,從圖3可以看出,雖然沙門氏菌和發光細菌的濃度遠遠高于大腸桿菌的濃度,但是傳感器檢測到的熒光信號值并沒有明顯下降。這一方面說明大腸桿菌核酸適配體具有良好的選擇性,不會與其他病原菌結合,同時證明本研究提出的基于倏逝波熒光原理和及其與病原菌尺寸效應的檢測機制是可行的,可以用于E.coliO157∶H7的直接快速檢測。
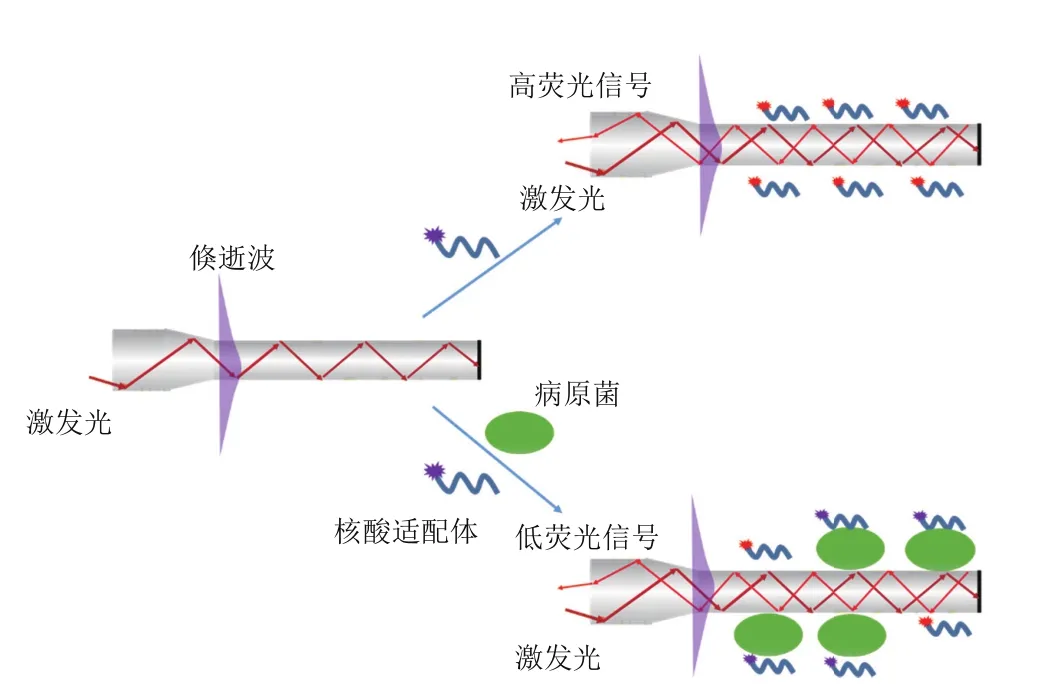
圖2 基于倏逝波熒光原理的E.coli O157∶H7傳感分析機制示意圖
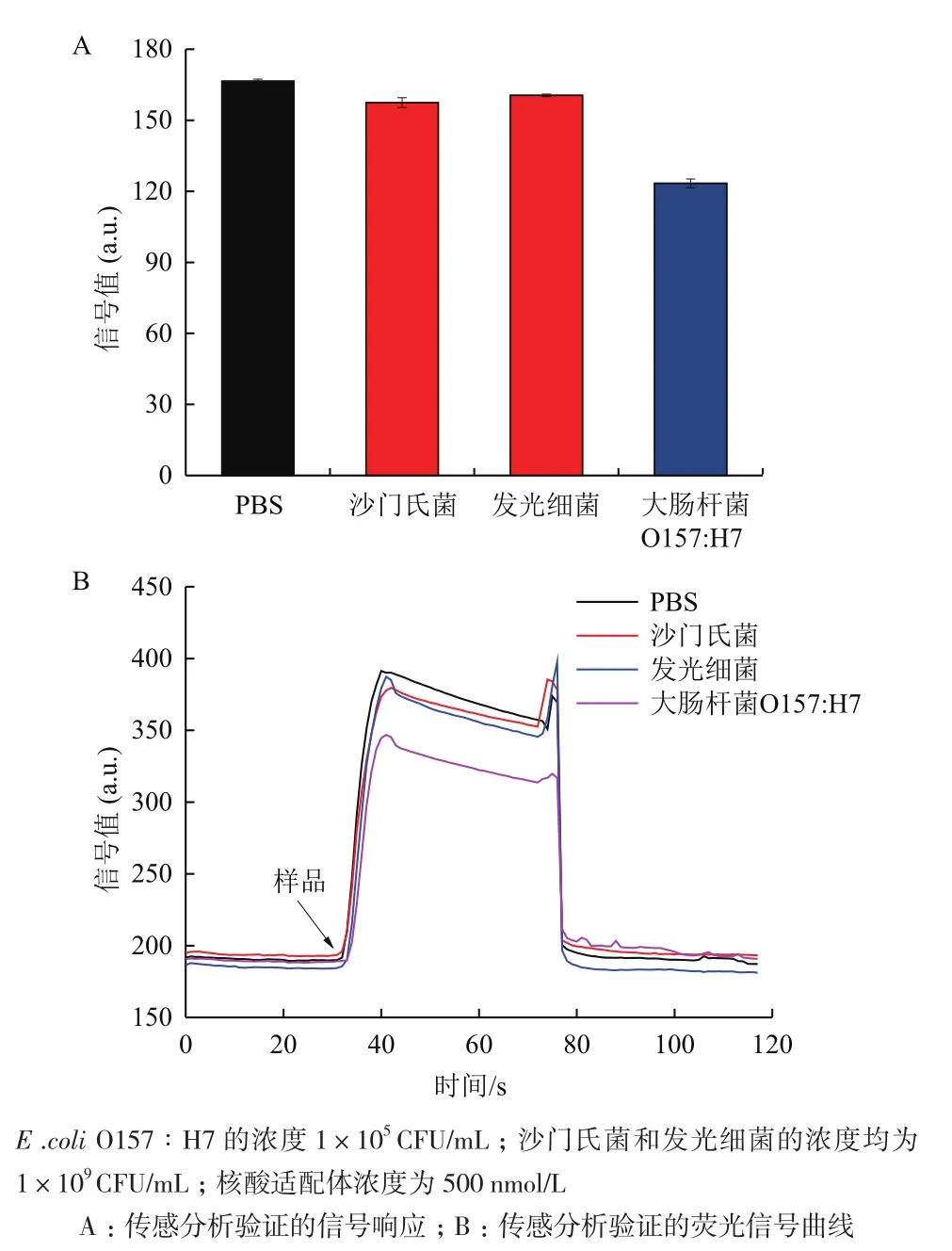
圖3 E.coli O157∶H7傳感分析驗證
2.2 E.coli O157∶H7檢測標準曲線繪制
為獲得基于倏逝波熒光原理的E.coliO157∶H7生物傳感分析標準檢測曲線,配制不同濃度的E.coliO157∶H7溶液,分別與500 nmol/L的熒光標記核酸適配體混合,反應15 min后輸入到樣品檢測池進行熒光信號值檢測,得到系列熒光信號檢測曲線(圖4)。從圖4可以看出,倏逝波熒光光纖傳感器檢測到的熒光信號值隨E.coliO157∶H7濃度的升高而下降。這是由于隨著E.coliO157∶H7濃度的增加,更多的熒光標記核酸適配體結合E.coliO157∶H7表面。因E.coliO157∶H7的尺寸在微米級,而倏逝波的滲入深度有限,部分標記在核酸適配體上熒光分子不能被激發,從而導致熒光信號值的下降。各個濃度E.coliO157∶H7重復測試3次,熒光信號的標準偏差都少于5%,表明該方法具有良好的穩定性。
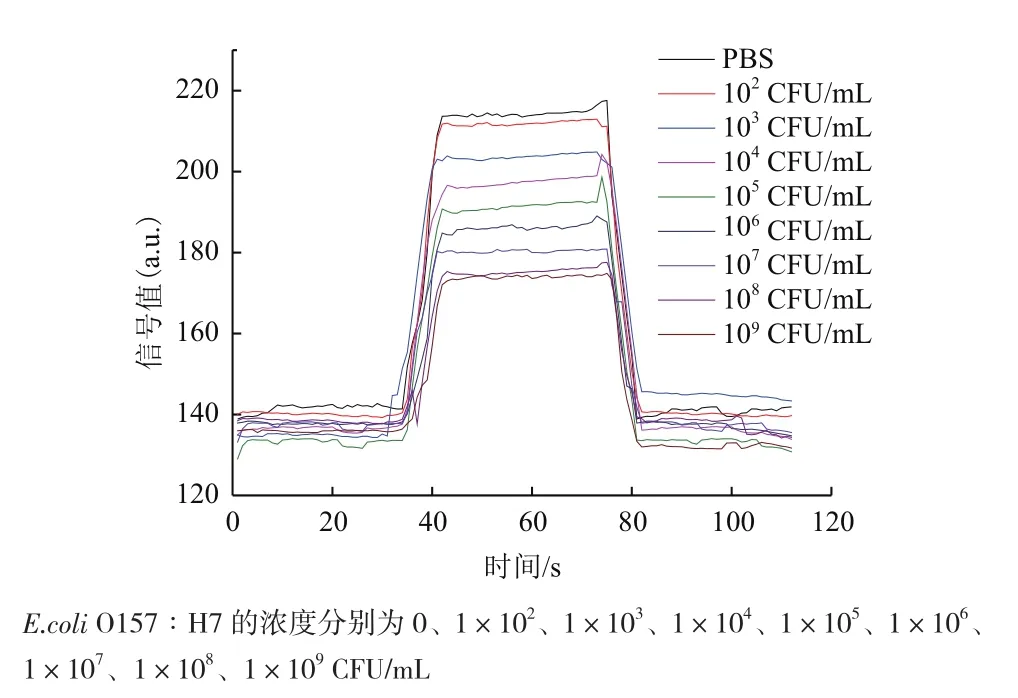
圖4 不同濃度E.coli O157∶H7的典型熒光信號曲線
將不同濃度下的熒光信號值根據式1進行歸一化處理,所得歸一化值按式2擬合,得到E.coliO157∶H7的檢測標準曲線(圖5)。通過計算可以得出,E.coliO157∶H7檢測范圍為1.1×103-1.4×107CFU/mL,檢測限[10-11]為610 CFU/mL。以上結果表明該方法具有較好的靈敏度和穩定性。
2.3 實際水樣的E.coli O157∶H7加標測試
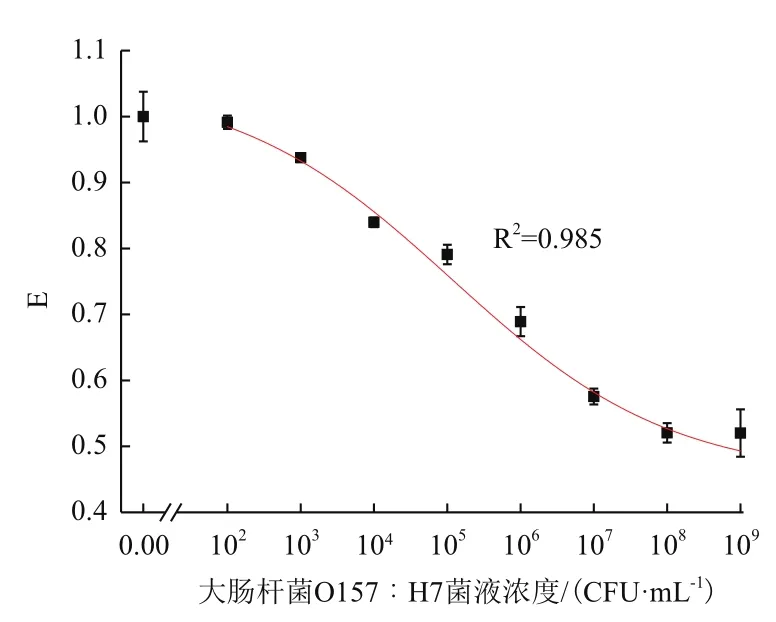
圖5 E.coli O157∶H7檢測標準曲線
為驗證該方法在實際水樣中運用的可行性,考察水體基質對傳感分析性能的影響,利用該方法分析了校園景觀水、自來水和污水處理廠出水等實際水樣的加標回收率并與傳統培養法進行了比對。在檢測前,先用高溫滅菌鍋對實際水樣進行高溫滅菌(121℃)。然后,將培養的E.coliO157∶H7加入各種實際水樣中。各種加標水樣與500 nmol/L熒光標記E.coliO157∶H7核酸適配體混合,在25℃下預反應15 min,然后輸入樣品檢測池進行檢測。從表1可以看出,E.coliO157∶H7的回收率在40%-180%之間,相對標準偏差在10%之內。與傳統的培養法具有較好的一致性,這些結果表明本研究建立的基于倏逝波熒光原理的E.coliO157∶H7生物傳感分析方法可以用于實際水樣的檢測。
3 討論
E.coliO157∶H7是一種腸出血性大腸桿菌,可經食物和飲用水在人群中廣泛傳播,可導致腹痛、腹瀉、急性腎衰,甚至死亡。美國和歐盟曾發生多次E.coliO157∶H7的爆發性流行[13]。因此,多國衛生部門已將E.coliO157∶H7列為常規檢測項目,我國生活飲用水衛生標準中要求不得檢出[14-15]。因此,發展高特異性、操作簡單、檢測迅速及成本低廉的病原菌檢測方法具有重要的科學價值和現實意義。
本研究結合倏逝波熒光光纖傳感器和核酸適配體的優勢,提出了基于倏逝波熒光原理及其與病原菌尺寸效應的E.coliO157∶H7直接快速檢測方法。該方法可以避免傳統生物傳感器需要固定生物識別分子造成的諸多不足,如生物識別分子在固定過程中可能導致活性損失等。由于本研究采用的是將特異性核酸適配體與E.coliO157∶H7在均相中直接反應,因此,可以有效提高生物識別分子與病原菌的親和反應效率。這種檢測模式無需苛刻的再生條件,僅需在檢測完成后,將樣品排出樣品池即可進行下一個樣品的檢測。同時,傳統生物傳感器常采用夾心法方式來實現病原菌的檢測,即采用一種生物識別分子(抗體或核酸適配體等)固定在生物傳感器表面捕獲病原菌,然后用另一種熒光標記生物功能分子結合到病原菌表面作為報告分子[16-19]。本研究提出的方法僅用一種熒光標記核酸適配體即可實現E.coliO157∶H7快速識別與定量檢測,這可以大大簡化病原菌檢測程序,減少檢測時間和反應試劑的使用,有效降低檢測成本。更進一步,本研究提出的檢測方法僅需更換熒光標記的生物識別分子即可實現其他不同的病原菌的檢測。因此,基于倏逝波熒光原理及其與病原菌尺寸效應的生物傳感分析技術具有廣泛的適用性和實用性。
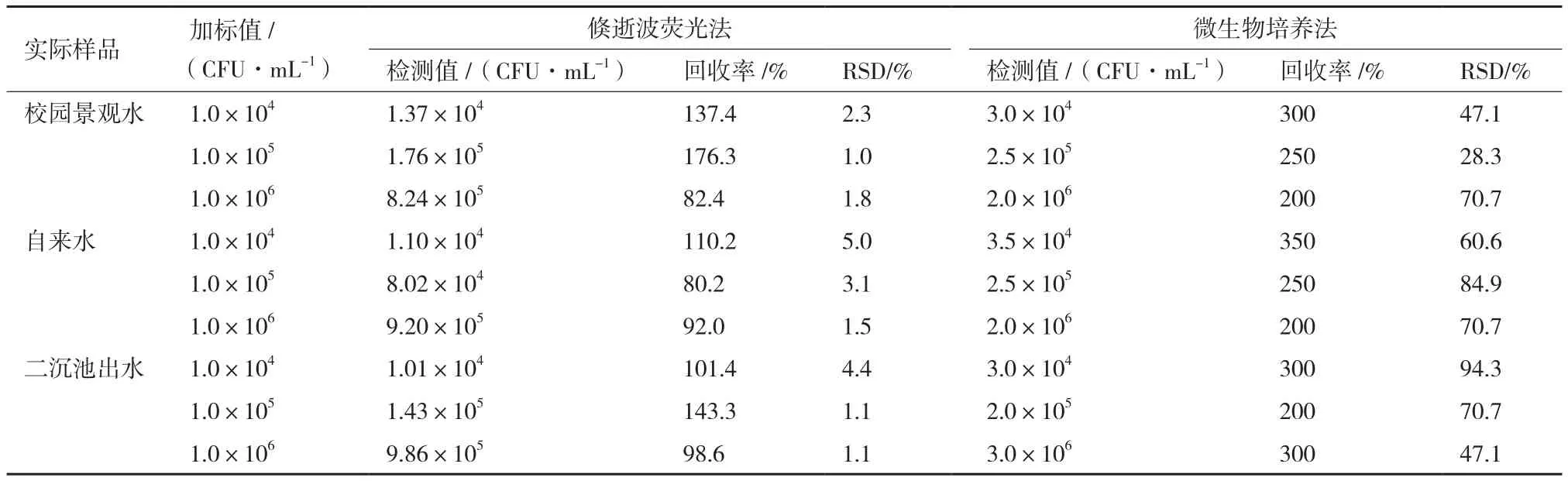
表1 實際水樣中E.coli O157∶H7的加標回收率(n=3)
4 結論
融合倏逝波熒光光纖傳感器和特異性核酸適配體的優勢,提出一種了基于倏逝波熒光原理及其與病原菌尺寸效應的病原菌新型檢測方法。研究表明該方法可實現E.coliO157∶H7的直接快速檢測,檢測限可達610 CFU/mL,線性檢測區間為1.1×103-1.4×107CFU/mL。由于使用特異性核酸適配體與E.coliO157∶H7在均相溶液中結合,利用倏逝波熒光原理及尺寸效應來實現其快速檢測,無需固定生物識別分子,也無需采用夾心法的檢測模式。因此,該方法可有效縮短檢測時間(<30 min),減少使用的反應試劑和檢測成本。對實際水樣進行了加標回收實驗,結果表明加標回收率在40%-180%之間,相對標準偏差在10%之內,水樣基質對該方法檢測E.coliO157∶H7沒有明顯影響。因此,本研究建立基于倏逝波熒光原理及其與病原菌尺寸效應的生物傳感分析方法可以用于實際水樣的檢測,同時,僅需更換熒光標記的生物識別分子即可實現其他不同的病原菌的檢測。

