經多功能導管化學消融犬左心室前組乳頭肌
錢 俊,黃 晶,楊 剛,江永紅,朱 愨,劉地川,鄧昌明
(重慶醫科大學附屬第二醫院心血管內科,重慶 400010)
左心室乳頭肌(papillary muscle, PM)解剖結構復雜,其基底部分布有豐富浦肯野纖維網,在室性心律失常(ventricular arrhythmias, VAS)發生和維持中扮演重要角色[1-2]。經導管射頻(radiofrequency, RF)消融是治療PM起源VAS的有效方式之一,但此類VAS常起源于心肌深部,且消融過程中始終保持電極與PM處于良好貼靠關系并非易事,尤其左心室前組乳頭肌(anterior papillary muscle, APM)懸垂于心腔,且基底寬大,相比其他部位心肌(如左心室壁、流出道等)起源VAS,其消融效果差強人意[3-4]。
經導管心肌注射無水乙醇可在靶區域內形成范圍可控的消融灶,以減少VAS發生[5-6]。本課題組前期自行研發了一款集心腔內超聲(intracardiac echocardiography, ICE)成像和心肌內注射功能于一體的多功能導管,其用于實施室間隔化學消融的可行性已在動物模型中得到驗證[7]。本研究嘗試利用該導管在ICE圖像定位和監控下經心內膜途徑向APM基底部注射無水乙醇,評估以之實施APM化學消融的可行性和安全性。
1 材料與方法
1.1 多功能ICE導管系統 系統[8]由以下各部分組成:①32晶陣微型超聲探頭(頻率6.5~10.0 MHz),經同軸電纜連接CTS-5000B型主機(汕頭市超聲儀器研究所有限公司),裝配于導管前端,可提供心腔內二維超聲圖像;②鎳鈦合金注射針(29G),自導管尾端進針并從成像探頭后方伸出,與成像探頭呈30°角,注射針尾端接1.0 ml注射器。
1.2 實驗動物 15只健康雜交犬,雌雄不限(體質量15.5~23.5 kg),購于重慶醫科大學實驗動物中心,隨機納入0.2 ml組、0.4 ml組及0.8 ml組,每組5只。以3%戊巴比妥鈉經腹腔注射麻醉動物后保定于手術臺上,在無菌條件下暴露左側頸總動脈,置入9F動脈鞘管,注入肝素(100 IU/kg體質量)抗凝,并經鞘管送入多功能ICE導管直至進入左心室。
1.3 消融過程 利用多功能ICE導管觀察心腔內結構,定位到左心室APM后,固定導管及探頭朝向,在ICE圖像監控下自導管尾端緩慢插入注射針,直至針尖抵達APM基底部。經導管尾端注射器注射少量超聲微泡(SonoVue)進一步確定針尖部位,之后對各組緩慢注射相應量無水乙醇。注射完畢后緩退注射針,撤出多功能導管,縫合切口,予青霉素鈉(800萬IU/天)預防感染。
1.4 安全性評價 消融前及消融5天后通過測定二尖瓣反流面積(mitral regurgitation area, MRA)、射流緊縮口寬度(vena contracta, VC)評估乳頭肌功能。消融結束后采用經胸超聲(CTS 5000B,汕頭市超聲儀器研究所)觀察有無心腔內附壁血栓、APM斷裂及心包壓塞等并發癥。
1.5 病理學檢測 完成上述檢查后經靜脈注射10%氯化鉀20 ml處死動物,取出完整心臟,沿左心室長軸切開,觀察有無血栓、贅生物、PM斷裂等并發癥;隨后沿長軸切開APM,觀察消融灶大體形態,并計算其體積(公式:4×長度×寬度×深度×π/3)。將組織置于4%多聚甲醛中固定,行HE染色,于光學顯微鏡下觀察消融灶及周邊組織病理學改變。
1.6 統計學分析 采用SPSS 15.0統計分析軟件。所有數據均以±s表示,使用配對t檢驗比較各組消融灶體積(cm2)和消融前、消融5天后MRA(cm2)及VC(mm)。P<0.05為差異有統計學意義。
2 結果
左心室APM在ICE長軸切面上呈“卵圓形”(圖1A),其尖端可見腱索附著,與左心室壁分界清晰。與周圍組織相比,插入心肌組織內的鎳鈦合金注射針表現為條索狀高回聲結構(圖1B),隨心臟搏動而擺動;注射無水乙醇后,肉眼可見局部心肌組織灰度值較前顯著增強,呈團塊樣高回聲區域(圖1C)。
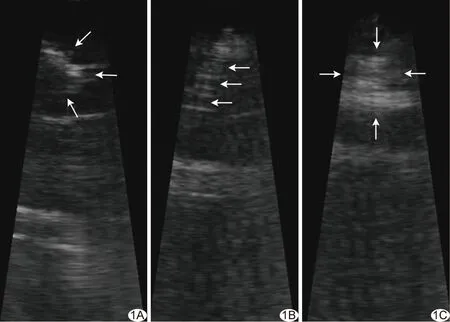
圖1 ICE監控下經心內膜面注射無水乙醇消融APM A.左心室APM顯示清晰,呈“卵圓形”,頭端有腱索附著(箭); B.插入心肌組織中的注射針表現為條索狀高回聲(箭); C.注射無水乙醇后,局部心肌灰度值較前顯著增加,表現為團塊狀高回聲(箭)
2.1 大體觀察 取出沿左心室長軸切開心臟發現2只犬心內膜輕微出血,未見附壁血栓、心肌穿孔及PM斷裂等并發癥。沿長軸切開APM見其基底部存在蒼白色、中間夾有暗紅區域的消融灶,與周圍組織界限分明(圖2),0.2 ml、0.4 ml及0.8 ml組 APM基底部消融灶體積分別為(0.37±0.07)cm2、(0.69±0.08)cm2及(0.96±0.19)cm2,較高劑量組消融灶體積大于較低劑量組(P均<0.05)。
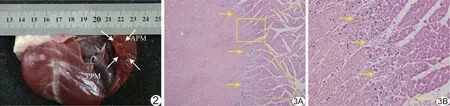
圖2 0.2 ml組犬左心室APM消融灶大體改變 APM基底部可見蒼白色、中間夾有暗紅區域的消融灶(箭),未見乳頭肌斷裂、心內膜血栓及心肌穿孔等 (APM:前組乳頭肌;PPM:后組乳頭肌) 圖3 消融部位心肌病理圖 A.消融灶周邊組織結構基本完好,橫紋清晰,與消融灶界限分明(箭,HE,×40); B.消融中心區域心肌細胞核固縮、碎裂、溶解或消失,可見變形及碎裂的紅細胞碎片,伴少量炎性細胞浸潤(箭,HE,×100)
2.2 安全性評價 注射針插入心肌瞬間可見室性期前收縮,未見持續性室性心律失常。消融后即刻及消融5天后經胸超聲均未發現附壁血栓形成、PM斷裂、心肌穿孔及心包壓塞等。消融5天后,0.2 ml、0.4 ml組MRA、VC與消融前差異無統計學意義(P均>0.1),0.8 ml組MRA、VC均較前增加(P均<0.05,表1)。
表1 各組消融前后乳頭肌功能比較(±s)

表1 各組消融前后乳頭肌功能比較(±s)
組別MRA(cm2)消融前消融5天后VC(ml)消融前消融5天后0.2 ml組0.36±0.230.39±0.191.10±0.701.30±0.700.4 ml組0.41±0.210.38±0.191.20±0.501.10±0.500.8 ml組0.36±0.221.16±1.051.40±0.702.50±0.90
2.3 病理學觀察 相比正常心肌組織,消融部位心肌纖維排列紊亂,消融中心區域心肌細胞可見出血及凝固性樣壞死,細胞核固縮、碎裂,核溶解或消失,消融灶內見大量變形及碎裂的紅細胞碎片和少許炎性細胞浸潤。消融灶周圍組織結構基本完好,橫紋清晰,細胞核呈正常卵圓形,與消融灶界限分明(圖3)。
3 討論
本研究利用自制多功能ICE超聲導管,采用動物模型驗證經心內膜途徑實施左心室APM化學消融的可行性和安全性,結果顯示利用導管內置ICE探頭可對左心室APM定位,以ICE圖像進行監控,能夠實現注射針進針和注射藥物的可視化操作,對左心室APM基底部實現安全消融,且消融灶體積與注射無水乙醇劑量有關,低劑量無水乙醇消融對乳頭肌功能無明顯影響。
PM解剖結構復雜,室性心律失常起源于此者并不少見。相較于左心室其他部位,乳頭肌在心腔內凸起,隨心室收縮活動度較大,尤其是左心室APM鄰近心室側壁,腱索、瓣膜等結構影響均可導管貼靠和到位,導致該區域內進行導管相關操作存在一定困難[9-10];為此臨床常于右心室放置一條ICE導管,用于觀察消融導管與PM之間的空間位置和貼靠關系,但保持導管與劇烈運動的PM之間的穩定性時常遇到困難[10-11];應用多條導管增加血管穿刺頻次,且ICE價格相對昂貴,致其使用受到限制[11-12]。
本研究所用導管進入心腔后,ICE圖像可清晰顯示左心室APM形態,雖探頭成像角度與市售商業化ICE導管(如AcuNav?)相比較為狹窄(約20°),但仍可清楚區分APM與左心室壁(圖1A);得益于該導管集ICE成像、心肌內注射消融等功能于一體的同軸化設計,無須放置其他導管即可明確消融導管與PM的空間位置,而插入PM的注射針在整個消融過程中亦可起到“錨定”作用,在一定程度上維持導管與PM之間貼靠的穩定性。
PM的特殊結構影響導管消融的穩定性,其解剖學異質性也使心律失常起源點往往位于心肌深部,這是目前消融技術面臨的另一個挑戰[2]。增加消融能量或利用冷鹽水灌注導管可能有助于提升消融效果,但存在可能導致心肌穿孔或心包壓塞的潛在風險[13],也可能給能量傳遞路徑上的正常心肌組織帶來損傷,甚至影響瓣膜功能[14]。利用心肌內注射導管直接注射化學藥物是達成心肌消融、減少室性心律失常發生的另一途徑[5],但在無影像學監控條件下進行心肌內注射存在心肌穿孔甚至心包壓塞風險[15]。本課題組前期動物實驗研究結果已證實了該導管用于實施室間隔化學消融的可行性和安全性[7]。本研究發現,PM內消融灶體積與注射無水乙醇劑量呈顯著正相關,提示通過調整注射藥量并結合ICE圖像對組織內高回聲區域擴布范圍進行實時監測,可在一定程度內控制性調節消融灶體積,且利用該導管可實現注射針進針和藥物注射的可視化操作,降低因進針過深導致心肌穿孔的風險,提高經心內膜注射化學消融PM的安全性;通過比較不同劑量組消融前后MRA、VC,發現較低注射劑量(0.2 ml、0.4 ml)短期內未對乳頭肌、二尖瓣功能產生明顯影響,提示采取心肌內注射消融策略無需經心內膜面釋放能量,通過ICE圖像監控注射針進針深度可實現APM基底部相對靶向性消融,而不對其體部及周圍組織造成過度損傷,最終實現可控、安全消融左心室APM的目標。
綜上所述,本研究利用自制ICE導管成像功能準確識別左心室APM,并實時監測心肌內注射過程,以低劑量無水乙醇在APM基底部形成范圍一定程度內可控的消融灶,且對二尖瓣功能無明顯影響,可能為消融治療左心室APM起源的VAS提供新的策略。

