應用細胞外體積分數評估肝細胞癌分化程度的初步探索
崔鳳嬌,李 琳,羅婭紅,于 慶,李 娜,王丹丹
1.遼寧省腫瘤醫院放射科,遼寧 沈陽 110042;
2.大連醫科大學研究生院,遼寧 大連 116044
肝細胞癌(hepatocellular carcinoma,HCC)目前居中國第4位常見惡性腫瘤及第3位腫瘤致死病因,據統計,中國每年約有30多萬人死于HCC,占全球肝癌死亡人數的一半左右。
HCC的發生多伴有肝臟纖維化的基礎病變,而肝臟纖維化過程伴隨著大量間質的增生。在微觀上,肝臟纖維化是膠原蛋白的過度沉積,細胞外間質合成與降解失平衡的過程[1]。目前有研究[2-4]表明,肝臟fECV(extracellular volume fraction)與肝臟纖維化相關,且伴隨著纖維化程度的增加,肝臟細胞外體積分數也會增加。腫瘤的發生、發展是復雜的過程,其伴隨細胞外微環境的改變,表現為細胞外基質的過量沉積、成纖維細胞的活化和富集,以及炎性反應細胞的浸潤等[5-7]。在肝臟纖維化的基礎上形成的肝癌不僅伴有基礎的間質成分的改變,同時也伴隨著腫瘤細胞與其微環境相互促進、共同演化。因此,本研究旨在探索肝臟多期動態增強CT掃描計算出的HCC患者腫瘤部分的fECV是否能夠用于評估HCC的分化程度。
1 資料和方法
1.1 研究對象
本研究為回顧性研究。選取2017年12月—2019年6月遼寧省腫瘤醫院患者41例。其中男性35例,女性6例。納入標準:① 于遼寧省腫瘤醫院手術且病理學確診為HCC的患者;② 術后病理學有明確的Edmondson-Steiner分級;③ 患者有慢性肝臟纖維化病史且術后病理學檢查顯示腫瘤周圍組織有肝硬化改變;④ 于遼寧省腫瘤醫院行肝臟多期動態增強CT檢查,且CT檢查日期與手術日期間隔小于1個月;⑥ CT 檢查前未進行針對肝癌的治療。排除標準:① CT掃描圖像有偽影的患者;② 有門靜脈癌栓、脂肪肝的患者。
1.2 CT成像方法
41例患者均采用日本Toshiba公司的Aquilion ONE 320層螺旋CT機行肝臟平掃和3期增強掃描。患者掃描前禁食水8 h,檢查前均進行碘過敏試驗且皆為陰性。3期增強掃描時間分別為動脈期25 s,門靜脈期60 s,平衡期140 s;掃描范圍從膈頂至肝臟的下緣。用非離子型對比劑碘普羅胺(300 mgI/mL)70 mL,流率3.0 mL/s,由高壓注射器經肘前靜脈注射,每期1次屏氣完成肝臟掃描。
1.3 測量方法
調取患者CT圖像平掃期和延遲期序列,圖像層厚皆為5 mm。選取患者腫瘤最大徑所在平面。在腹主動脈區域、腫瘤區域,腫瘤周圍正常肝實質區域分別選擇圓形感興趣區(region of interest,ROI)測量CT值(圖1)。其中,在腹主動脈區域選擇ROI時,避開血管壁(包括管壁的鈣化及附壁血栓)放置最大ROI;在腫瘤區域選擇ROI時,避開腫瘤內部壞死區和出血區,選擇腫瘤實性部分放置最大ROI,對于多發腫瘤患者,選取較大病灶放置ROI;在腫瘤周圍正常肝實質區域選擇ROI時,避開血管、膽管及其他肝內病變,選擇1~2 cm2的ROI。上述測量全部進行3次,分別取平均值,并將平衡期CT值與平掃期CT值相減,得到主動脈(Eaorta)、腫瘤區域(Etumor)及腫瘤周圍正常肝實質區域(Eliver)的絕對強化值。收集每例患者的血細胞比容(hematocrit,Hct)值。分別按以下公式計算fECV:fECV1(%)=Eliver×[100-Hct(%)]/Eaorta,fECV2(%)=Etumor×[100-Hct(%)]/Eaorta。fECV1為腫瘤周圍正常肝實質的fECV,fECV2為腫瘤區域的fECV。
1.4 統計學處理
所有統計學處理利用IBM SPSS 21.0軟件進行,定量資料以x±s表示,組間比較采用獨立樣本的t檢驗,P<0.05為差異有統計學意義;繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算fECV2的靈敏度和特異度,取靈敏度和特異度之和最大時為最佳診斷界值;曲線下面積(area under curve,AUC)為0.5~0.7表示診斷價值較低,0.7~0.9表示診斷價值中等,0.9以上表示診斷價值較高。
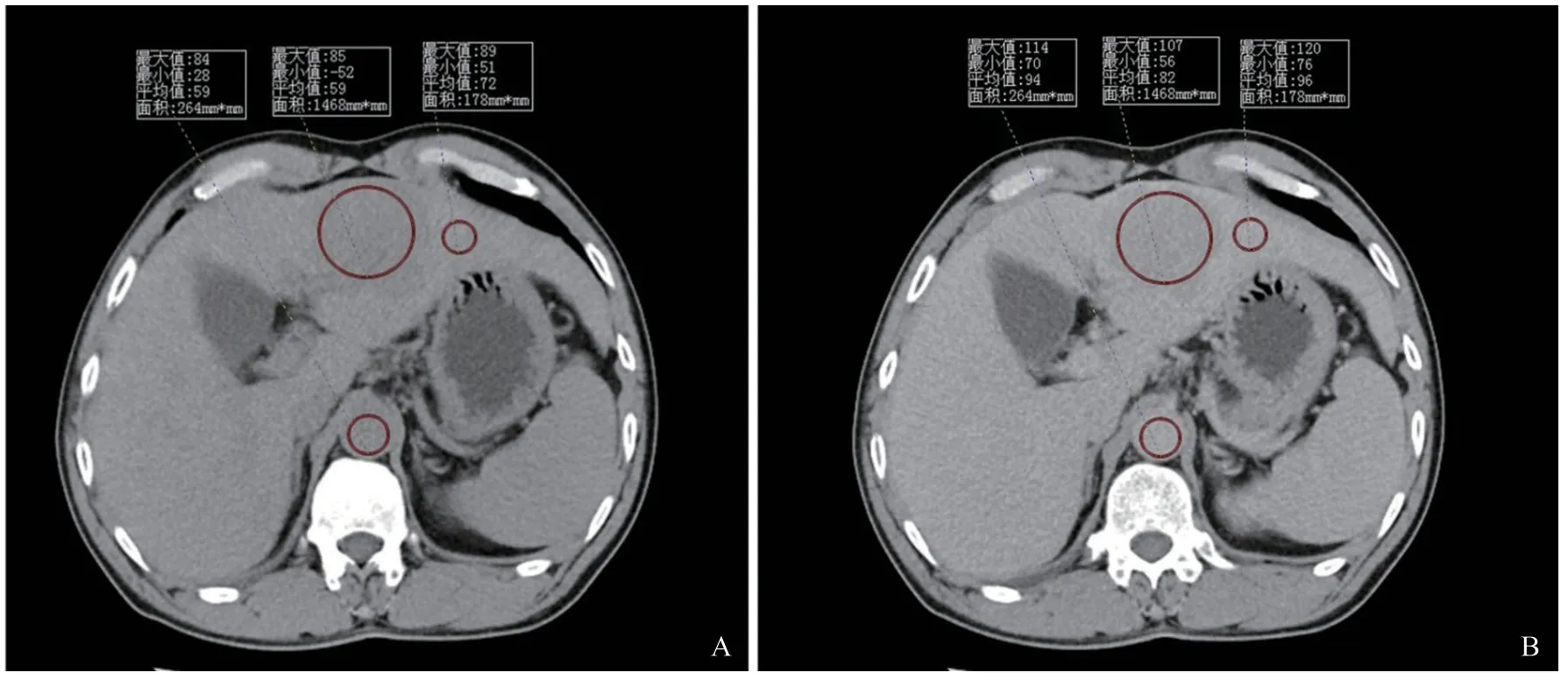
圖1 HCC患者平掃期和延遲期圖像
2 結 果
本研究共納入了41例患者,平均年齡為(56.0±8.6)歲,其中高分化組21例[Ⅰ級2例,Ⅱ級19例;平均年齡為(56.5±7.8)歲],低分化組20例[Ⅲ級18例,Ⅳ級2例;平均年齡為(55.3±9.5)歲]。
HCC高分化組和低分化組Eaorta、Eliver、Etumor、Hct比較見表1;高分化組和低分化組fECV1、fECV2值比較見表2。
Etumor、fECV2評估HCC分化程度的箱圖及ROC曲線見圖2~5。
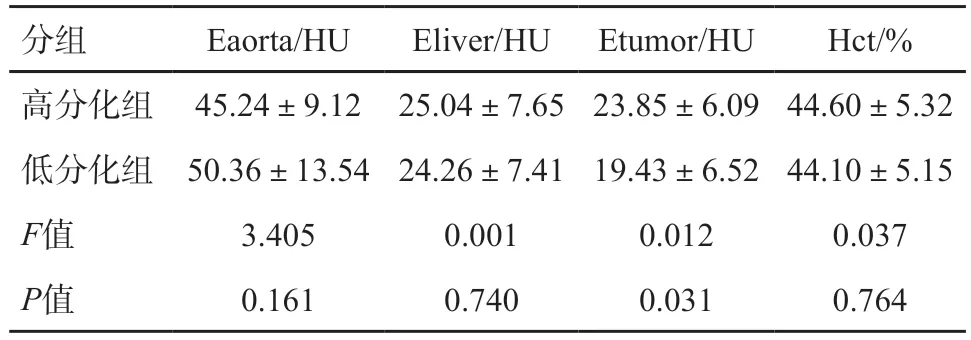
表1 HCC高分化組和低分化組Eaorta、Eliver、Etumor、Hct比較

表2 高分化組和低分化組fECV值比較
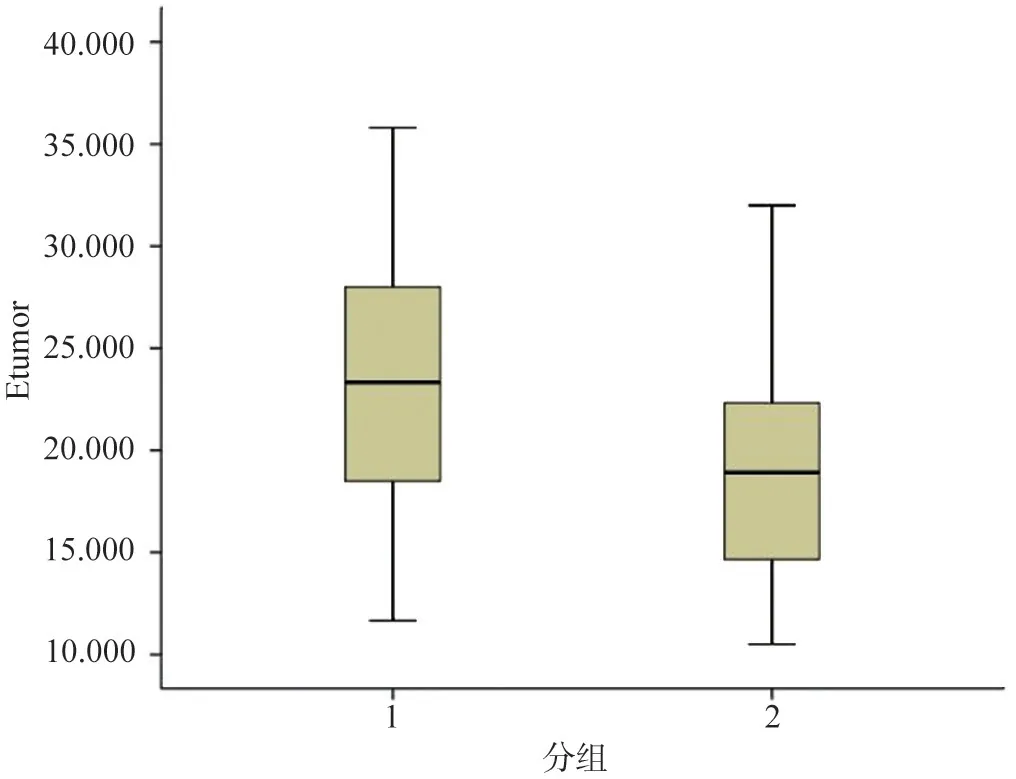
圖2 高分化組和低分化組腫瘤部分絕對強化值Etumor箱形圖
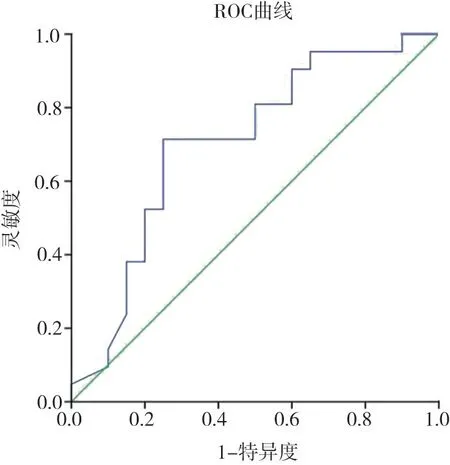
圖3 Etumor評估HCC分化程度的ROC曲線
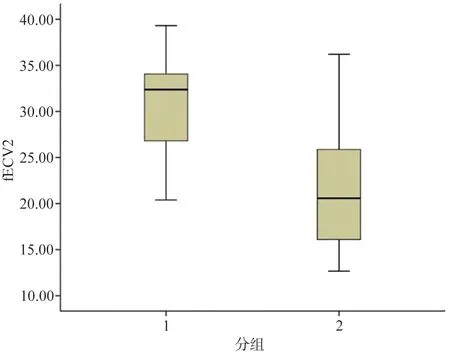
圖4 高分化組和低分化組fECV2值箱形圖
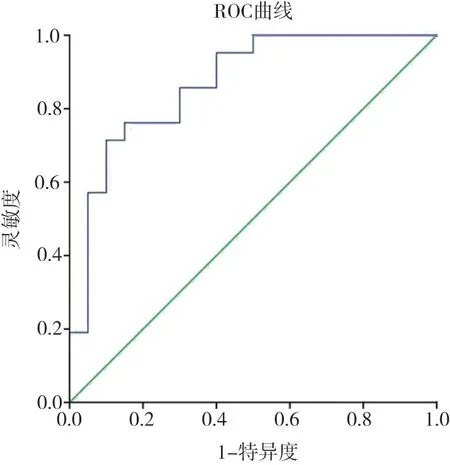
圖5 fECV2值評估HCC分化程度的ROC曲線
通過ROC曲線分析,Etumor值評估HCC分化程度的AUC為0.705(95% CI:0.540~0.869);高分化組與低分化組診斷界值為21.83,靈敏度為62%,特異度為75%。fECV2值評估肝細胞癌分化程度的AUC為0.869(95% CI:0.759~0.979);高分化組與低分化組診斷界值為28.56%,靈敏度為71%,特異度為90%。
3 討 論
肝癌進展快、惡性程度高,有研究表明,肝癌的病理分化程度是影響患者治療后復發及生存期限的重要因素,低分化肝癌與高分化肝癌相比更易發生轉移[8],高分化腫瘤預后優于低分化腫瘤[9]。HCC的Edmondson-Steiner分級是肝癌患者預后的獨立危險因素[10]。本研究旨在探索能否通過fECV評估肝癌分化程度,從而為臨床提供指導。
本研究發現,HCC患者腫瘤部分的絕對強化值Etumor及fECV2在高分化組和低分化組差異有統計學意義。應用fECV評估HCC的分化程度,是從一個新的角度出發,通過評估細胞外間質的量來區分HCC的分化,其靈敏度、特異度、診斷效能比應用絕對強化值Etumor評估分化程度高。
王東旭[11]和周江楓[12]研究表明,增強掃描呈廓清型的HCC病理多為低分化,持續強化型多為高分化。故作者認為不同分化程度HCC腫瘤部分絕對強化值的差異,與其強化方式有關。在本研究中,高分化組腫瘤絕對強化值為(23.85±6.09)HU,低分化組為(19.43±6.52)HU,高分化組總體強化程度高于低分化組,這與前人研究相符合。
Yoon等[13]和Guo等[14]研究表明,肝臟纖維化會使肝臟的fECV增加,且肝臟纖維化程度與fECV成正相關。在本研究中,所有患者皆有肝硬化病史且術后病理學檢查皆有報告腫瘤周圍正常組織有肝硬化改變,在結果中fECV1值在高分化組和低分化組之間差異無統計學意義(P=0.319),表明兩組的患者的肝硬化程度無顯著差異。fECV2值在高分化組和低分化組之間差異有統計學意義(P<0.01),且fECV2值在高分化組較高,在低分化組較低。結果說明,高分化的HCC比低分化的HCC間質量更多,作者認為造成含量差異的原因,可能與肝癌患者肝硬化的基礎病變相關,肝硬化發展成為肝癌的過程中,較高級別的肝癌與較低級別的肝癌相比,高級別肝癌細胞與肝細胞異質性更小,對細胞外微環境影響可能更小,間質的變化也更小,在我們的研究中,肝癌周圍肝臟實質比肝癌本身的fECV要高,故造成高級別的HCC的fECV較低級別HCC高。
基于增強CT計算fECV有以下優勢:首先,與組織學檢查相比,應用CT計算的fECV是無創性檢查,易于執行且無組織學檢查帶來的并發癥風險;此外,有學者應用磁共振成像(magnetic resonance imaging,MRI)化學位移成像、DWI及ADC值來評估肝癌病理學分級[15-16],CT相比MRI,掃描時間短,空間分辨率高,可用于評估有MRI禁忌證的患者,如幽閉恐懼癥、體內有金屬植入等。
目前雖然無明確的對比劑在肝臟到達平衡期的時間,有研究表明,肝臟的延遲期最早是從2 min開始建立的[17]。在肝臟纖維化的fECV的研究中部分學者認為140 s的延遲相不足以到達平衡期,而使用了更長時間的延遲相[18]。本研究旨在對肝臟腫瘤部分進行研究,肝臟腫瘤相比肝實質血供豐富且有大量新生血管,筆者認為理論上到達平衡期的時間早于肝實質,140 s延遲期計算的fECV可用來進行初步探索。
本研究也存在不足:此項研究為回顧性研究,存在選擇偏倚;本研究樣本量較小,尚需進一步大樣本量的研究;在本研究中肝細胞癌病理分級為Ⅰ和Ⅳ級的樣本較少,未來以期豐富樣本,做進一步研究。
綜上所述,我們認為在肝硬化背景下,HCC的fECV能夠用于評估其分化程度,且其診斷效能中等;與較低分化程度的HCC比較,較高分化程度的HCC的fECV較高。

