雙源計算機斷層掃描在肺癌病理類型及臨床分期中的應用價值△
杜軍華,喬洪源,曹勁松
三峽大學第二人民醫院1腫瘤放化療科,2放射科,湖北 宜昌 443000
肺癌是最常見的惡性腫瘤之一,發病率及病死率均高居惡性腫瘤之首,鱗狀細胞癌是主要的病理類型,占所有肺癌類型的85%[1-2]。多因素Cox分析結果顯示,臨床分期的診斷是影響肺癌患者預后的主要因素,TNM分期不僅可以指導治療方案的選擇,還可評估患者預后[3]。此外,準確判斷肺癌的病理類型直接影響患者治療方案的選擇和預后。雙源計算機斷層掃描(CT)雙能量技術以不同能量X線同時照射組織,從而反映不同物質X線特征的能譜曲線圖[4],分辨力高,在確保圖像質量基礎上,縮短了掃描時間,又極大地降低了對病灶的輻射劑量,減輕了對人體重要器官的影響[5]。近年來,隨著雙源CT技術的飛速發展,掃描效率得到了增強提高,反映了患者病灶信息及靜動脈期碘覆蓋值、標準化碘,從形態、成分、血流灌注不同能量下CT值、病灶和靜動脈碘含量各方面對肺癌的診斷及鑒別診斷、療效的評估提供重要的價值[6-7]。本研究旨在分析雙源CT多項定量參數在肺腺癌、鱗狀細胞癌的診斷、鑒別診斷及肺癌臨床分期中的作用,為肺癌的治療方案的制訂提供更為準確、更有價值的影像學信息,現報道如下。
1 資料與方法
1.1 一般資料
選取2017年1月至2018年12月三峽大學第二人民醫院收治的肺癌患者。納入標準:①均經病理學檢查證實為肺癌,且均為初次就診;②行雙源CT檢查前未進行手術、放化療和靶向治療等;③臨床資料和影像學資料完整;④雙源CT圖像質量符合要求。排除標準:①合并其他嚴重肺部疾病;②對對比劑過敏;③合并其他系統惡性腫瘤。依據納入和排除標準,本研究共納入86例肺癌患者,其中男53例,女33例;年齡38~73歲,平均年齡為(46.15±5.32)歲;肺腺癌55例,鱗狀細胞癌31例。
1.2 雙源CT 檢查方法
所有患者患者仰臥于CT床,行雙源CT雙能量增強掃描,經肘靜脈以3 ml/s流速注入濃度300 mg/ml碘海醇100 ml,動脈期和靜脈期分別在對比劑注射后25 s、30 s進行雙能量CT掃描,掃描范圍為胸廓入口到腎臟中部。雙能管電壓分別為140 kV和100 kV,掃描層厚2 mm,2 mm重建,螺距0.7,準直器32 mm×0.6 mm,卷積核D30f。由2名資深專業影像學診斷醫師對所獲得的圖像于MMWP工作站應用雙能量后處理軟件進行分析。分別將雙期增強掃描140 kV和100 kV的圖像通過Dual-energy程序、Liver-VNC模式獲得虛擬平掃圖像及碘圖,以Overlay圖像作為反映肺癌病灶增強后凈增值,經Volume程序選擇目標病灶,選取肺癌原發腫瘤最大層面劃取感興趣區,盡量避開病灶內囊性區、鈣化區、周圍大血管、壞死、空洞、出血及周圍阻塞性改變的肺組織,計算整體病灶CT衰減值及標準化碘濃度(normalized iodine concentration,NIC),分別測量3次取平均值。
1.3 觀察指標
依據病理學診斷,比較不同病理類型肺癌患者各期凈增CT值。參考第8版國際肺癌TNM分期標準[8],將86例肺癌患者進行TNM分期,記錄不同TNM分期肺癌患者NIC,NIC=原發灶碘濃度/同層主動脈碘濃度。繪制受試者工作特征(receiver operating characteristic,ROC)曲線,分析NIC對肺癌TNM分期的診斷效能。
1.4 統計學方法
采用SPSS 20.0軟件對所有數據進行統計分析,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,多組間兩兩比較采用LSD-t檢驗;兩組間比較采用兩獨立樣本t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗;以ROC曲線及曲線下面積(area under the curve,AUC)分析NIC對肺癌TNM分期的診斷效能;以P<0.05為差異有統計學意義。
2 結果
2.1 不同病理類型肺癌患者凈增CT值比較
依據病理學診斷,86例肺癌患者中腺癌55例,鱗狀細胞癌31例,分別作者腺癌組和鱗狀細胞癌組,結果顯示,腺癌組患者在主動脈達峰時及達峰后第100秒的凈增CT值均高于鱗狀細胞癌患者,差異均有統計學意義(t=5.039、3.597,P<0.05);達峰后第40、60秒,兩組患者凈增CT值比較,差異均無統計學意義(P>0.05)。(表1)
表1 不同病理類型肺癌患者各期凈增CT值比較(Hu,±s)

表1 不同病理類型肺癌患者各期凈增CT值比較(Hu,±s)
注:*與鱗狀細胞癌組比較,P<0.05
掃描期主動脈達峰時第40秒第60秒第100秒腺癌組(n=55)31.27±5.35*37.72±9.56 39.68±10.23 43.86±11.23*鱗狀細胞癌組(n=31)25.75±4.59 35.41±7.39 36.77±9.59 35.68±10.72
2.2 不同TNM 分期肺癌患者NIC值的比較
依據第8版國際肺癌TNM分期標準將86例肺癌患者中Ⅰ期13例,Ⅱ期26例,Ⅲ期34例,Ⅳ期13例,結果顯示,隨TNM分期的增加,肺癌患者的NIC值隨之增加,差異有統計學意義(F=23.202,P<0.05),其中Ⅲ、Ⅳ期肺癌患者的NIC值均高于Ⅰ期患者,差異均有統計學意義(t=5.826、6.858,P<0.05),Ⅲ、Ⅳ期肺癌患者的NIC值均高于Ⅱ期患者,差異均有統計學意義(t=8.034、7.548,P<0.05)。(表2)
表2 不同TNM分期肺癌患者NIC值的比較(±s)

表2 不同TNM分期肺癌患者NIC值的比較(±s)
注:a與Ⅰ期肺癌患者比較,P<0.05;b與Ⅱ期肺癌患者比較,P<0.05
TNM分期Ⅰ(n=13)Ⅱ(n=26)Ⅲ(n=34)Ⅳ(n=13)NⅠC值0.25±0.09 0.28±0.04 0.44±0.11a b 0.56±0.14a b
2.3 NIC對肺癌TNM 分期的診斷效能
NIC診斷肺癌TNM分期AUC為0.925(95%CI:0.855~0.995),靈敏度為86.1%,特異度為88.6%,最佳截斷值為0.425。(圖1)
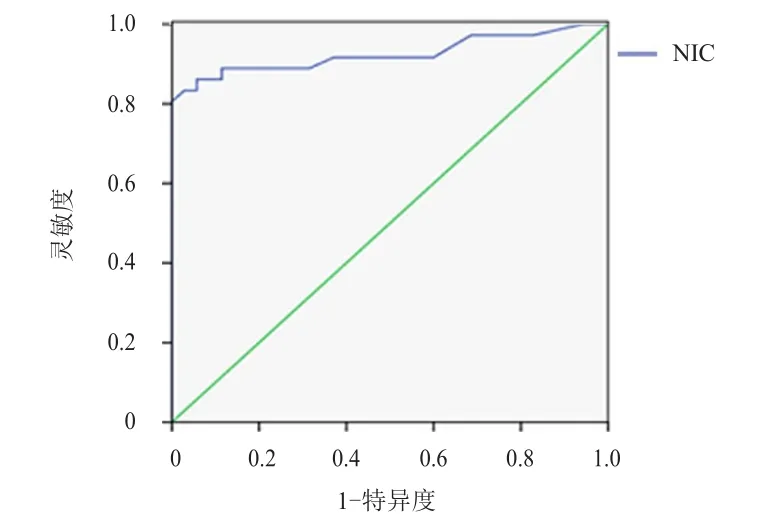
圖1 NIC診斷肺癌TNM分期的ROC曲線
3 討論
目前,肺癌的臨床治療手段包括外科手術治療、放化療和靶向治療等,不同病理類型的非小細胞肺癌(non-small cell lung cancer,NSCLC)的診療方案也不盡相同,因此,在肺癌的臨床治療中早期準確鑒別病理類型對治療方案、預后評估至關重要。目前病理組織活檢是診斷NSCLC病理類型的金標準,但它是一種有創技術,患者接受程度差,并且局部活檢標本在反映腫瘤生物異質性方面有一定的局限性。CT是一種無創且有效的的檢查方法,術前即可對NSCLC的病理類型及臨床分期進行診斷,對指導肺癌患者個體化治療方案的選擇極為重要。
雙源CT成像及物質分離技術能顯示并檢測腫塊的碘含量,并對腫塊內部的血供情況進行評估,在NSCLC非手術治療早期療效評估中,腫瘤總碘含量較最大徑及CT值更為靈敏,潛在的臨床價值較高[9]。雙源CT雙能量成像技術是近年來興起的成像技術,其擁有兩套X線球管和兩套探測器,因不同組織和器官對不同能量的X線衰減值的差值各不相同,通過專用系統獲得的能譜曲線,簡稱能量圖[10]。與常規CT相比,雙源CT雙能量成像輻射劑量低、掃描速度快,可提供有效的原子序數、碘基圖、水基圖等更多的分析方法和定量指標,在判斷腫瘤病理類型、分化程度、是否侵犯周圍臟器、淋巴結是否轉移等方面具有較大優勢。但有關CT雙能量成像技術在肺癌術前組織學分級及臨床分期報道較少。本研究旨在分析雙源CT多項定量參數在肺腺癌、鱗狀細胞癌的診斷、鑒別診斷及肺癌臨床分期中的作用,為肺癌的治療方案的制訂提供更為準確、更有價值的影像學信息。
本研究結果顯示,肺腺癌患者主動脈達峰時及達峰后第100秒的凈增CT值均高于鱗狀細胞癌患者,差異均有統計學意義(P<0.05),主要是因為不同病理類型的肺癌組織起源(鱗狀細胞癌的內部結構相對較為致密,肺腺癌為腺腔樣或腺管狀結構)、血管生成情況和病灶滲透性差異不同導致[11]。研究顯示,肺腺癌與肺鱗狀細胞癌的細胞增殖及腫瘤組織的生長速度、腫瘤實質與間質的比例、壞死程度等微觀改變均有差異,導致二者強化程度、結構、密度不同,引起CT凈增值時間-密度曲線差異,這也為雙源CT碘定量分析用于肺腺癌和肺鱗狀細胞癌鑒別診斷提供理論基礎[12]。肺癌病理類型不同具有不同的生物學特征,鱗狀細胞癌、腺癌在分化程度方面存在明顯差異,腫瘤的分化程度與腫瘤內的新生血管及強化程度密切相關,普通CT對判定肺癌的病理類型有局限性,而雙源CT能量成像中特有的物質分離技術。張俊強和王戰[10]分析52例腺癌和34例肺鱗狀細胞癌患者各期CT凈增值和時間-密度曲線,結果顯示,肺腺癌主動脈達峰時間短于肺鱗狀細胞癌,腺癌組患者達峰時、達峰后第60、100秒的凈增CT值均明顯高于鱗狀細胞癌組患者,與本研究結果基本一致。
精準的術前分期對患者的后續治療提供了依據,雙源CT多參數模式對肺癌TNM分期具有重要意義。本研究結果顯示,隨TNM分期的增加,肺癌患者的NIC值隨之增加,表明肺癌患者的NIC越高,TNM分期進展可能越嚴重,NIC評估肺癌TNM分期的診斷靈敏度為86.1%,特異度為88.6%。不同的球管能量在判斷腫瘤分化靈敏度時差距極大,有助于判斷肺腺癌的組織學分級[13]。雙能量成像中的碘濃度、NIC、動脈期斜率可作為術前判斷實性肺腺癌淋巴結轉移及分化程度的重要預測指標之一[14]。彭丹丹等[15]對55例肺癌患者采用雙源CT常規平掃及雙能增強掃描,獲得腫塊靜脈期NIC,結果顯示,肺癌患者的NIC與原發灶大小無明顯相關性,與臨床分期呈正相關,對臨床分期診斷靈敏度為96.0%,特異度為73.3%,雙源CT雙能量成像參數定量分析對預測肺癌轉移和評估TNM分期意義重大。
綜上所述,雙源CT定量參數能間接反映腫瘤的病理類型、腫塊內部血供情況、分化程度、組織浸潤情況及淋巴結轉移情況等,在肺腺癌和鱗狀細胞癌及臨床分期的診斷中發揮重要作用。

