CrkⅡ表達水平對喉癌細胞Hep-2增殖、遷移及侵襲的影響
劉東東,周李芳,楊華暉
荊州市中醫醫院耳鼻咽喉頭頸外科,湖北 荊州 448002
喉癌是臨床常見的頭頸部惡性腫瘤,其中,絕大多數為喉鱗狀細胞癌,主要表現為呼吸困難、發音困難、聲音嘶啞等臨床癥狀,其具體發病機制目前尚未完全明確,可能與飲酒、吸煙、咽喉反流、胃食管反流、微量元素缺乏和放射線等因素有關,且通常多種因素相互作用[1-2]。根據發生位置的不同,喉癌可分為聲門上型、聲門型和聲門下型,具有局部腫瘤浸潤、區域淋巴結轉移、遠處擴散等特征。接頭蛋白CrkⅡ為原癌基因Crk表達的產物,在蛋白質之間起介導作用,介導細胞之間的信號轉導[3-4]。CrkⅡ與細胞骨架重構、侵襲、增殖、遷移及凋亡等均有一定關系[5]。本研究分析CrkⅡ表達對喉癌細胞Hep-2增殖、遷移及侵襲的影響,為喉癌患者的臨床診療提供參考,現報道如下。
1 資料與方法
1.1 一般資料
選取2012年12月至2018年12月荊州市中醫醫院收治的喉癌患者,所有患者均經病理檢查確診為喉鱗狀細胞癌,年齡為38~74歲,平均(56.27±5.09)歲。本研究共納入108例喉癌患者,收集其喉癌組織及癌旁正常組織(距離腫瘤邊緣>0.5 cm)的石蠟存檔標本。喉鱗狀細胞癌細胞Hep-2由本院頭頸腫瘤課題組提供。
1.2 主要試劑與儀器
磷酸鹽緩沖液(phosphate buffer saline,PBS)、0.25%胰蛋白酶、RPMI-1640均購自美國Hyclone公司,Opti-MEM購自美國Gibco公司,pGPU6/RFP/Neo載體購自上海吉瑪制藥技術有限公司。倒置熒光顯微鏡、水浴鍋均購自德國Leica公司,超凈工作臺購自蘇州金凈凈化設備科技有限公司,數顯恒溫水浴鍋購自常州金南儀器制造有限公司,熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)儀購自美國Bio-Rad公司。
1.3 實驗方法
1.3.1 免疫組化染色方法及結果判定 采用免疫組化染色法檢測喉癌組織中CrkⅡ蛋白的表達情況,CrkⅡ蛋白主要表達于細胞質,少許表達于細胞核,細胞質和細胞核內出現棕黃色顆粒為陽性細胞[6]。隨機選取5個高倍視野,對陽性染色細胞數量和腫瘤細胞總數進行計算。依據陽性細胞所占百分比評分:≤5%計0分,6%~25%計1分,26%~50%計2分,51%~75%計3分,>75%計4分。依據染色強度評分:無色計0分,淺棕色計1分,棕黃色計2分,深棕色計3分。染色強度評分和陽性細胞所占百分比評分相加,≤3分為陰性表達,>3分為陽性表達。
1.3.2 CrkⅡRNA干擾質粒構建與驗證 通過NCBI檢索CrkⅡ基因序列,設計干擾小RNA(small interfering RNA,siRNA)序列,基因 ID 為1398,mRNA 序列號為 NM-016823。使用 Invitrogen公司在線設計軟件設計靶向CrkⅡ基因的siRNA干擾序列,依據序列設計原則,經NCBI行BLAST同源對比后,篩選出最優siRNA序列,并設計一條無關序列作為陰性對照。針對CrkⅡ基因的shRNA序列插入至質粒載體內,包含目的基因的序列全部無誤,表明CrkⅡRNA干擾質粒構建成功。
1.3.3 載體選擇與構建 選取pGPU6/RFP/Neo表達載體,此載體內含有Neomycin抗性篩選標記基因和紅色熒光蛋白(red fluorescent protein,RFP)表達基因,以便篩選穩定表達的單克隆細胞系并檢測轉染效率,于Bbsl和BamH1酶切位點插入設計好的siRNA序列,并委托上海吉瑪制藥技術有限公司完成CrkⅡRNA干擾質粒的構建和測序。
1.3.4 細胞培養 ①細胞復蘇:取出凍存的Hep-2細胞,置入預熱(39℃)水浴鍋內,解凍后將細胞懸液吸出,置于離心管內,加入含10%胎牛血清的1640培養基10 ml,選取1支廢棄離心管配平,離心后加入完全培養基,重懸細胞并充分吹打,預防細胞呈團塊,將細胞懸液移至培養瓶內,補充完全培養基,置于培養箱內培養。②細胞傳代:細胞融合至80%時,倒掉舊培養液,立刻加入2 ml無菌PBS,沖洗2次后將1 ml 0.25%胰蛋白酶加入培養瓶,翻轉使細胞與胰蛋白酶充分接觸,于培養箱內培養1 min,巴氏吸管吸取瓶內培養液,反復輕輕吹打瓶壁細胞,使之從瓶壁脫落并形成單個細胞懸液,以1∶2或1∶3的比例接種于T25細胞培養瓶內,再置入培養箱內進行培養,第2天換液。③細胞凍存:將完全培養基(含20%胎牛血清)和二甲基亞砜(dimethyl sulfoxide,DMSO)按照9∶1的比例制備凍存液,融合度為70%~80%時選取細胞,于倒掉原有培養基的培養瓶中加入2 ml PBS,沖洗2次,PBS洗掉后加入1 ml 0.25%胰蛋白酶,貼壁細胞完全消失后加入培養基,將細胞吹打為單細胞懸液,以2500 r/min的離心速度離心6 min后,去除原培養液和胰蛋白酶,加入至預先配置好的凍存培養液,使用巴氏吸管將細胞吹散為細胞懸液,采用1 ml凍存管分裝。
1.3.5 細胞轉染與分組 將細胞接種至6孔板內,補足2 ml無抗生素完全培養基,確保轉染時融合度為60%~80%,于150 ml無血清培養基Opti-MEM內稀釋4.0 mg NDA,搖勻;于150 ml無血清培養基Opti-MEM內稀釋10 ml LipofectamineTM2000試劑,搖勻后孵育6 min,將稀釋的LipofectamineTM2000試劑加入至質粒稀釋液內,室溫下孵育20 min,將上述轉染復合物加入至各個培養孔內,并上下左右翻轉使細胞與轉染復合物充分接觸,后放置培養箱內培養5 h,去除轉染復合物,加入不含抗生素的完全培養基。將實驗細胞分為空白對照組(無轉染質粒)、陰性對照組(轉染陰性對照質粒)和實驗組(轉染CrkⅡ干擾質粒)。將CrkⅡRNA質粒轉染至Hep-2細胞內,轉染24、48、72 h后,使用倒置熒光鏡觀察RFP的表達情況,細胞呈現紅色熒光表明CrkⅡRNA干擾質粒能夠對Hep-2細胞進行轉染,且Hep-2細胞可穩定表達CrkⅡ。
1.3.6 實時熒光定量PCR檢測CrkⅡmRNA表達情況 轉染后提取細胞總RNA,合成cDNA第一條鏈,行實時PCR擴增,CrkⅡ的上游引物為5'-GATTGAGATGATTTTGGAG-3',下游引物為5'-GTATGTTAAGTATATGATTG-3',擴增片段長度是482 bp;內參β-actin的上游引物為5'-CTTGATCGTACGTAGCCTGA-3',下游引物問5'-GTGTAGTGTACTGTCATGCA-3',擴增片段長度是 482 bp。42℃預變性,60 min;70℃,15 min;PCR反應條件:94 ℃,45 s;55 ℃,50 s;72 ℃,75 s,共40次循環。
1.3.7 蛋白質印跡法(Western blot)檢測CrkⅡ蛋白表達情況 轉染后提取總蛋白,組織裂解后上樣電泳,初始電壓為80 V,溴酚藍染料前緣進入至分離膠上緣后,提高電壓至100 V,溴酚藍泳出分離膠下緣后電泳結束。采用半干電轉移儀將蛋白質轉移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜內,以30 mA恒流連續處理90 min。取出PVDF膜后,采用5%TBST脫脂奶粉封閉,振蕩60min。結束封閉后采用TNS-T漂洗液洗膜3次,每次10 min,將膜轉移至雜交袋內,加入適量漂洗液稀釋抗體,封口后于4℃下孵育過夜;用TBST漂洗液洗膜3次,每次10 min,加入漂洗液稀釋的辣根過氧化物酶標記二抗,振蕩60 min。PVDF膜置于電化學發光(electrochemiluminescence,ECL)顯色液內振蕩溫育5 min,暗室下曝光、顯影和定影。清水沖洗后,晾干掃描,采用IPP軟件對掃描圖像的目的條帶行灰度分析。
1.3.8 噻唑藍法檢測Hep-2細胞增殖情況 采集處于對數生長期的細胞,細胞懸液含量為1×104/ml,96孔板接種,倒入200 ml細胞懸液,放入培養箱中培養;然后,每孔內加入劑量為5 mg/ml的噻唑藍(methylthiazolyl tetrazolium,MTT)溶液20 ml,于培養箱內繼續培養4 h;倒掉原MTT培養液,加入DMSO溶解液150 ml,培養板置于搖床振蕩8 min,充分溶解藍紫色結晶甲瓚。于24、48、72 h分別取一塊96板孔,測定各孔的光密度(optical density,OD)值。
1.3.9 Transwell實驗檢測細胞侵襲能力 于無血清培養液中“饑餓”處理細胞,將細胞重懸計數后稀釋至1×105/ml,接種至Transwell小室中,添加0.5 ml細胞懸液,于24孔板下室加入0.75 ml含10%FBS的完全培養液,培養箱內培養24 h,培養孔內加入1 ml 4%甲醛溶液,固定10 min,PBS洗滌,然后,每孔加入1 ml 0.1%結晶紫溶液,染色30 min,PBS洗滌3次,晾干后置于顯微鏡下觀察。
1.3.10 細胞劃痕實驗檢測Hep-2細胞遷移能力采集細胞并計數,將重懸細胞濃縮至5×105/ml,6板孔內分別加入細胞懸液2 ml,細胞融合度為80%~90%時,采用加樣槍頭在6孔板底中劃痕,PBS沖洗,去除脫落細胞,而后加入培養液,在培養箱中培養。利用軟件測量并計算培養24、48 h后細胞的遷移率。
1.4 統計學分析
采用SPSS 19.0軟件對數據進行統計分析,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析和重復測量方差分析,多組間兩兩比較采用LSD-t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 CrkⅡ蛋白表達情況的比較
免疫組化染色結果顯示,喉癌組織中CrkⅡ蛋白的陽性表達率為68.52%(74/108),明顯高于癌旁正常組織的9.26%(10/108),差異有統計學意義(χ2=4.157,P<0.01)。
2.2 不同臨床特征喉癌患者喉癌組織中CrkⅡ蛋白的表達情況
臨床分期為Ⅲ~Ⅳ期、組織分化程度為中低分化、有淋巴結轉移喉癌患者喉癌組織中CrkⅡ蛋白的陽性表達率均高于臨床分期為Ⅰ~Ⅱ期、組織分化程度為高分化、無淋巴結轉移的喉癌患者,差異均有統計學意義(P<0.05);不同年齡、性別喉癌患者喉癌組織中CrkⅡ蛋白的陽性表達率比較,差異均無統計學意義(P>0.05)。(表1)
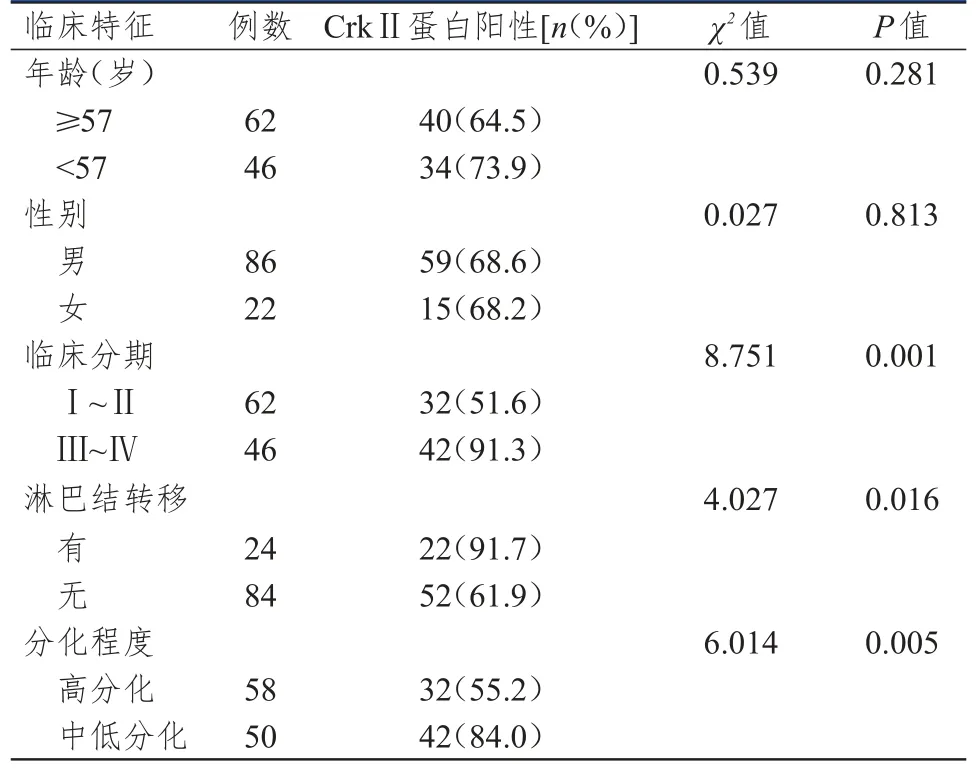
表1 不同臨床特征的108例喉癌患者喉癌組織中CrkⅡ蛋白的陽性表達情況
2.3 CrkⅡRNA 干擾質粒測序及轉染情況
CrkⅡRNA干擾質粒測序結果顯示,針對CrkⅡ基因的shRNA序列插入至質粒載體內,包含目的基因的序列全部準確無誤,CrkⅡRNA干擾質粒構建成功。CrkⅡRNA轉染至Hep-2細胞內72 h時,Hep-2細胞中可觀察到穩定表達的RFP。
2.4 喉癌細胞Hep-2中CrkⅡmRNA的表達情況
實時熒光定量PCR檢測結果顯示,空白對照組、陰性對照組、實驗組喉癌細胞Hep-2中CrkⅡmRNA 的表達水平分別為(1.00±0.00)、(1.03±0.02)、(0.52±0.02),3組比較,差異有統計學意義(F=4.097,P<0.01)。實驗組喉癌細胞Hep-2中CrkⅡmRNA的相對表達量低于陰性、空白對照組,差異均有統計學意義(t=3.498、4.117,P<0.05)。
2.5 喉癌細胞Hep-2中CrkⅡ蛋白的表達情況
空白對照組喉癌細胞Hep-2中CrkⅡ蛋白的相對表達量為(0.84±0.03),陰性對照組喉癌細胞Hep-2中CrkⅡ蛋白的相對表達量為(0.83±0.04),實驗組喉癌細胞Hep-2中CrkⅡ蛋白的相對表達量為(0.46±0.03),3組比較,差異有統計學意義(F=4.014,P=0.003)。實驗組Hep-2細胞中CrkⅡ蛋白的相對表達量低于陰性對照組、空白對照組,差異均有統計學意義(t=4.509、5.226,P<0.05)。
2.6 CrkⅡ蛋白表達下調對Hep-2細胞增殖能力的影響
MTT檢測結果顯示,Hep-2細胞培養24、48、72 h時,3組細胞的OD值比較,差異均有統計學意義(P<0.05)。實驗組Hep-2細胞不同時間點的OD值均低于空白對照組和陰性對照組,差異均有統計學意義(P<0.05)。(表2)
表2 不同組別不同時間點轉染后Hep-2細胞OD值的比較(±s)
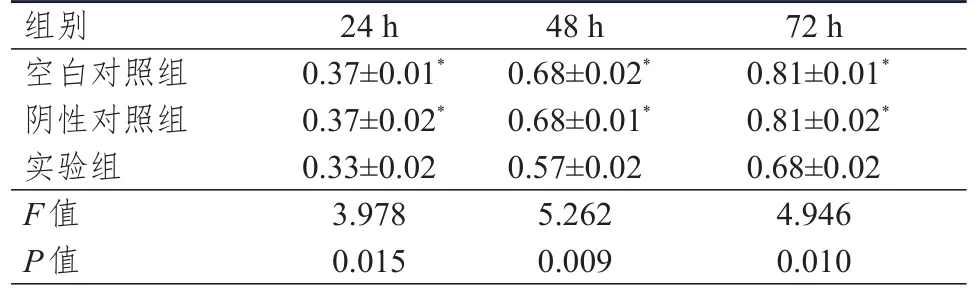
表2 不同組別不同時間點轉染后Hep-2細胞OD值的比較(±s)
注:*與實驗組比較,P<0.05
組別空白對照組陰性對照組實驗組F值P值24 h 0.37±0.01*0.37±0.02*0.33±0.02 3.978 0.015 48 h 0.68±0.02*0.68±0.01*0.57±0.02 5.262 0.009 72 h 0.81±0.01*0.81±0.02*0.68±0.02 4.946 0.010
2.7 CrkⅡ蛋白表達下調對Hep-2細胞侵襲能力的影響
Transwell實驗檢測結果顯示,CrkⅡ蛋白的表達下調后,實驗組穿過基質膜至下室的細胞數目為(98±6),陰性對照組穿過基質膜至下室的細胞數目為(150±7),空白對照組穿過基質膜至下室的細胞數目為(154±6),3組比較,差異均有統計學意義(F=6.294,P<0.05)。實驗組穿過基質膜至下室的細胞數目低于陰性對照組和空白對照組,差異均有統計學意義(t=4.509、3.921,P<0.05)。(圖1)
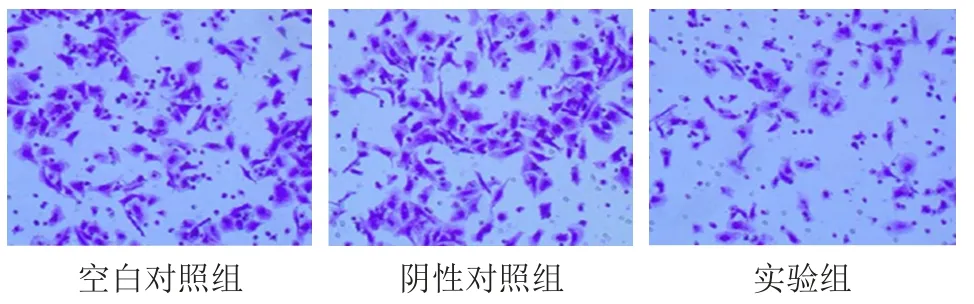
圖1 Transwell 檢測不同組別Hep-2細胞的侵襲能力(SP法染色,×200)
2.8 CrkⅡ基因沉默對Hep-2細胞遷移能力的影響
細胞劃痕實驗檢測結果顯示,轉染24 h時,3組細胞的遷移率比較,差異無統計學意義(P>0.05)。轉染48 h時,3組細胞的遷移率比較,差異有統計學意義(P<0.01)。轉染48 h時,實驗組細胞的遷移率低于陰性對照組、空白對照組,差異均有統計學意義(P<0.05)。(表3)
表3 不同組別不同時間點Hep-2細胞遷移率的比較(%,±s)
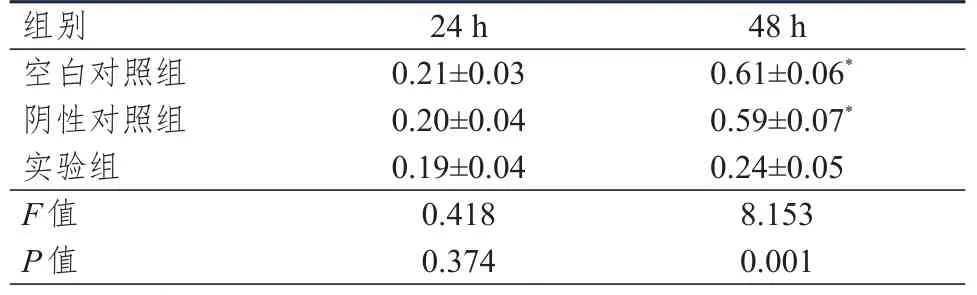
表3 不同組別不同時間點Hep-2細胞遷移率的比較(%,±s)
注:*與實驗組比較,P<0.05
組別空白對照組陰性對照組實驗組F值P值24 h 0.21±0.03 0.20±0.04 0.19±0.04 0.418 0.374 48 h 0.61±0.06*0.59±0.07*0.24±0.05 8.153 0.001
3 討論
本研究結果顯示,CrkⅡ蛋白在喉癌組織中高表達,在癌旁正常組織內僅少量表達,說明CrkⅡ蛋白可能與喉鱗狀細胞癌的發生與進展關系密切。本研究中,伴淋巴結轉移、臨床分期高和組織分化程度為中低分化的喉癌患者喉癌組織中CrkⅡ蛋白的陽性表達率較高,說明CrkⅡ蛋白可促進喉癌細胞的生長、侵襲和轉移。基因沉默指的是生物體中特定基因的表達被抑制或不表達的狀況,發生于兩個水平:①轉錄后基因沉默;②位置效應、DNA甲基化和異染色質化等導致轉錄水平內基因不表達[7]。RNAi是序列特異性的、天然的轉錄后基因沉默路徑,廣泛存在于真核生物內[8-10]。本研究采用RNA干擾技術將CrkⅡRNA干擾質粒轉染至Hep-2細胞,而后采用Western blot和實時PCR檢測CrkⅡRNA干擾質粒的干擾效率,結果顯示,實驗組Hep-2細胞中CrkⅡ在蛋白、mRNA水平上的表達水平均低于對照組,說明本研究采用CrkⅡ RNA干擾質粒將CrkⅡ基因成功敲除,使喉癌細胞株Hep-2中CrkⅡ的表達含量降低。
本研究中,MTT檢測結果顯示,實驗組Hep-2細胞的細胞活力低于對照組,且隨著時間的增長,實驗組Hep-2細胞的細胞活力降低得更加明顯,說明CrkⅡ表達下調抑制了Hep-2細胞的增殖能力。為了進一步將質粒和脂質體細胞毒性對細胞所產生的影響進行排除,本研究設立陰性對照組、空白對照組,結果顯示,兩個對照組細胞的增殖情況差異不明顯,說明細胞生長不受質粒與脂質體細胞毒性的影響。劃痕實驗結果顯示,實驗組細胞的遷移率低于陰性對照組、空白對照組,說明CrkⅡ表達下調能夠抑制Hep-2細胞的遷移能力。機體內的細胞遷移過程復雜,主要依賴于細胞外基質重塑、細胞與細胞外基質間附著變化、肌動蛋白細胞骨架協調重建和相關信號調節[11-13]。有研究顯示,整合素信號對p130Cas-Crk-Dock180復合物刺激后可將Racl激活,對形成黏著斑、偽足延伸與肌肉蛋白骨架重塑起調節作用,從而發生細胞遷移[14-15]。所以,整合素信號傳遞受影響與Hep-2細胞內CrkⅡ表達下調后其遷移能力受限可能有關系。Transwell侵襲與遷移實驗結果近似,說明CrkⅡ表達下調后,Hep-2細胞的侵襲能力也下降。研究顯示,腫瘤轉移、侵襲與CrkⅡ蛋白過表達有關,CrkⅡ蛋白過表達可造成腫瘤細胞出現上皮-間充質轉化,CrkⅡ過表達可激活下游效應因子Rap、Rac1,加速細胞擴散,同時CrkⅡ可通過抑制β-連環蛋白與E-鈣粘蛋白的聚集加速上皮黏附連接的分解,進而加速乳腺癌細胞的擴散[16]。同時,RNA干擾所介導的CrkⅡ基因沉默能夠使CrkⅡ表達下調后抑制腫瘤細胞的生長、侵襲與遷移。
綜上所述,喉癌細胞Hep-2中CrkⅡ的表達下調可明顯降低細胞的侵襲、遷移和增殖能力,CrkⅡ蛋白有可能成為喉癌臨床治療中的新靶點。

