中藥調控Nrf2 通路發揮腫瘤放射治療增敏作用的研究進展*
王 松,王 婷,蔣 剛△
(1. 電子科技大學醫學院,四川 成都 610054; 2. 四川省腫瘤醫院藥學部,四川 成都 610041)
Keap1- Nrf2- ARE 是細胞存活的重要防御機制之一,其主要功能是通過誘導多種基因的轉錄來激活細胞的抗氧化反應,從而抵抗細胞內外的各種損傷,如氧化應激、炎性反應和外來異物的損害[1]。研究發現,Nrf2的激活不僅能提高正常細胞的生存能力,還有助于腫瘤細胞對放化療的抵抗。腫瘤細胞中Nrf2 的累積可幫助其抵抗化學治療(簡稱化療)和放射治療(簡稱放療)所產生的氧化應激損傷,導致癌癥治療效率下降,甚至導致治療失敗[2]。據報道,腫瘤細胞通過異常激活Nrf2 信號通路實現放療抵抗[3-5]。目前尚無關于Nrf2 抑制劑在臨床使用或正在進行臨床試驗的相關報道,不過已發現一些中藥成分可通過調控Nrf2 達到放療增敏的效果。本研究中討論了腫瘤細胞放療抵抗發生機制及Nrf2 與放療增敏的關系,同時總結了中藥有效成分通過調控Nrf2 通路達到放療增敏效果的最新研究。
1 腫瘤細胞放療抵抗的發生機制
放療抵抗機制的形成通常由多個因素綜合導致。腫瘤干細胞內活性氧(ROS)清除劑的上調使得細胞內ROS 濃度降低,導致細胞的DNA 損傷修復能力增強,降低放射敏感性[6]。在放療抵抗的相關研究中,發現腫瘤細胞內大量出現抗氧化酶過度表達的現象,阻斷這些抗氧化防御機制可有效增強放射敏感性,促進腫瘤細胞凋亡[7]。因此,細胞中用于維持其氧化還原平衡的天然抗氧化系統與放療抵抗密切相關。
2 Nrf2 在腫瘤放療增敏中的作用
2.1 Nrf2 信號通路概述
Nrf2 屬CNC(Cap“n”Collar)家族的核轉錄因子,在保護細胞免受氧化應激和電離損傷中起重要作用[8]。一個完整的Nrf2 通路由Kelch 樣環氧氯丙烷相關蛋白-1(Keap1)、Nrf2 及ARE 3 個部分構成。
Nrf2 由7 個結構域組成(詳見圖1),依次命名為Neh1 至Neh7。Nrf2 通過ARE 可調控200 多種基因的表達,其中大部分基因都用于編碼解毒、抗氧化等[9]。Keap1 屬BTB-Kelch 蛋白家族,包括5 個主要功能域,詳見圖2。Keap1 是Nrf2 主要的細胞內調節因子,在穩態條件下,Nrf2 與細胞質中的Keap1 偶聯以進行泛素化,隨后通過蛋白酶體降解,以此維持在較低水平。當受到異生物質或氧化應激物刺激時,這種偶聯作用消失,Nrf2 在幾種蛋白激酶磷酸化作用下,發生核轉移,進入細胞核內,隨后與Maf 蛋白結合,再與ARE 結合,激活其下游靶基因中Ⅱ相解毒酶和抗氧化酶的表達[10-11]。詳見圖3。
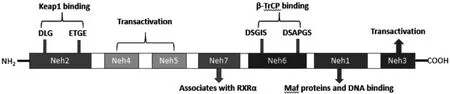
圖1 Nrf2 功能結構域示意圖
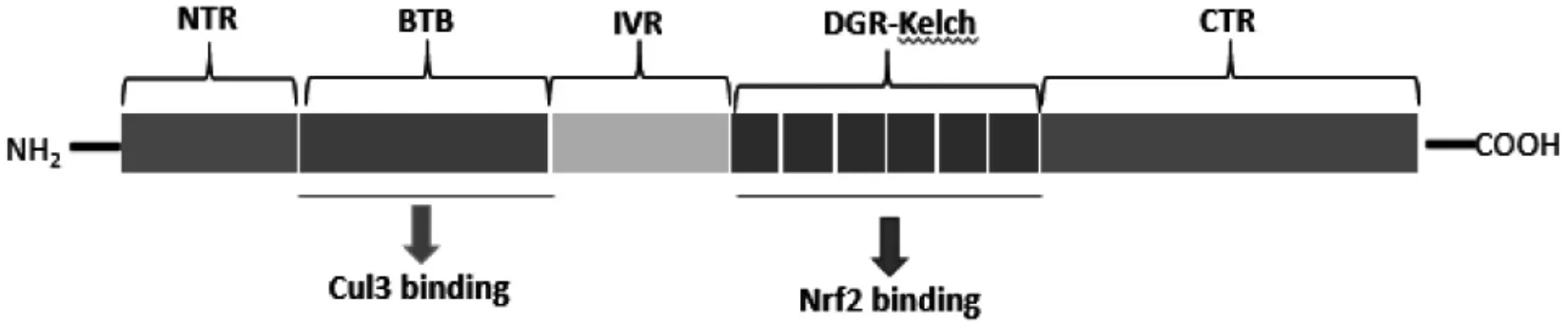
圖2 Keap1 功能結構域示意圖
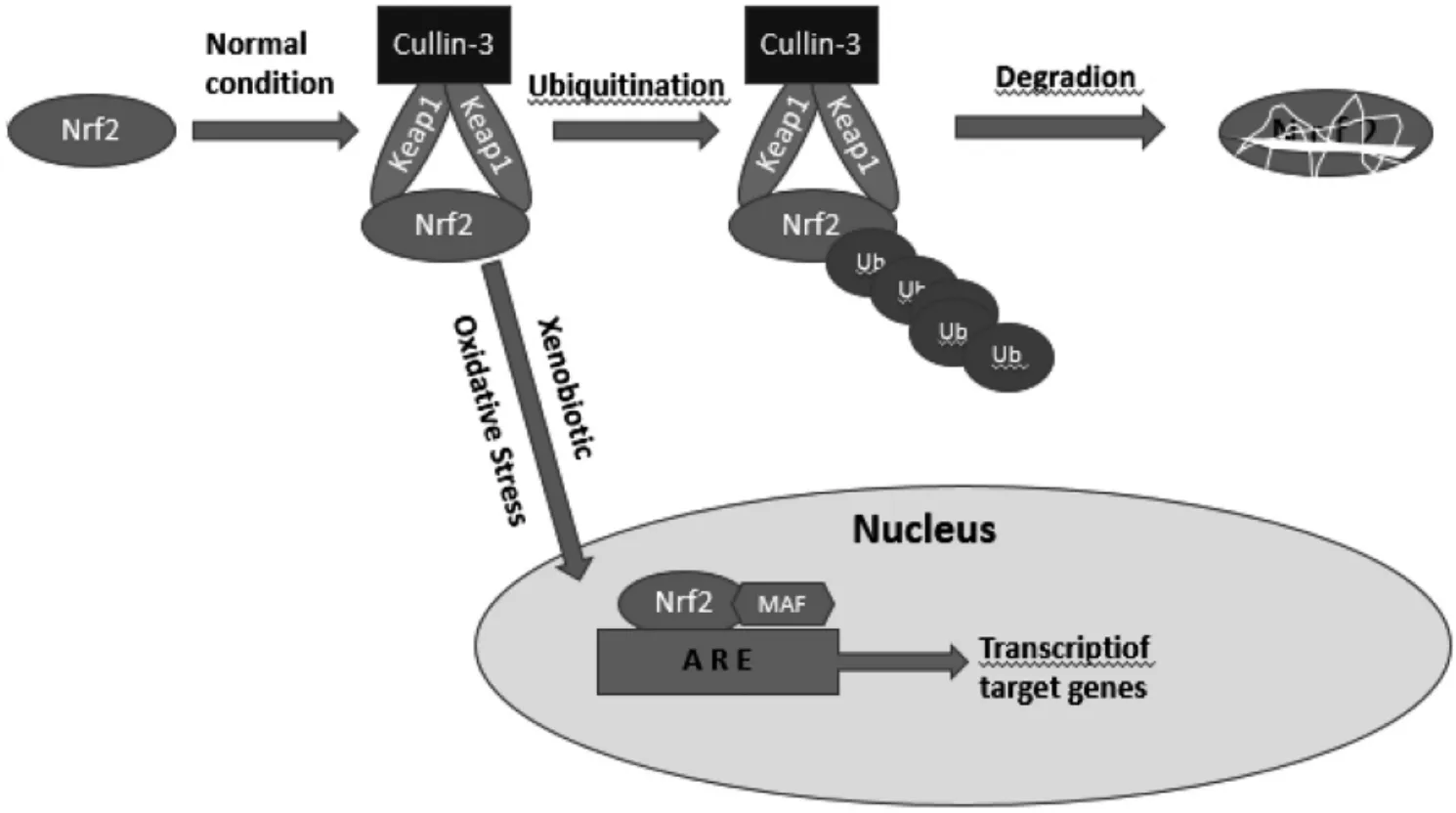
圖3 Nrf2 信號通路調控機制圖
2.2 腫瘤細胞中Nrf2 與放療增敏的關系
腫瘤細胞中Nrf2 的異常激活導致其下游抗氧化酶表達增加,使其抵抗氧化應激的能力相較于正常細胞大幅增加,ROS 的清除能力增強;同時,Nrf2 還可使DNA的損傷修復能力增強。這2 種都是腫瘤細胞產生放療抗性的主要機制,故調控腫瘤細胞中異常激活的Nrf2 及其下游基因的表達可達到放療增敏的效果。
參與腫瘤細胞中Nrf2 活化的途徑至少有4 種:1)體細胞內Nrf2,Keap1,Cul3 基因的突變,在腫瘤細胞中引起異常的Nrf2 活化;2)Keap1 基因的表觀沉默導致Keap1 的下調和Nrf2 上調;3)與Keap1 相互作用蛋白的積累,如p62/Sqstm1 和p21 可阻斷Nrf2 和Keap1 的結合,從而導致Nrf2 積累;4)通過富馬酸鹽等代謝物對半胱氨酸的修飾,影響Keap1 活性并導致Nrf2 積累[12]。Nrf2 異常激活后,再通過ARE 上調相關抗氧化酶的表達,從而腫瘤細胞內ROS 的清除增加,減輕放療對腫瘤細胞的殺傷。且抑制腫瘤細胞中過表達的Nrf2 及其所介導的抗氧化防御系統,可達到放療增敏的效果,使腫瘤細胞經放療后凋亡增加[13]。
Nrf2 與8-氧鳥嘌呤DNA 糖基化酶(OGG1)基因和53PB1 近端啟動子中的ARE 結合,從而增加DNA 修復蛋白的表達,使腫瘤細胞中DNA 的損傷修復增強[14]。在MCF-7和A549 腫瘤細胞中也發現,抑制Nrf2 會導致DNA 的修復能力明顯降低,且其修復能力并不依賴于ROS[15]。

表1 可通過調節Nrf2 信號通路實現放療增敏的中藥有效成分
3 中藥經Nrf2 調控在腫瘤放療增敏中的作用
在腫瘤治療中,中藥與化療、放療或靶向治療相結合可提高療效,減少相關不良反應及并發癥的發生,改善患者的生活質量,延長生存時間[16]。可通過調控Nrf2通路實現放療增敏的幾種中藥有效成分及其作用機制分別見表1 和圖4。
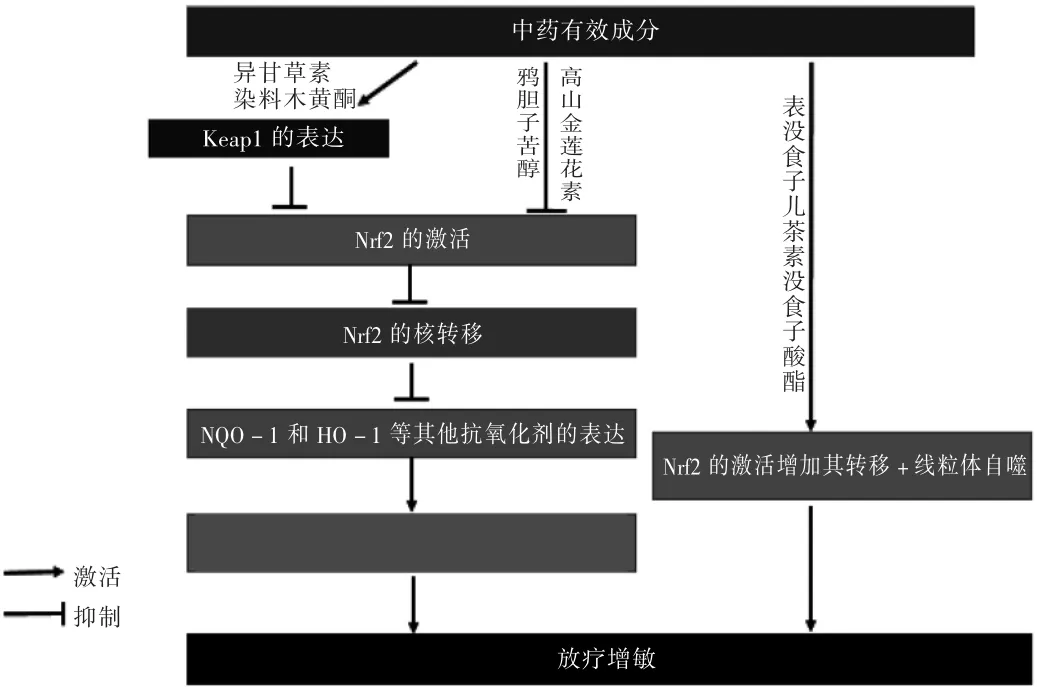
圖4 中藥有效成分調控Nrf2 實現放療增敏作用機制簡圖
鴉膽子苦醇:鴉膽子苦醇是鴉膽子中的苦木內酯類化合物,藥理活性廣泛,包括抗腫瘤、抗瘧疾、抗炎、抗病毒和殺蟲活性[23]。SUN 等[17]的研究結果表明,鴉膽子苦醇在增加A549 細胞放療敏感的試驗中,用80 nmol 鴉膽子苦醇處理4 h+6 Gy 照射聯合處理組,細胞中ROS水平比對照組增加1.8 倍,DNA 損傷加重,Nrf2 的蛋白表達水平比照射組顯著降低(P<0.05),細胞增殖速率明顯減緩(P<0.01)。可見,鴉膽子苦醇可使暴露于輻射后A549 細胞中Nrf2 的積累減少,從而使細胞中ROS 水平升高,DNA 損傷增強,達到放療增敏的效果。
異甘草素(ISL):是甘草的提取物,其在體內外均可顯著上調Nrf2 及其下游基因的表達,且隨著ISL 使用劑量的增多,Nrf2 蛋白表達增多[24-25],表明ISL 對Nrf2具有誘導作用。但SUN 等[18]發現,ISL 可通過干擾氧化還原狀態,從而提高HepG2 細胞的放射敏感性;其中涉及Nrf2 的下調,使HepG2 細胞內ROS 增加,引起其氧化應激對細胞的損傷增加,從而導致放射增敏。LIU等[9]發現,經過10 μg/mL ISL 處理6 h 后的HepG2 細胞選擇性地增強了Keap1 的轉錄和表達,使Keap1 有效誘導Nrf2 的泛素化降解,抑制Nrf2 向細胞核的轉移,導致Nrf2 下游基因表達降低,Nrf2 依賴性抗氧化系統被抑制,細胞內ROS 增加;且經過10 μg/mL ISL 6 h+4 Gy照射聯合處理可顯著增加HepG2 細胞凋亡及其克隆形成率(P<0.05)。可見,ISL 通過增加Keap1 表達抑制Nrf2 抗氧化途徑,最終通過對氧化還原狀態的干擾誘導氧化應激,從而使HepG2 細胞在體內外的放射敏感性均增強,表明ISL 具有放療增敏效果。
高山金蓮花素(AIF):也稱為貓尾草異黃酮,是一種從毛果魚藤中提取的黃酮類化合物,具有多種藥理作用,包括抗動脈粥樣硬化、抗菌等[26]。貓尾草主要分布于我國的廣西、貴州、云南。ZHANG 等[20]研究了AIF 在食管鱗狀細胞癌放療中的作用,發現5 μm AIF 24 h+6 Gy照射聯合處理后可顯著抑制食管鱗狀癌細胞中Nrf2 及其下游基因HO-1 和NQO-1 的表達,誘導細胞內ROS增多,使DNA 損傷加重,細胞凋亡增加(P<0.01);在敲除Nrf2 基因后發現,用AIF+照射處理后并未顯著增加癌細胞中的ROS,與Nrf2 未敲除細胞中ROS 的水平相似,且敲除Nrf2 后的AIF 失去了放療增敏作用。動物實驗結果顯示,AIF 20 mg/kg+2 Gy 照射聯合處理后,體內形成的腫瘤質量顯著小于對照組(P<0.01)。可見,AIF 通過抑制Nrf2 及其下游基因NQO-1 和HO-1的表達,從而增加輻射誘導的ESCC 細胞中ROS 的產生,達到放療增敏的效果。
染料木黃酮:是一種具有多種生物活性的天然異黃酮,主要存在于豆科植物中,藥理作用主要有抗炎、抗血管生成和抗癌活性[27]。LIU 等[21]研究發現,染料木黃酮可選擇性地對非小細胞肺癌(NSCLC)A549 細胞顯示放射增敏作用,但其對正常肺成纖維細胞MRC-5 無作用。研究發現,10μm 染料木黃酮經48h+ 4 Gy 照射后降低了A549 細胞Keap1 啟動子區域的甲基化水平,導致其mRNA 表達增加,有效抑制Nrf2 向細胞核的轉移,進而抑制Nrf2 依賴性抗氧化酶的表達,使得細胞內ROS 上調,對細胞的損傷加重,細胞中NQO1 蛋白的表達被顯著抑制(P<0.01)。兩者聯合處理后,A549 細胞存活分數、生長速度均明顯低于對照組(P<0.01)。可見,染料黃木酮可通過抑制Keap1 啟動子區域的甲基化,進一步抑制Nrf2 及其下游基因的表達,從而導致其對NSCLC 的A549 細胞實現放療增敏作用。
表沒食子兒茶素沒食子酸酯(EGCG):是綠茶中的主要多酚物質,屬黃烷醇類,具有強抗氧化性和抗癌性,在癌癥的預防、發生和發展過程都有治療作用[28]。ENKHBAT 等[22]報道指出,EGCG 通過Nrf2 信號通路使結直腸癌細胞達到放療增敏的效果。12.5μmol EGCG經24 h+2 Gy 照射聯合治療后,結腸癌細胞HCT116 的克隆形成率顯著降低(P<0.05),聯合處理后細胞自噬及凋亡相關的mRNA 和蛋白(LC-3 及caspase-9 mRNA)表達水平增加,由于Nrf2-Keap1-P62 通路所促進的細胞自噬是維持細胞穩定狀態的一個基本降解機制。細胞自噬中的線粒體自噬在腫瘤微環境中,通過清除腫瘤細胞中功能失調的線粒體可發揮抗腫瘤作用。可見,EGCG 和放射聯合治療可誘發腫瘤細胞中的線粒體自噬,從而導致腫瘤細胞的凋亡。
其他潛在增敏藥物:克羅苷元是從牛角瓜中提取出來的,可抑制Nrf2 及其驅動的抗氧化劑分子NQO-1的表達,使A549 細胞實現放療增敏[29]。栗子葉提取物或可通過抑制Nrf2 增加乳腺癌CSCs 對抗癌藥紫杉醇的敏感性,實驗發現其可顯著降低MCF-7 來源的CSC中Nrf2 的核轉移和抗氧化酶蛋白的表達[30]。常春藤皂苷元是從常春藤葉中提取的三萜類化合物,可抑制Nrf2-ARE 途徑,并激活頭頸癌細胞中的P53,從而增強ROS 產生,并促進谷胱甘肽耗竭,誘導耐藥頭頸癌細胞的凋亡[31]。鈴蘭毒苷是類洋地黃化合物,最新研究發現,其對Nrf2/ARE 有抑制作用,且其抑制機理不是通過轉錄介導的,而是通過蛋白水解調節的[32]。漢黃芩素來自于藥用植物黃芩,黃芩廣泛用于治療各種疾病,包括炎癥、過敏反應、腫瘤、腹瀉等,能減少Nrf2 的核轉移,提高細胞內ROS 水平,進而殺死腫瘤細胞[33],其主要通過減少Nrf2 mRNA 轉錄下調Nrf2 表達[34]。
4 小結
中藥是腫瘤輔助治療的重要組成部分,已進行的基礎和臨床研究表明,中藥在抑制腫瘤進展,提高放療、化療、靶向治療的敏感性方面具有優勢。Nrf2 在腫瘤的預防及進展中的雙重作用決定了其特殊性,中藥成分可通過誘導Nrf2 及其靶向基因的表達在協調機體抵抗氧化應激所帶來的損傷,但在腫瘤細胞中由于Nrf2 的過表達,抵抗氧化應激的增強導致放療抵抗。中藥成分亦可通過調控Nrf2 實現放療增敏,且同一中藥有效成分對Nrf2 通路的調控在不同實驗中也存在差異。異甘草素、高山金蓮花素、染料木黃酮通過抑制Nrf2 表達可實現放療增敏作用,但也可作為Nrf2 激活劑,有助于細胞抵抗氧化應激。因此,目前仍需進一步研究同一中藥成分在不同細胞中對Nrf2 的調控存在差異的原因,以及由于Nrf2 雙重作用的存在,中藥成分通過Nrf2 達到放療增敏時對機體整體的綜合作用。

