去勢法構建骨質疏松癥模型大鼠肱骨與股骨骨組織形態計量學比較
劉月姝 江國健 梁志健
(廣東省醫學實驗動物中心,廣東佛山 528248)
骨質疏松癥(osteoporosis,OP)是一種系統性骨病,原發性骨質疏松癥以骨量減少,骨小梁變細、斷裂、數量減少,骨皮質多孔、變薄為特征[1]。構造實驗動物骨質疏松癥模型有多種方法,其中,去勢法最為常用的方法[2]。骨組織形態計量學、簡稱骨計量學,近年來被廣泛用于骨質疏松等代謝性骨病發生機制、藥效學及各種防治手段的研究[3]。本試驗選擇去勢SD大鼠骨質疏松癥模型動物,比較肱骨及股骨的組織學、及骨組織計量學是否存在差異,以便在動物實驗中選擇最佳部位用以評價骨質疏松癥模型。
1 材料與方法
1.1 實驗動物及分組
雌性3月齡SPF級SD大鼠20只,由廣東省醫學實驗動物中心提供,實驗動物生產許可證號SCXK(粵)2018-0002。動物實驗經中心實驗動物倫理委員會審查批準。動物隨機分為2組,假手術組、模型組,各組10只動物。
1.2 主要試劑
注射用青霉素鈉,華北制藥集團動物保健品有限責任公司,批號1809 8,石蠟,廣東大川特種蠟有限公司,批號:20191013,環保透明劑,武漢宏茲生物技術有限公司,批號:2020010602,無水乙醇,廣州化學試劑廠,批號:2019120213,曙紅(醇溶),國藥集團化學試劑有限公司,批號:20190820,蘇木素,上海麥克林生化科技有限公司,批號:C10529154,甲醛溶液,西隴科學股份有限公司,批號200417 2。
1.3 主要儀器
BS-3000A型電子天平,上海浦春計量儀器有限公司,感量:0.1g;ASP300S型生物組織全自動脫水機,LEICA,德國;EG1150型生物組織包埋機,LEICA,德國;AutoStainer-XL型自動染色機:LEICA?,德國。BX43型生物顯微鏡:OLYMPUS,日本。CellSens Standard顯微圖像軟件:OLYMPUS,日本。
1.4 實驗方法
1.4.1 去勢手術方法
腹腔注射3%戊巴比妥鈉麻醉,注射體積為1.5ml/kg。俯臥位于手術板上,背部中下部皮膚備毛,75%乙醇消毒,背部中下部作1~2cm縱行切口,止血鉗伸入切口向兩側進行鈍性分離,使背部皮膚與肌層分離。移動切口,使切口位于左右兩側腹后壁肌肉層較薄處打開腹腔,切口盡量小,暴露乳白色條帶狀脂肪團,于其中找出淡紅色卵巢。0號縫合線于卵巢和子宮的連接處結扎,另結扎卵巢下方脂肪團,避免剪除卵巢時傷及脂肪團里血管,引起出血。結扎后剪除卵巢,將子宮輕輕置回入腹腔,逐層縫合,碘伏消毒創口。假手術組動物不摘除卵巢,只剪除卵巢周圍的脂肪組織,大小與卵巢相當即可,其余操作同上。術后動物肌肉注射青霉素注射液,8萬單位/只,連續注射3d,以防動物術后感染。術后常規飼養12周。
1.4.2 組織學評價方法
實驗結束,麻醉放血處死動物,解剖取出左側肱骨及股骨,用紗布除去骨干周圍附著的肌肉組織后用4%中性甲醛固定72h以上。使用Plank-Rychlo脫鈣液脫鈣,脫鈣后的骨組織經手捏富彈性、用取材刀的刀鋒輕刮骨髓表面無沙沙聲時脫鈣結束,留取肱骨及股骨近端、取正中矢狀面經脫水、透明、浸蠟、石蠟包埋、切片(厚度3μm)、HE染色后,于光學顯微鏡下觀察骨組織形態。
1.4.3 骨組織計量學參數測定方法
選取骨骺生長板以下1~3mm范圍的區域拍攝40×照片,使用顯微圖像軟件測量骨組織面積(T.Ar)、骨小梁面積(Tb.Ar)以及骨小梁周長(Tb.Pm),按照計算公式計算骨小梁面積百分數、骨小梁厚度、骨小梁數量以及骨小梁分離度。
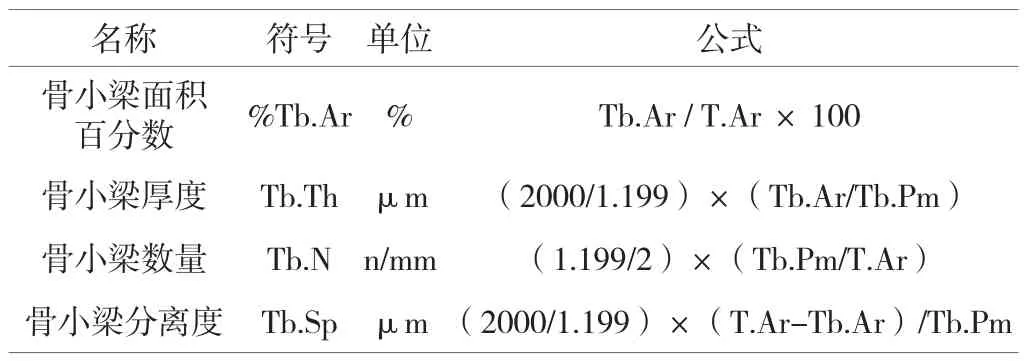
表1 骨組織計量參數計算公式[4]
1.5 統計學方法
所有數據以均數±標準差(M±s)表示,應用SPSS22.0軟件進行統計分析,采用獨立樣本T檢驗,P<0.05時差異顯著,P<0.01時差異極顯著。
2 結果
2.1 病理組織學變化(圖1)
假手術組動物肱骨及股骨結構基本正常,骨皮質未見變薄,骨小梁致密,骨髓腔大小正常,高倍視野下,骨小梁周圍可見成骨細胞、偶見或未見破骨細胞。模型對照組動物肱骨及股骨骨皮質變薄、股骨變化更明顯,肱骨及股骨骨小梁變細、斷裂不連續、數量減少、排列稀疏,骨髓腔擴大、骨髓脂肪組織增生,高倍視野下,骨小梁周圍成骨細胞減少、易見破骨細胞。
2.2 骨計量學參數結果
術后12周,肱骨及股骨的模型組骨組織計量學參數較假手術組可見明顯變化:其中,骨小梁面積百分數、骨小梁厚度、骨小梁數量極顯著(P<0.01)下降,骨小梁分離度極顯著(P<0.01)升高。肱骨與股骨之間比較:可見假手術組骨小梁面積百分數存在極顯著(P<0.01)差異、骨小梁分離度存在顯著(P<0.05)差異,假手術骨小梁厚度和骨小梁數量未見顯著差異(P>0.05);模型組骨小梁面積百分數、骨小梁數量、骨小梁分離度存在極顯著(P<0.01)差異。
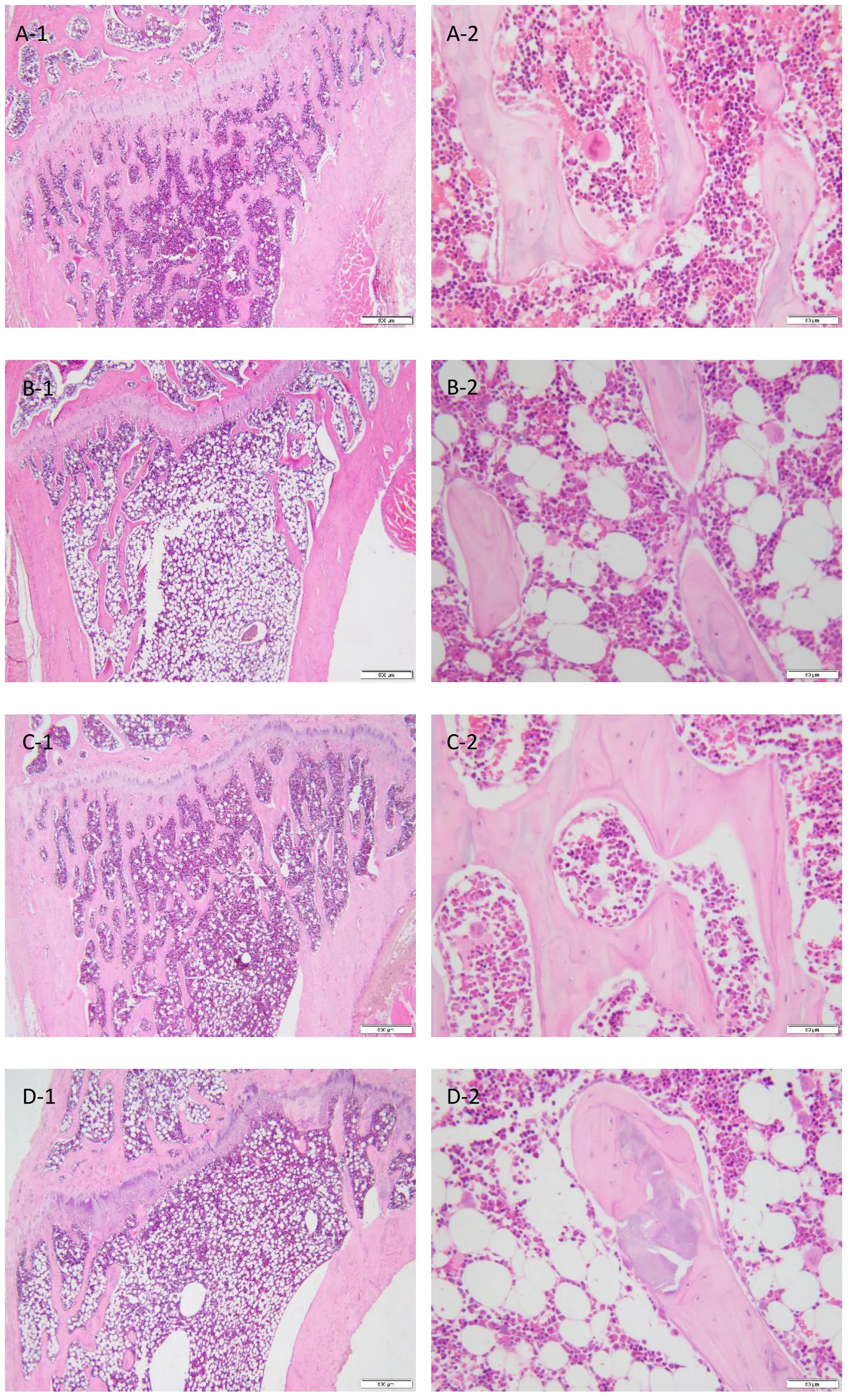
圖1 各組大鼠肱骨及股骨組織病理學變化(-1:HE ×40,-2:HE ×400)
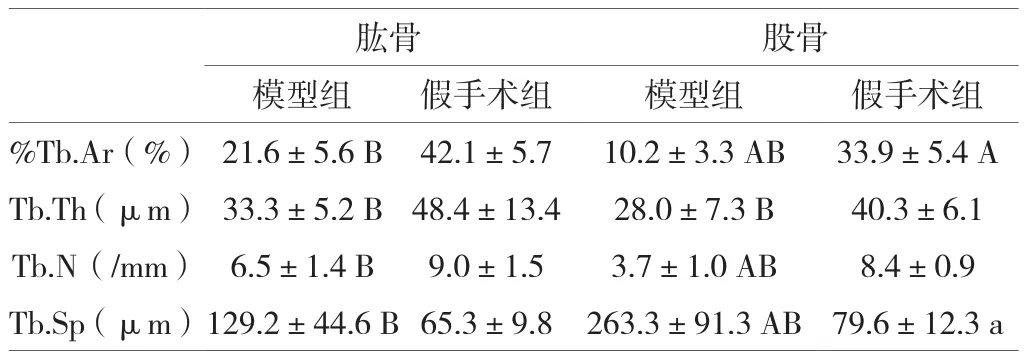
表2 骨計量學參數比較(n=10)
3 討論
臨床上,絕經后骨質疏松癥是危害人類健康的常見病之一。骨質疏松癥的發生是由于骨細胞活動失衡,破骨作用大于成骨作用,致使總骨量降低,從而導致骨骼強度降低,臨床表現為骨折風險增加,骨骼畸形、嚴重疼痛,有時甚至引起死亡[5]。構建骨質疏松癥動物模型最常用的方法是去勢法,尤其在雌性動物,能夠看到更好的造模效果[6]。這是因為雌性動物經手術去勢,由于體內雌激素含量降低、破骨細胞受到的抑制作用減弱,最終因破骨作用大于成骨作用而使得骨組織微結構發生變化,骨質丟失、骨量減少,出現類似于臨床所見的女性絕經后骨質疏松癥的一系列變化[7]。
治療骨質疏松癥的藥物,主要包括鈣劑、維生素D、抗消化劑如雌激素、雙膦鹽酸,以及合成類固醇,但這些藥物在實現治療效果的同時也會有一系列副作用[8],因此,尋找更好的藥物以期治療或者預防骨質疏松癥,成為骨質疏松癥研究的熱點。判斷藥效及藥物安全性,首先需要通過動物實驗來實現,而去勢大鼠骨質疏松癥模型是常用的實驗動物。在動物實驗中,為了獲得更多指標作為判斷依據、同時遵循動物實驗的“3R”原則,不少研究者會選擇同一例動物不同部位的骨組織去做不同的指標檢測,選擇的部位通常有肱骨、股骨、脛骨、椎骨等,檢測的內容有骨密度、骨鈣等元素、骨組織學、骨計量學、骨生物力學等。其中,股骨和肱骨為常選部位、骨松質組織計量學靜態參數為常測指標[9-19]。
骨計量學,屬于體視學、生物醫學組織形態計量學的特殊分支之一,該方法能夠將形態學觀察到的骨組織結構改變,轉化為定量的參數,從靜態和動態兩個方面評價骨組織的變化、精確反映骨重建過程的變化規律和特點[20]。骨計量學參數中的骨小梁面積百分數、骨小梁厚度、骨小梁數量以及骨小梁分離度屬于骨松質組織計量學靜態參數,是反映骨組織形態結構及骨量變化的重要指標。骨小梁面積百分數反映骨量的多少,用以評價骨量變化,骨小梁厚度以及骨小梁數量都反映骨小梁形態結構、間接反映了骨量的變化,骨小梁分離度反映了骨小梁之間的平均距離、即骨小梁的疏密程度。
本試驗中,雌性SD大鼠去勢手術后12周,肱骨及股骨的組織學檢查結果和骨計量學測定結果均反映了模型動物骨量減少、骨質丟失,再次驗證了去勢構建SD大鼠骨質疏松癥模型方法具有高效、穩定的特點。假手術組,股骨骨小梁面積百分數和骨小梁分離度明顯低于肱骨、存在統計學差異,說明股骨骨松質骨量、骨松質密度可能在造模之前就低于肱骨。造模后,除以上兩個參數外、股骨的骨小梁數量亦明顯低于肱骨、可見統計學差異,結合組織學見到的骨小梁變細、斷裂等變化,可推斷造模后12周,股骨的結構變化更為明顯、骨量丟失更為嚴重,由此可見不同部位長骨的骨重建過程本身存在明顯差異、造模后的變化亦存在明顯差異,這一現象對藥效試驗的結果判定可能有潛在影響。在同等條件下,變化明顯的部位,更適于評價藥效。
綜上所述,本試驗證明采用去勢法構建的雌性大鼠骨質疏松模型,在造模后12周,股骨的骨組織計量參數變化較肱骨更為明顯,評價藥效時可優先選擇股骨作為檢測骨組織計量參數的對象。

